太行山野生艾蒿挥发油抗菌活性研究
朱红霞 李鹏 朱英慧 胡林峰 陈锡岭


摘要:为研究太行山野生艾蒿(Artemisia argyi)挥发油的抗菌活性,采用水蒸气蒸馏法提取获得艾蒿挥发油,并以生长速率法和抑菌圈法分别测定其对5种植物病原真菌和4种病原细菌的抑菌活性。结果表明,艾蒿挥发油对水稻纹枯病菌(Thanatephorus cucumeris)、番茄灰霉病菌(Botrytis cinerea)和辣椒疫霉病菌(Phytophthora capsici)等3種供试植物病原真菌的EC50均低于0.100 mg/mL;在0.050 mg/mL浓度下,对金黄色葡萄球菌(Staphylococcus aureus)的抑菌圈直径大于30 mm,对枯草芽孢杆菌(Bacillus subtilis)和炭疽杆菌(B. anthraces)表现出中等强度抗菌活性,抑菌圈直径介于20~30 mm。
关键词:艾蒿(Artemisia argyi);挥发油;病原真菌;细菌;抗菌活性
中图分类号:O629 文献标识码:A 文章编号:0439-8114(2018)04-0060-04
DOI:10.14088/j.cnki.issn0439-8114.2018.04.015
Study on the Antimicrobial Activities of Essential Oil Extracted from Wild
Artemisia argyi in Taihang Mountains
ZHU Hong-xia, LI Peng, ZHU Ying-hui, HU Lin-feng, CHEN Xi-ling
(Henan Institute of Science and Technology, Xinxiang 453003,Henan,China)
Abstract: Essential oil from wild Artemisia argyi in Taihang Mountains was extracted by steam distillation. Growth rate method and oxford cup method were applied to test the antimicrobial activities against five plant pathogenic fungic and four bacteria. The results showed that the EC50 of essential oil were lower than 0.100 mg/mL against Thanatephorus cucumeris,Botrytis cinerea and Phytophthora capsici. And the diameter of inhibition zone was more than 30 mm against Staphylococcus aureus under the concentration of 0.050 mg/mL. Moderate inhibition activities were determined against Bacillus subtilis and B. anthraces,and the diameter of inhibition zone located among 20~30 mm under the same concentration.
Key words: Artemisia argyi; essential oil; plant pathogenic fungic; bacteria; antimicrobial activity
植物是生物活性化合物的巨大天然宝库,其产生的次生代谢产物超过40万种,这些物质中很多具有抑菌作用,是发现新杀菌剂和杀菌化合物的较好开发资源,对农药的开发和利用有重要的意义。植物源农药具有低毒、低残留、与环境和谐、符合现代环保和人类健康需求的优点,越来越引起世界各国高度重视,近几年掀起了一个研究开发植物源农药的高潮。在仿生杀菌剂研究中,植物被公认为是筛选先导化合物的最佳资源,因此开发利用植物资源用于有害生物防治的前景十分广阔。
长期的实践经验和药理研究表明,艾蒿(Artemisia argyi)具有很好的防霉、抑制病原细菌的能力,对部分植物病虫害也有一定的作用。艾蒿挥发油的抗菌活性一直以来得到科研人员的关注[1]。已有研究表明,艾蒿挥发油对金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli)、黑曲霉(Aspergillus nige)等微生物具有较强的抑制作用[2-4]。艾蒿挥发油以及丙酮提取物对植物病原真菌也表现出一定的生物活性,对棉花枯萎病菌(Fusarium oxysporum)、辣椒疫霉病菌(Phytophthora capsici)、水稻纹枯病菌(Thanatephorus cucumeris)和苹果腐烂病菌(Valsa mali)均表现出不同程度的抑制作用[3,5]。艾蒿提取物还能够影响昆虫的正常生理活动,干扰昆虫产卵及发育[6,7]。
河南太行山区地理位置特殊,孕育了丰富的植物资源,其出产的艾蒿及其生物活性未见报道。为了有效地利用艾蒿这一植物资源,充分发掘艾蒿的功用,为艾蒿抗菌产品的开发提供新的发展方向,本研究对其挥发油进行提取,并分析挥发油成分,测试挥发油对植物病原真菌和病原细菌的生物活性。
1 材料与方法
1.1 供试生物材料
艾蒿于2016年6月采于河南省辉县市关山地区,室内晾干后冷藏保存备用。
供试真菌:棉花黄萎病菌(Verticillicum dahliae)、小麦赤霉病菌(Gibberellins zeae)、水稻纹枯病菌、灰霉病原菌(Botrytis cinerea)、辣椒疫霉病菌。
供试细菌:金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、炭疽杆菌(B. anthraci)、沙门氏菌(Salmonella typhimurium)。
1.2 仪器与试剂
仪器:电热套、圆底烧瓶、球形冷凝管、高压蒸气灭菌器、电热恒温鼓风干燥箱、超净工作台、霉菌培养箱。
药剂:乙醚、氯化钠、琼脂、葡萄糖、牛肉膏、蛋白胨、吐温-40,试剂均为分析纯。
1.3 挥发油的提取
将艾叶粉碎,称取50 g置于2 000 mL圆底烧瓶中,加入1 000 mL去离子水,超声波振荡20 min后开始蒸馏。收集馏出液500 mL后加入500 mL去离子水继续蒸馏,两次共得到1 000 mL的馏出液。向馏出液中加入氯化钠使饱和,再用等体积的乙醚萃取3次,合并后浓缩除去乙醚,经无水硫酸钠干燥后即得艾蒿挥发油。
1.4 培养基的配制
马铃薯葡萄糖琼脂(PDA)培养基:称取200 g马铃薯,洗净去皮切片,加水1 000 mL煮沸20 min,用四层纱布过滤后加水补足至1 000 mL,再加12 g葡萄糖和12 g琼脂粉,煮沸待琼脂粉完全熔化后用三角瓶分装,在121 ℃下高压灭菌20 min,冷却后贮存备用。
牛肉膏蛋白胨液体培养基:称取牛肉膏3.0 g、蛋白胨5.0 g,加少量水加热搅拌使其熔化,补充水至1 000 mL,调pH至7.2~7.4,分装在三角瓶中,在121 ℃下高压灭菌20 min,冷却后贮存备用。
牛肉膏蛋白胨固体培养基:在上述液体培养基基础上,加琼脂15.0 g,分装在三角瓶中,在121 ℃下高压灭菌20 min,冷却后贮存备用。
1.5 GC-MS分析条件
气相色谱分离采用TR-5MS(30 m×25 mm×25 μm)石英毛细管柱,载气为高纯氦,载气流量1.0 mL/min,进样量1 μL,进样口采用不分流模式。色谱柱采用程序升温:初始温度40 ℃,保持1 min后,以3 ℃/min升至100 ℃,保持10 min,以5 ℃/min升至200 ℃,保持10 min,再以5 ℃/min升至250 ℃,保持15 min。质谱分析采用Trace DSQII型气相色谱质谱联用仪(Thermo公司),色谱柱及色谱柱程序升温条件同上。载气为高纯氦,分流比为1∶50;质谱接口温度为280 ℃,电离方式EI,离子源温度280 ℃,电子能量70 eV,质量扫描范围为40~500 amu,检索谱库为Nist05。
1.6 抗菌活性测定
采用生长速率法测定艾蒿挥发油药剂对5种病原真菌的离体抑菌活性。首先用丙酮配制成浓度为9.792 00~0.076 50 mg/mL的一系列溶液,用移液枪移取1 mL的稀释液于刻度试管(20 mL或25 mL)中,再加入融化好的培养基至10 mL,充分混匀后倒入灭菌后的培养皿中,放置在平台上冷却后即制成带药平板。试验过程中设置溶剂对照,每个处理重复3次。将预先在PDA培养基上预培养7 d的真菌用打孔器打出直径为4 mm的菌饼,用接种针把菌饼倒扣(菌丝面朝下)在带药平板上,在25 ℃霉菌培养箱中培养72 h,用十字交叉法测量菌落直径,按以下公式计算菌落生长抑制率,并采用DPS软件进行毒力曲线计算及多重比较(Duncan氏新复极差法)。
抑制率=(对照组菌落平均直径-处理组菌落平均直径)/(对照组菌落平均直径-菌饼直径)×100%
采用牛津杯抑菌圈法[8]测定艾蒿挥发油对4种细菌的抑菌活性。用0.2%吐温-40水溶液将挥发油配制成0.100、0.050、0.010、0.005、0.001 mg/mL等系列浓度。将所需细菌转接于液体培养基中,37 ℃培养24 h。按2∶1(v/v)将融化冷却至50 ℃左右的牛肉膏蛋白胨固体培养基与转接培养过的牛肉膏蛋白胨液体培养基混匀,每培养皿倒入15 mL。待培养基冷却后,用无菌镊子将牛津杯轻轻放入培养皿中。吸取配制好的供试药品0.2 mL加入牛津杯,以不含藥液的溶剂为对照,在25 ℃条件下培养24 h测定结果。
2 结果与分析
2.1 艾蒿挥发油的提取
艾蒿叶经水蒸气蒸馏及乙醚萃取最终得淡黄色艾蒿挥发油,出油率为0.606 9%。
2.2 挥发油成分分析
用毛细管气相色法从艾叶挥发油中共分离出84个峰,采用气相色谱数据处理系统,以面积归一化法测得挥发油各组分相对含量。按“1.5”GC-MS条件对艾叶挥发油进行分析,得其总离子流如图1所示。
对总离子流中的各峰经质谱扫描后得到质谱图,经过计算机数椐库系统检索和人工谱图解析,鉴定出艾叶挥发油中的化学成分62种,占峰面积的97.58%,结果见表1。由表1可以看出,艾蒿挥发油中含量最高的是桉树脑(26.89%),其次为1,2-邻苯二甲酸-(2-乙基己基)酯(11.22%),化合物类型以烯、醇、酮、芳香化合物为主,含氧化合物占挥发油总量的60%以上。挥发油中含量最高的桉树脑为已知活性萜类,其他多种组分,如桉油精、异龙脑、匙叶桉油烯醇、红没药烯环氧化物、植醇、香芹酮、紫苏醛等化合物。在检出上述化合物的同时,还从艾蒿挥发油中鉴定出羽扇烯酮、羽扁豆醇、α-香树脂醇、乌苏烷-12-烯-24-甲酸-3-氧甲酯、正三十七醇、4,4, 6a,6b,8a,11,11,14b-Octamethyl-1,4,4a,5,6,6a,6b,7,8,8a,9,10,11,12,12a,14,14a,14b-octadecahydro-2H-picen-3-one等高分子量化合物,这些化合物在已有文献中未曾报道过。这些差异可能与艾蒿的产地、气候、生长环境以及提取方法、检测手段等有着密切的关系,这些成分的检出对深入研究艾蒿挥发油的生物活性具有重要意义。
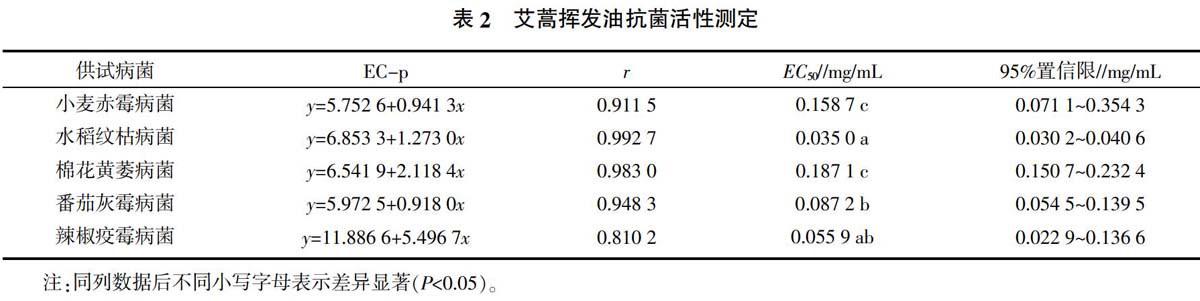
2.3 艾蒿挥发油抗菌活性测定
采用生长速率法[9]测定艾蒿挥发油对5种病原菌的抑制作用,抗菌效果见表2。由表2可知,艾蒿挥发油对水稻纹枯病菌的抗菌效果显著好于除辣椒疫霉病菌外的其他病菌,EC50为0.035 0 mg/mL,对辣椒疫霉病菌的抗菌效果次之,EC50为0.055 9 mg/mL。艾蒿挥发油对小麦赤霉病菌和棉花黄萎病菌的抗菌效果较差,EC50高于0.150 0 mg/mL。测试中发现,当挥发油浓度高于1 mg/mL时,能够完全抑制5种病原菌的生长。
牛津杯法测定结果(表3)表明,艾蒿挥发油对金黄色葡萄球菌和大肠杆菌抗菌效果最好,其次是炭疽杆菌和枯草芽孢杆菌,对沙门氏菌仅在高供试浓度(0.10 mg/mL)下表现出微弱的抗菌活性。
3 小结与讨论
对太行山区艾蒿挥发油的成分及抗菌活性进行研究,经GC-MS分析,从挥发油中分离鉴定出62种化合物。艾蒿挥发油成分分析中采用更宽的质量扫描范围,从而鉴定出多种高分子量且含量较高的化合物,这些化合物在以往的研究中均未发现。抗菌活性测定表明,艾蒿挥发油在0.1 mg/mL浓度下即对供试植物病原真菌和供试病原细菌表現出强烈的抗菌作用,其活性优于艾蒿传统用材[3,10]。由此可见,太行山区所出产的艾蒿,其挥发油具备较好的抗菌活性,在日常病原细菌的防治以及植物病原真菌杀菌剂的开发中具有潜在的研究价值。
参考文献:
[1] 胡林峰,崔乘幸,吴玉博,等.艾蒿化学成分及其生物活性研究进展[J].河南科技学院学报(自然科学版),2010,38(4):75-78.
[2] 段伟丽,刘艳秋,包怡红.艾蒿精油的抑菌活性和稳定性[J].食品与生物技术学报,2015,34(12):1332-1337.
[3] 吴朝霞,夏天爽,李 琦,等.同时蒸馏法提取艾叶挥发油及其抑菌性研究[J].食品研究与开发,2010,31(8):19-22.
[4] 黄建华,孟昭礼.艾蒿农用杀菌抑菌作用研究[J].当代生态农业,2005,14(1):111-113.
[5] 李玉平,冯俊涛,邵红军,等.25种菊科植物提取物对3种植物病原菌的药效试验[J].西北农林科技大学学报,2003,31(4):123-126.
[6] 张玲春,李国清,刘泽文.艾蒿抽提物对甜菜夜蛾产卵的影响[J].南京农业大学学报,2002,25(4):110-112.
[7] 张玲春,刘泽文,李国清,等.艾蒿提取物及其不同柱层析馏分对甜菜夜蛾产卵行为的影响[J].农药学学报,2003,5(2):59-63.
[8] WANG Y,LU Z,WU H,et al. Study on the antibiotic activity of microcapsule curcumin against foodborne pathogens[J].International Journal of Food Microbiology,2009,136(1):71-74.
[9] 万红娟,赵 特,董红平,等.旋覆花不同部位提取物对辣椒疫霉菌的生物活性研究[J].河南农业大学学报,2012,46(3):313-316,321.
[10] 洪宗国,周西友,伊 定,等.艾油抑菌作用研究[J].中南民族学院学报(自然科学版),1995,14(1):57-59.

