豆粕粒度及容器堆料对地衣芽孢杆菌实验室固态发酵效果的影响
王若愚,赵若恒,宋增磊,宋晓玲,黄 倢*
(1.大连海洋大学水产与生命学院,辽宁大连116023;2.中国水产科学研究院黄海水产研究所,青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室,农业部海水养殖病害防治重点实验室,青岛市海水养殖流行病学与生物安保重点实验室,山东青岛266071;3.上海海洋大学水产与生命学院,上海 201306)
豆粕的供给来源丰富,价格稳定[1],具有丰富的营养成分,是我国重要的植物性蛋白原料[2]。但由于豆粕含有多种抗营养因子[3-4],氨基酸组成不平衡[5],影响养殖动物对其营养物质的吸收。地衣芽孢杆菌是农业部第2045号公告批准使用的饲料级微生物添加剂[6]。地衣芽孢杆菌在形成芽孢后,具有耐高温、耐酸碱、耐挤压等特点,在饲料的加工过程中不易失活且能够在饲料保存过程中长期稳定存在[7]。利用微生物发酵豆粕可以显著降低豆粕抗营养因子含量,同时发酵产生的菌体蛋白能够平衡豆粕的氨基酸组成,提高其营养价值[8-10]。发酵豆粕的生产主要分为酶解和固态发酵,我国大多数发酵豆粕生产采用固态发酵工艺[11-12]。
笔者所在实验室在前期研究工作中,从凡纳滨对虾消化道中分离到1株地衣芽孢杆菌,该菌株具有提高对虾细胞和体液的免疫水平,特别是增强对虾抗病毒感染能力的生物学活性。笔者对地衣芽孢杆菌实验室小规模豆粕固态发酵工艺进行了优化,在建立豆粕内活菌的有效计数方法的基础上,分析不同混匀方式对发酵豆粕中菌量计数的影响,研究不同发酵容器、豆粕粒径和堆料厚度对发酵豆粕菌浓度的影响,以确定实验室小试固态发酵的最佳条件。
1 材料与方法
1.1材料
1.1.1豆粕。豆粕于2017年7月25日购自山东龙口香驰粮油有限公司,粗蛋白含量≥46%,粗纤维含量≤4.5%,粗灰分含量≤7.0%。
1.1.2菌种。发酵所使用地衣芽孢杆菌是2011年从山东青岛胶州某养殖场工厂化养殖的凡纳滨对虾消化道中分离获得,使用2216E甘油保种液保存于-80 ℃冰箱中。
1.1.3培养基。2216E液体培养基100 mL含0.5 g蛋白胨(Typtone)、0.1 g酵母膏(Yeast Extract)和0.001 g四水合磷酸铁(FePO4·4H2O),用陈海水溶解,定容至100 mL。2216E固体培养基是在上述培养基中添加2.0 g琼脂(Agar Powder)配制而成。所有培养基在各成分溶解后混合。
1.2方法
1.2.1菌种活化及富集培养。菌种经平板划线活化,挑取单菌落接入100 mL 2216E液体培养基中,在28 ℃、150 r/min条件下过夜培养至菌浓度为108CFU/ mL。菌液使用前测定其OD600,确定每次试验的接种量。
1.2.2豆粕发酵前的预处理。豆粕经粉碎后,逐级过筛,各级筛下物经高压灭菌锅121 ℃高压灭菌20 min,在烘干箱中37 ℃烘干24 h。
1.2.3豆粕的发酵。称取50.00 g经预处理的豆粕置于无菌研钵中,将结块的豆粕研磨成灭菌前相同粒度的粉末,置于无菌食品袋中。将34 mL无菌水、1 mL 108CFU/mL菌液和5 mL 18%蔗糖溶液在50 mL离心管中混匀后,加入食品袋中,反复揉搓晃动使液相与固相混匀。称取适量混合均匀的豆粕置于容器中,在28 ℃下发酵48 h。
1.2.4菌浓度的测定。称取2.00 g发酵豆粕置于内径2.7 cm的50 mL无菌离心管中,向其中加入PBS缓冲液至20 mL,使菌与PBS缓冲液充分混匀,从混匀后的离心管中量取0.1 mL加入到盛有0.9 mL PBS缓冲液的1.5 mL离心管中,进行10倍梯度稀释,每个梯度取0.1 mL均匀涂布到2216E平板上,平板放入28 ℃培养箱中培养24 h后进行计数。
1.2.5不同混匀方式对发酵豆粕内菌量释放的影响。为使发酵豆粕中菌能够有效释放到PBS缓冲液中进行涂板计数,设置4种混匀方式:涡旋振荡1 min(A);超声破碎1.5 s,间隔1 s,重复5次(B);超声破碎2.0 s,间隔1 s,重复5次(C);超声破碎2.5 s,间隔1 s,重复5次(D)。每种混匀方式设置3个平行,测定菌浓度。
1.2.6不同发酵容器对豆粕发酵的影响。发酵容器分别为10×6 cm2无菌聚乙烯(PE)食品袋、φ9 cm一次性培养皿、内径2.7 cm的50 mL无菌离心管和23×12×5 cm3无菌铝饭盒。为保证3种容器的豆粕厚度相同,分别称取9.00、9.00、2.00和150.00 g豆粕,置于容器中并均匀松散堆积成1.5 cm厚度。将食品袋用封口机封口,培养皿盖合,离心管用4层无菌报纸封口,铝饭盒用铝盖盖合。每个条件设置3个平行,28 ℃恒温持续静置发酵48 h,测定菌浓度。
1.2.7不同豆粕粒径对豆粕发酵的影响。将粉碎后的豆粕逐级过筛,取10目、20目、40目和80目筛过滤的豆粕颗粒,这4层筛孔直径分别为2.00、0.85、0.43和0.18 mm。经灭菌后在37 °C烘箱内烘干24 h。按1.5 cm厚度松散堆积于50 mL无菌离心管中,每个条件设置3个平行,28 ℃恒温持续静置发酵48 h,测定菌浓度。
1.2.8不同堆料厚度对豆粕发酵的影响。称取发酵豆粕,置于内径2.7 cm的50 mL无菌离心管中,松散堆积,使其平均厚度分别为1.5、2.0、2.5和3.0 cm,3次重复,将离心管站立放置于管架内,28 ℃恒温持续静置发酵48 h,测定菌浓度。
1.2.9数据统计与分析。采用Excel 2010软件进行数据处理和绘图;采用DPS软件分析处理数据,采用SNK法进行差异显著性分析。
2 结果与分析
2.1不同混匀方式对发酵豆粕菌浓度的影响分别称取同一批发酵的豆粕2.00 g,各加入20 mL PBS缓冲液后,在50 mL离心管中采用4种混匀方式进行发酵后豆粕中细菌的释放,以便能准确测定豆粕中细菌的数量。从图1可以看出,混匀方式A和C所测定的菌浓度最高,二者无显著差异,测得的菌浓度是混匀方式B和D测得菌浓度的1.16~1.21倍,差异显著。由于涡旋振荡操作简单,所以后续试验中选择涡旋振荡1 min作为发酵豆粕中细菌计数的混匀方式。

注:不同小写字母表示差异显著(P<0.05)Note:Different small letters indicated significant differences(P<0.05)图1 不同混匀方式对发酵豆粕中菌浓度的影响Fig.1 Effects of different blending methods on the concentration bacteria in fermented soybean meal
2.2不同发酵容器对发酵豆粕菌浓度的影响采用热封的PE食品袋(A)、盖合的培养皿(B)、报纸封口的50 mL离心管(C)和盖合的铝饭盒(D)4种容器进行豆粕发酵,观察不同容器对发酵豆粕菌浓度的影响。从图2可以看出,盖合的培养皿(B)和报纸封口的50 mL离心管(D)处理菌浓度最高,分别达1.67×1010和1.68×1010CFU/g,二者无显著差异(P>0.05)。热封的PE食品袋(A)和盖合的铝饭盒(D)中豆粕发酵后的菌浓度分别为8.50×109和1.17×1010CFU/g,是盖合的培养皿(B)和报纸封口的50 mL离心管(C)处理菌浓度的50.6%~70.1%,差异达到显著水平(P<0.05)。相对于盖合的培养皿(B)而言,报纸封口的50 mL离心管(C)可直接作为细菌计数的容器,方便后续取样和处理。
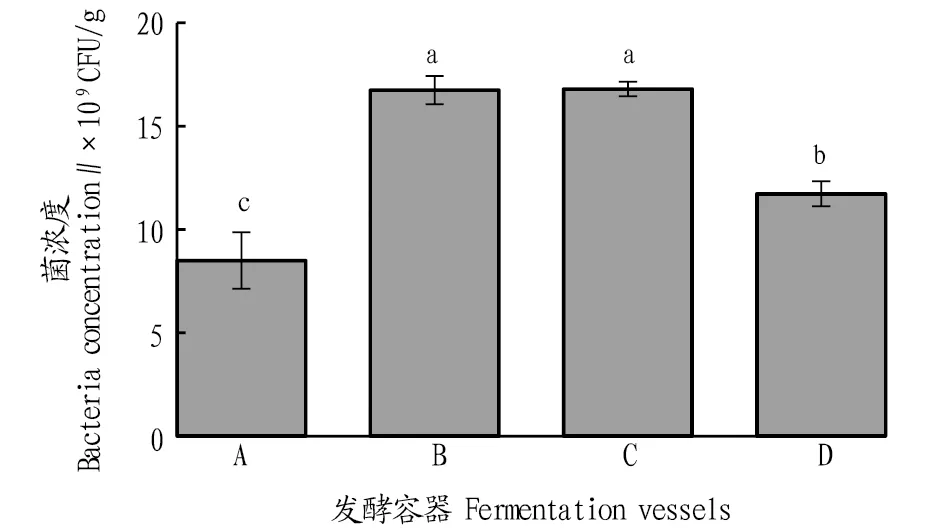
注:不同小写字母表示差异显著(P<0.05)Note:Different small letters indicated significant differences(P<0.05)图2 不同发酵容器对发酵豆粕菌浓度的影响Fig.2 Effects of different fermentation vessels on the bacteria concentration in fermented soybean meal
2.3不同豆粕粒径对发酵豆粕菌浓度的影响采用豆粕粉碎后经4种不同筛孔过筛分级,再经灭菌后用于发酵,观察豆粕粒径对发酵豆粕菌量的影响。从图3可以看出,经过80目(0.18 mm)筛孔的豆粕颗粒发酵后菌浓度最高,达1.76×1010CFU/g,而经过10目(2.00 mm)、20目(0.85 mm)和40目(0.43 mm)过筛的豆粕颗粒发酵后的菌量分别为4.26×109、6.14×109和9.53×109CFU/g,分别是经80目筛孔过筛分级豆粕颗粒发酵后菌浓度的24.2%、34.9%和54.1%(P<0.05)。这说明随着豆粕粒径的减小,发酵豆粕菌浓度明显升高。
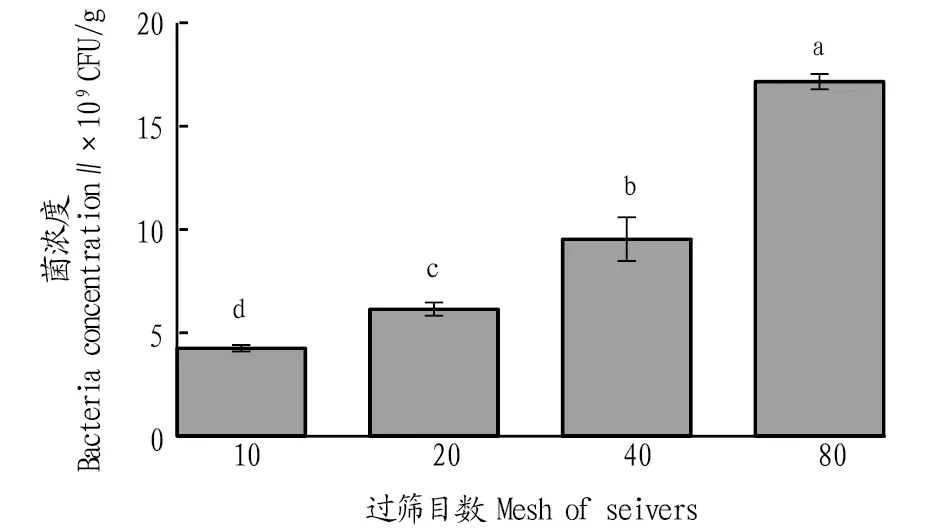
注:不同小写字母表示差异显著(P<0.05)Note:Different small letters indicated significant differences(P<0.05)图3 不同豆粕粒径对发酵豆粕菌浓度的影响Fig.3 Effects of different particle sizes of soybean meal on the bacteria concentration in fermented soybean meal
2.4不同堆料厚度对发酵豆粕菌浓度的影响采用1.5~3.0 cm的4种堆料厚度在50 mL离心管中进行豆粕发酵,观察堆料厚度对发酵豆粕菌量的影响。从图4可以看出,堆料厚度在1.5 cm的菌浓度最高,达1.65×1010CFU/g。堆料厚度为2.0、2.5和3.0 cm处理发酵后的菌浓度分别为1.27×1010、1.19×1010和1.04×1010CFU/g,分别为堆料厚度1.5 cm处理发酵后菌浓度的77.0%、72.1%和63.0%(P<0.05)。这说明随着堆料厚度的增加,发酵豆粕菌浓度逐渐降低。

注:不同小写字母表示差异显著(P<0.05)Note:Different small letters indicated significant differences(P<0.05)图4 不同堆料厚度对发酵豆粕菌浓度的影响Fig.4 Influences of different windrow thickness on the bacteria concentration in fermented soybean meal
3 讨论与结论
固体发酵与液体发酵最主要的差异是发酵体系的异质性和缺乏流动性,无法通过液体发酵的揺瓶方式实现发酵体系的匀质化,实验室发酵只能采用静置方式进行。在这种条件下,物料状况和发酵容器对固体发酵的影响比液体发酵大得多。
芽孢杆菌是一种好氧菌,发酵容器的透水透气性、导热性、操作便利性以及发酵物料的匀质性等都可能显著影响豆粕的固态发酵效果[13]。食品袋透水透气性差,袋口封闭后发酵过程导致袋内氧气不足,且袋不规则形状使袋内冷凝水滴回豆粕表面,阻止了豆粕内部的透气性,从而影响发酵效果[14-15]。该研究选用的铝饭盒与盒盖间的密封性较好,盒内因发酵耗氧而可能导致氧气不足,且长时间的发酵过程中产酸,会溶出铝离子,这些因素可能影响了发酵效率;50 mL离心管采用报纸封闭,透气性好;培养皿盖的气密性也不强,符合微生物培养的一般耗氧需求,因此这2种容器均能满足芽孢杆菌发酵过程中的氧气需求。容器中堆料厚度越大,越会阻碍氧气向堆料内部传递。在生产规模,一般静置好氧发酵的堆料厚度小于10 cm,当堆料高度小于3cm时,料层厚度对于氧气纵向传递的阻碍作用减弱[16],但该研究在内径为2.7 cm的50 mL离心管中进行堆料发酵,物料底部和侧面都有管壁封闭,只有顶面开放,这种条件下,可以看到2.0~3.0 cm的堆料厚度都使发酵效果显著低于1.5 cm的堆料厚度。管军军等[17]研究表明更细的豆粕粒度能够显著提高发酵效率。该研究结果表明,与其他筛下的豆粕颗粒相比,80目筛下的粉碎豆粕颗粒匀质性好,且具有最大的豆粕空隙率和比表面积,发酵结果表明豆粕粒径对发酵效果的影响最大。
笔者针对具有抗病作用的1株地衣芽孢杆菌的实验室豆粕发酵工艺,比较了发酵豆粕在PBS中经涡旋振荡或超声破碎进行混匀后对其中细菌的释放效果,确定利用1 min涡旋振荡的方式就能获得满意的细菌释放效果,建立了发酵豆粕中活菌有效计数的方法。通过对发酵容器种类、豆粕粒径和堆料厚度3种因素进行比较,发现地衣芽孢杆菌发酵豆粕的实验室小试发酵条件是用报纸封口的50 mL离心管为发酵容器,经80目筛过滤粉碎的豆粕颗粒,按1.5 cm厚度堆料进行发酵,能得到最佳发酵效果,经28 ℃发酵48 h,菌浓度能达到1.65×1010~1.76×1010CFU/g。该研究结果为后续发酵豆粕的深入研究提供了技术支持。
[1] 张淑萍.基于资源配置效率的粮食安全风险及其防控[J].农村经济,2016(8):22-29.
[2] 杨小佳,王金水,管军军,等.豆粕的营养价值及影响因素[J].粮食与饲料工业,2013(3):44-46.
[3] RUMSEY G L,SIWICKI A K,ANDERSON D P,et al.Effect of soybean protein on serological response,non-specific defense mechanism,growth and protein utilization in rainbow trout[J].Veterinary immunology & immunopathology,1994,41(3/4):323-339.
[4] ANDERSON R L,WOLF W J.Compositional changes in trypsin inhibitors,phytic acid,saponins and isoflavones related to soybean processing[J].Journal of nutrition,1995,125(3 Suppl):581-588.
[5] FLORETO E A T,BAYER R C,BROWN P B.The effects of soybean-based diets,with and without amino acid supplementation,on growth and biochemical composition of juvenile American lobster,Homarusamericanus[J].Aquaculture,2000,189(3/4):211-235.
[6] 中华人民共和国农业部.饲料添加剂品种目录[Z].2013-12-30.
[7] CUTTING S M.Bacillus probiotics[J].Food microbiology,2011,28(2):214-220.
[8] KIERS J L,NOUT M J,ROMBOUTS F M,et al.Effect of processed and fermented soybeans on net absorption in enterotoxigenicEscherichiacoliinfected piglet small intestine[J].British journal of nutrition,2006,95(6):1193-1198.
[9] 尹慧君,宋俊梅.微生物发酵对豆粕中抗营养因子的影响[J].粮食与饲料工业,2010(12):56-58.
[10] 姚琨,李富伟,李兆勇.发酵豆粕概述[J].饲料与畜牧,2011(12):32-38.
[11] 卫琳,宋俊梅,黄永锋.固态发酵豆粕在饲料中的研究应用[J].饲料与畜牧,2008(8):12-13.
[12] 安晓萍,王哲奇,齐景伟,等.混菌固态发酵对豆粕营养特性的影响[J].饲料研究,2014(1):66-70.
[13] 周巍.食品工程原理[M].北京:中国轻工业出版社,2002.
[14] 戚伟,赵树欣,李艳敏,等.混菌发酵生产富肽蛋白饲料工艺条件的研究[J].饲料工业,2007,28(17):6-9.
[15] HONG K J,LEE C H,KIM S W.Aspergillus oryzae GB-107 fermentation improves nutritional quality of food soybeans and feed soybean meals[J].Journal of medicinal food,2004,7(4):430-435.
[16] 翁媛媛,陈洪章.惰性吸附载体固态发酵细菌纤维素的研究[J].纤维素科学与技术,2010,18(4):1-7.
[17] 管军军,李世豪,韩丙倩,等.粒度对固态发酵豆粕产肽的影响研究[J].饲料工业,2014,35(17):40-43.

