酒醅发酵法降解河豚毒素的条件优化研究
乔 菊,代启虎,李 冉,梁田田,卢 瑛,李柏林,欧 杰
上海海洋大学 食品学院,分子生物学实验室,农业部水产品贮藏保鲜质量安全风险评估实验室(上海),上海 201306
河豚毒素(Tetrodotoxin,TTX)是一种毒性非常强的海洋生物活性物质,它是典型的神经N a+通道阻断剂。最初主要是从豚科鱼(Tetrodontidae)中被发现,被Tahara(1909)命名为Tetrodotoxin。
TTX是世界上最致命的生物毒素之一[1],毒性是氰化钠的1250倍,0.5 mg就可以致人于死命[2]。TTX中毒之后,它的潜伏期短、同时病死率很高,吸收后会损坏中枢神经和末梢神经系统,使神经传导出现障碍,先会感到神经麻痹,后是运动神经麻痹,严重的脑干麻痹则会导致呼吸循环衰竭[3]。TTX主要分布在河豚的卵巢、肾脏、肝脏、血液、眼睛、鱼鳃还有皮肤内,尤是以卵巢和肝脏中含量较多[4]。TTX及其类似物不仅分布于河豚鱼体内,另外还存在于多种脊椎及无脊椎动物体内,例如两栖动物、棘皮动物、节肢动物、软体动物等[5]。TTX的理化性质非常稳定,在中性和酸性溶液中稳定,在碱性水溶液中比较容易被分解,降解为几种喹啉化合物[6]。TTX一般难以通过烹调手段来破坏,中毒后也没有有效的解救措施[7]。
在白酒酿造过程中,酒醅是指加酒曲后发酵好的粮食。这类粮食发酵过程中,会有大量的微生物繁殖生长,其中的微生物主要有酵母、霉菌和细菌。在日本的石川县,用河豚卵巢做的米糠浸渍酱菜,是用盐腌藏河豚卵巢,然后放入到米糠中让其发酵,盐渍一段时间之后,
河豚卵巢的毒性可降低到一个可食用的范围[8]。这可能是米糠中的某些微生物有降解TTX毒性的作用。方国锋等用EDC/NHS化学偶联法将磁性纳米微球与TTX单克隆抗体(实验室自备)[9]进行偶联,制备了磁性免疫探针,又参考徐晓巍等的方法[10]制成了免疫层析试纸条。本研究采用此试纸
1 材料与方法
条为测量方法,利用酒醅中的微生物种群来降解河豚毒素。
1.1 仪器,试剂及材料
纯度大于99%的TTX标准品,购自北京盈泽纳新化工技术研究院;超滤离心管购自上海蒙昌仪器有限公司;酒醅为山西杏花春汾酒集团有限责任公司提供;实验动物为SPF级别昆明鼠,雄性,19~21 g,购自上海斯莱克实验动物有限责任公司。
恒温培养箱购自上海一恒科学仪器有限公司;ZWY-2102C Incubator Shaker购自上海智诚分析仪器制造有限公司;Eppendorf离心机5810B型购自德国Eppendorf公司;MAR磁信号分析系统购自美国Magna Bio Sciences公司。
1.2 样品前处理
TTX经酒醅发酵降解后,在5000 r/min的条件下离心15 min,取上清液;上清液在10000 r/min的条件下离心15 min,取上清;上清液调节pH至中性(试纸条在中性环境下检测才准确,所以检测之前要对样品进行调节pH至中性的操作),取4 mL配平pH的上清液加入到超滤离心管中,在4000 r/min条件下离心20 min。取经超滤的样品液按比例加入层析液和磁珠,滴加到试纸条上,30 min之后用磁信号仪进行磁信号值的测定。
1.3 实验方法
免疫层析检测采用的是间接竞争模式,对于阳性样本,C线区域有明显的颜色反应;阴性则T线显色,本实验所使用试纸条是基于相同原理制成的。即是说河豚毒素的毒性越大,则试纸条C线显色越深,所测C线的磁信号值越大;反之,随着河豚毒素被降解,试纸条T线显色越深,所测到的T线的磁信号值就会越大。另外,试纸条测河豚毒素时最大检测上限为5µg/mL,所以本实验中TTX的初始浓度都定为5µg/mL。以TTX标准溶液的浓度为横坐标,对应的试纸条T线的磁信号值为纵坐标建立对数标准曲线,以此判断磁性免疫层析法是否适用于TTX的定量分析和检测。结果处,以各影响因素为横坐标,样品检测试纸条上T线信号值为纵坐标来做图。TTX的降解率={(样品试纸条T线磁信号值-5µg/mL TTX标准品试纸条T线磁信号值)/(阴性对照磷酸缓冲液(PBS)试纸条T线磁信号值-5µg/mL TTX标准品试纸条T线磁信号值)}×100%。
1.4 降解条件优化
1.4.1 酒醅添加量对降解效果的影响 秤取4、8、12、16、20 g酒醅,分别对应加入3、7、11、15、19 mL灭过菌的去离子水,然后再对应加入1 mL的20µg/mL、40µg/mL、60µg/mL、80µg/mL、100µg/mL的TTX标准品溶液。充分搅拌均匀后,放置到恒温培养箱中静置培养,温度设为30℃。72 h后,经前处理后测磁信号值。
1.4.2 温度对降解效果的影响 酒醅中加入TTX标准溶液,搅拌均匀后,分别放置在条件为20℃、25℃、30℃、35℃、40℃的无水恒温培养箱中。反应72 h后,取出,经前处理后测磁信号值。
1.4.3 摇床转速对降解效果的影响 参照贾晋斌等[11]研究酒曲发酵液降解河豚毒素时摇床转速的设定,本实验在酒醅中加入河豚毒素之后,搅拌均匀,分别放置在条件为20 r/min、50 r/min、80 r/min、100 r/min、150 r/min的摇床中30℃反应,72 h后,取出,经前处理后测磁信号值。
1.4.4 时间对降解效果的影响 TTX标准溶液加入到酒醅中后,用上面确定的最佳降解条件进行培养。每隔一天取出一个样品,放入-20℃冰箱中保存备测。7 d后对7个样品经前处理后,测磁信号值。主要为了计算最佳条件下酒醅对TTX的降解率会达到多少。
1.4.5 小鼠生物法检测降解效果 将上述降解1~7 d的TTX样品,用小鼠法[12-14]来检测酒醅对TTX的降解效果。每只小鼠的注射剂量为1 mL,每个样品注射3只体重相差不大的小鼠,取3只小鼠的死亡时间的平均数作为该样品的致死时间。当注射器把样品全部注入小鼠腹腔内时开始计时,以出现了河豚毒素中毒的典型症状为标准判断小鼠是否中毒,当小鼠停止呼吸时便停止计时。小鼠中毒的症状是开始先安静,之后躁动转圈、动作不灵活、呼吸困难、身体抽搐,最终死亡。
1.5 统计分析
文中的试纸条结果都是5次平行试验的平均值,小鼠则是3次平行试验的平均值。用SPSS软件对数据进行统计分析。其中同列肩标不同字母表示差异显著(P≤0.05),肩标相同字母则表示无显著差异(P>0.05)。
2 结果
2.1 免疫层析定量检测
对不同浓度TTX标准品试纸条的T线部分的磁信号进行检测,建立标准曲线如图1所示。TTX的含量在100~5000 ng/mL的范围内,与磁信号的值具有良好的线性关系,关系式y=-0.1303x+813.88,R2为0.9944。由此可见,磁性免疫层析方法可用于TTX的定量分析和检测。
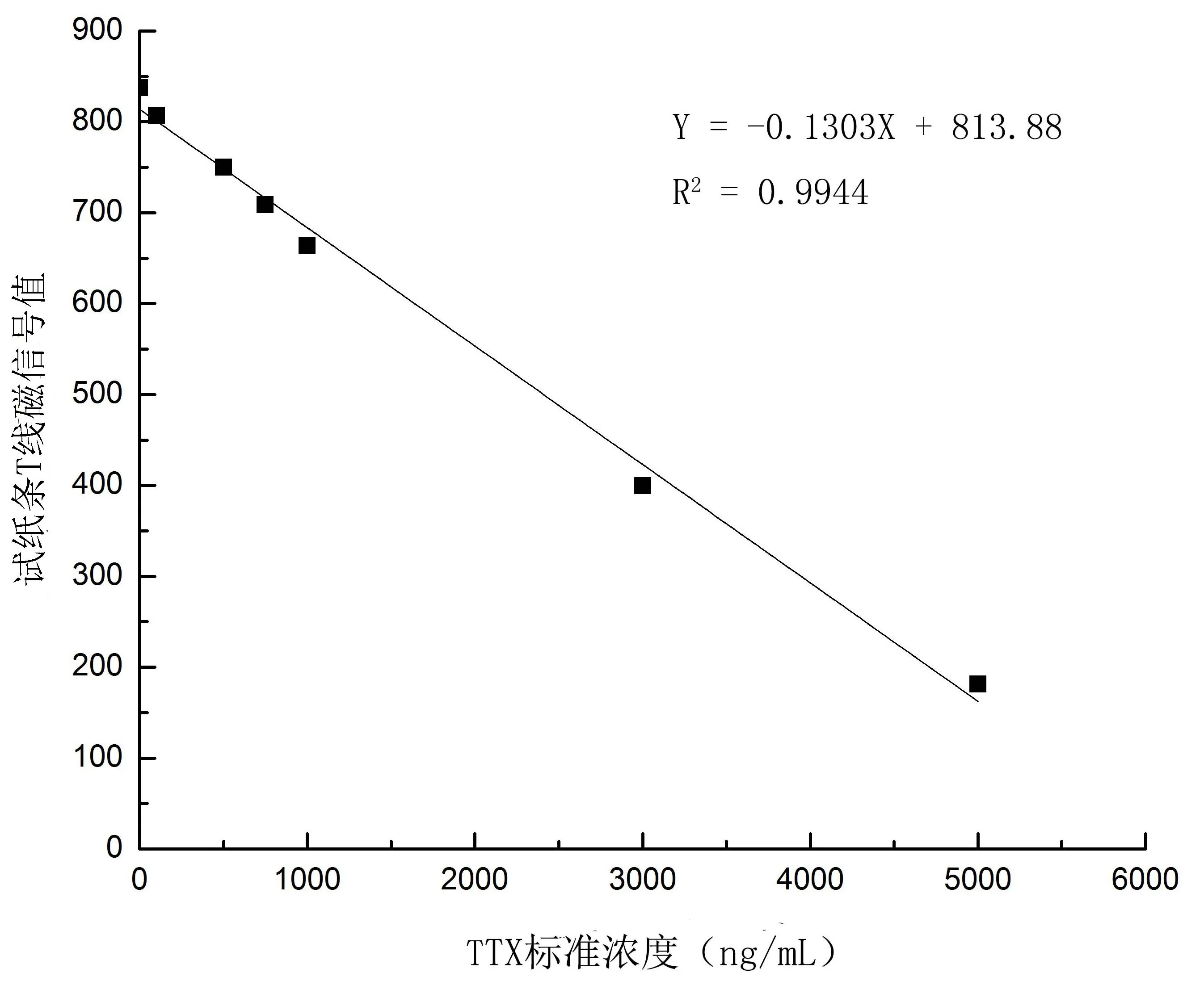
图1 河豚毒素免疫层析法检测定量标准曲线Fig.1 Standard curve of immunochromatography for TTX
2.2 降解条件的优化
2.2.1 酒醅添加量对降解效果的影响 SPSS软件的统计分析结果(表1)显示随着酒醅添加量的增多,试纸条的T线磁信号值在不断增大,说明河豚毒素在不断被降解,毒性越来越低。酒醅添加量到达16 g之前,试纸条上T线磁信号值之间变化显著(P≤0.05)。这可能是因为,随着酒醅量的增加,微生物的数量也在增加,因而与河豚毒素的作用加强。而当酒醅添加量为16 g、20 g时,试纸条T线磁信号值之间没明显差异(P>0.05)。这可能是当微生物数量继续增加时,由于受到包括溶氧量等其他条件的限制,化合物降解不再发生变化。所以最优酒醅添加量为16 g。

表1 不同酒醅添加量对TTX降解的影响结果的显著性分析Table 1 Notability analysis on influence of different fermented grains dosage to TTX degradation
2.2.2 温度对降解效果的影响 如图2,当温度达到30℃时,试纸条T线磁信号值最大,说明此时河豚毒素的毒性最低。根据方法中降解率的计算公式,得出此温度下河豚毒素的降解率达到43.6%。30℃之前,T线磁信号值随温度增加而增加,30℃之后,TTX线磁信号值不断下降。温度对微生物的生长有很大的影响,在最适生长温度范围之内,随着温度的升高,反应作用会不断加强,但超过限定范围时,一些活性物质如酶会失活,从而影响反应的结果。所以30℃为最佳降解温度。
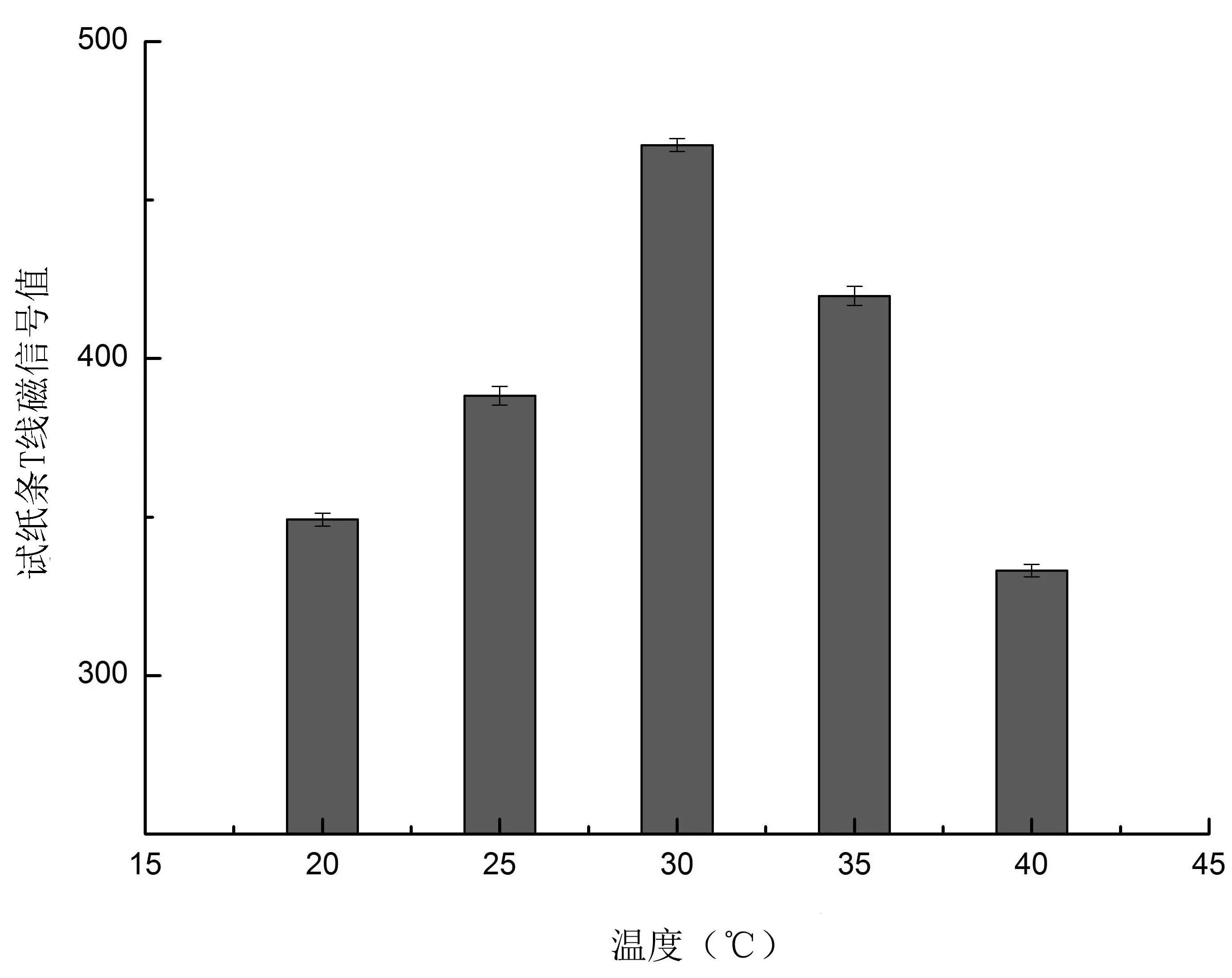
图2 不同温度对酒醅降解TTX的影响Fig.2 Influence of different temperatures on TTX degradation rate
2.2.3 摇床转速对降解效果的影响 由图3可知,当摇床转速为50 r/min时,试纸条T线磁信号值最大,说明此时酒醅对TTX的降解能力最佳,根据降解公式算出降解率可达53.8%。酒醅是半固体,摇床振荡影响通气量,通气量不同则发酵结果不同。不同摇床转速对TTX降解结果显示通气量确实对TTX的降解起到促进作用。
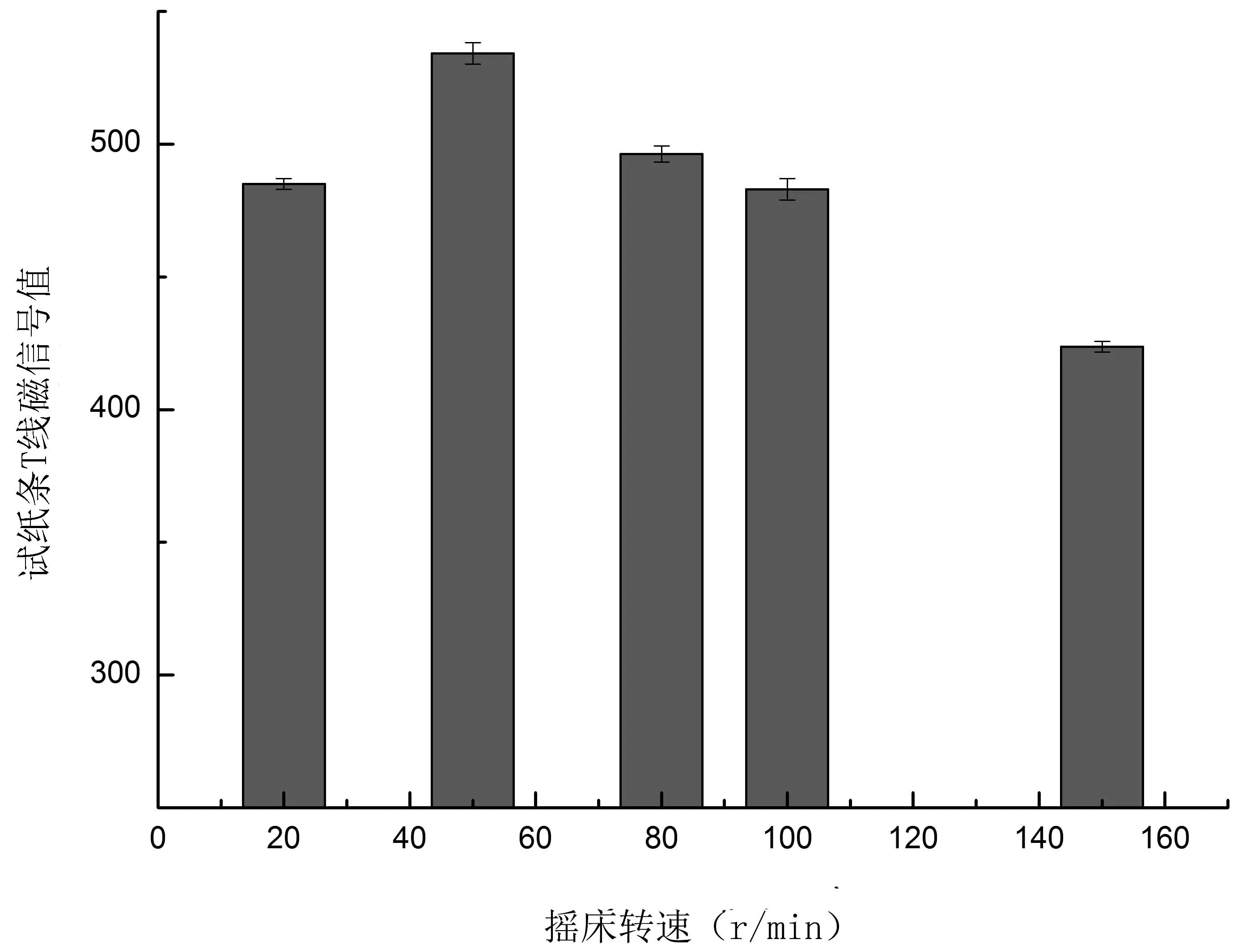
图3 摇床转速对酒醅降解TTX的影响Fig.3 Influence of different shaker rotate speeds on TTX degradation rate
2.2.4 时间对降解效率的影响 观察表2统计分析结果,5 d以前,试纸条T线磁信号值之间变化显著(P≤0.05),但当降解达到第5、6、7 d时,试纸条T线磁信号值之间无显著差异(P>0.05)。根据降解率计算公式算出第5 d时的降解率达68.3%。可能是在适宜的条件下培养时,随着时间的延长,酒醅中微生物的数量在不断增加,对河豚毒素的降解作用也在增强。而当降解达到第5、6、7 d时,酒醅中降解河豚毒素的活性物质不再发生变化,导致降解率不变。因此实验时,5 d就可以进行1次数据测定。

表2 时间酒醅降解TTX的影响结果的显著性分析Table 2 Notability analysis on influence of time to TTX degradation
2.2.5 小鼠生物法检测结果 观察表3的显著性分析表格,在降解5 d之前,小鼠的死亡时间之间变化显著(P≤0.05),5 d之后小鼠的死亡时间变化不显著(P>0.05)。这准确验证了酒醅降解TTX的时间规律。虽然不能达到完全解毒的效果,但证明了酒醅确实有降解TTX的能力。酒醅降解7 d后,腹腔注射TTX的小鼠的死亡时间为17′29″,依据国标法[13]附录A中表A,查出此时的TTX的毒力为1.26 MU。5µg/mL的TTX腹腔注射小鼠时,小鼠的死亡时间为1′23″,小于4 min,查出毒力远远大于6.13 MU。毒力降低值大于4.87 MU。

表3 小鼠生物法检测酒醅对TTX的降解效果的显著性分析Table 3 Significant analysis on the degradation effect of fermented grains on TTX by mouse bioassay
3 讨论
本实验研究了酒醅降解河豚毒素的最优条件,结果表明在酒醅添加量为16 g,温度为30℃,摇床转速为50 r/min的条件下,酒醅对河豚毒素的降解能力最强,用小鼠生物法来验证时间对降解效果的影响时,发现随着反应的进行,小鼠的死亡时间在延长,第五天之后趋于不变,验证了酒醅降解河豚毒素的时间规律,同时也证明了酒醅对河豚毒素确实有降解作用,其中有可能是酒醅中的微生物在起降解作用。贾晋斌,舒静[11]等研究酒曲对河豚毒素的转化实验中发现酒曲发酵液对河豚毒素的降解具有较为显著的效果,结果表明在温度为30~35℃,摇床转速为50 r/min的条件下,酒曲对河豚毒素的降解能力最佳。TTX含有苯吡啶结构,而微生物在好氧和厌氧环境下都可以利用吡啶及其衍生物[15]。TTX也是一种氨基全氢化喹唑啉化合物,能够降解喹啉及其衍生物的菌株也被大量分离鉴定出来,如假单胞菌属(Pseudomonassp.)[16]可降解喹啉,黄单孢菌属(Xanthomonas)[17]可降解4-甲基喹啉。
关于TTX的降解机理以及TTX被转化为何种物质,这需要进一步的研究,现在还没有确定的研究结果。汾酒属于清香型白酒,李增胜、任润斌[18]研究了清香型白酒在发酵过程中的主要微生物,认为酵母菌类中主要有拟内孢霉、酵母菌属、假丝酵母和异常汉逊酵母;霉菌类中主有根霉、红曲霉、梨头霉、毛霉和黄米曲霉;细菌类中主要有革兰氏阴性芽孢细菌、乳酸菌和醋酸菌。介于微生物在毒素降解中的作用,所以酒醅能够降解TTX可能是是酒醅中的微生物对河豚毒素起了生物转化的作用。微生物转化的本质是某种微生物将一种物质(底物)转化成为另一种物质(产物)的过程,是通过微生物细胞将复杂的底物进行结构修饰,也就是利用微生物代谢过程产生的某个或某一系列的酶之间的相互作用对底物特定基团进行的催化反应[19]。也许可以根据酒醅中的菌相来建立一个微生物体系,通过不断调试加入微生物的比例,不断优化,可以达到降解河豚毒素的作用。这对找出TTX的降解机理是个机会,可以作为一个研究的方向。
[1]Do HK,Kogure K,Imada C,etal.Tetrodotoxin production of actinomycetes isolated from marine sediment[J].Journal of Applied Microbiology,1991,70(6):464-468
[2]岳田芳.海藻希瓦氏菌发酵产生河豚毒素的提取与检测[D].青岛:中国海洋大学,2008
[3]洪 专,易瑞灶,许 晨,等.河豚毒素中毒机理与临床救治探讨[J].中国海洋药物,2004,23(3):49-53,14
[4]刘燕婷,雷红涛,钟青萍.河豚毒素的研究进展[J].食品研究与开发,2008,29(2):156-160
[5]Miyazawa K,Noguchi T.Distribution and origin of tetrodotoxin[J].J Toxicol--Toxicon Review,2001(20):11-33
[6]Charles TH.The Chemical and Evolutionary Ecology of Tetrodotoxin(TTX)Toxicity in Terrestrial Vertebrates[J]. Marine Drugs,2010,8(3):577-593
[7]刘燕婷.河豚毒素的研究进展[J].时珍国医国药,2002,13(11):691-692
[8]Fujii T,Mayumi M.Fugu meat,pickles ovary.National processed marine products overview[C/OL].[2013-04-16]. http://nrifs.fra.affrc.go.jp/kakou/souran/ransounukaduke/.
[9]丛 蕾.河豚毒素特异性单克隆抗体的制备[D].上海:上海海洋大学,2011
[10]徐晓巍,崔正权,卢瑛,等.基于磁性纳米探针的乙肝前S1抗原的快速磁性免疫层析方法的建立[J].生物学杂志,2016,33(1):98-103
[11]贾晋斌,舒 静,彭 锐,等.酒曲生物转化降解河豚毒素的初步研究[J].中国医药生物技术,2013,8(4):269-273
[12]王 静,杨丽君,李兆杰,等.昆明系小鼠生物法定量测定水产品中河豚毒素[J].食品科学,2011,32(4):181-184
[13]段发淼,谢心磊,朱宝平.用小鼠单位法检测河豚毒素[J].中国卫生检验杂志,2000,10(4):463-464
[14]中华人民共和国国家质量监督检验检疫总局.SN/T 1569.2-2013出口河豚鱼中河豚毒素检测方法 第2部分:小鼠生物法[S].北京:中国标准出版社,2013
[15]Li YM,Gu G,Zhao J,etal.Anoxic degradation of nitrogenous heterocyclic compounds by acclimated activated sludge[J].Process Biochemistry,2001,37(1):81-86
[16]Kilbane JJ,Ranganathan R,Cleveland L,et a1.Selective removal of Nitrogen from Quinoline and Petroleum byPseudomona ayucidaIGNT9m[J].Appl.Environ.Microbiol,2000,66(2):688-693
[17]Sutton SD,Pfaller SL,Shann JR,et a1.Aerobic biodegradation of 4-methylquinoline by a soil bacterium[J].Applied and Environmental Microbiology,1996,62(8):2910-29l4
[18]李增胜,任润斌.对清香型白酒发酵过程中酒醅中的主要微生物[J].酿酒,2005,32(5):33-34
[19]Chen DJ,Zhu BQ.Application of microbial transformation in modern pharmaceutical industry[J].Chin J Antibiotics, 2006,31(2):112-118

