大米α-球蛋白肽YGEGSSEEG对TNF-α诱导的血管内皮细胞损伤的影响
鞠志远,王丽丽,刘丽娅,周闲容,周素梅,佟立涛
(中国农业科学院农产品加工研究所,农业部农产品加工综合性重点实验室,北京 100193)
血管内皮分泌肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等前炎症介质[1],能够诱发自身和循环中的单核细胞产生多种促炎因子,加重细胞损伤,从而促进动脉粥样硬化(atherosclerosis,AS)的发展[2]。近年来,通过食物功能活性成分改善心血管疾病已成为食品和营养学家研究的热点。前期研究证实,摄入大米α-球蛋白(100 mg·kg-1体质量)可明显降低ApoE-/-小鼠的AS病变[3]。相关研究也证实,鸡蛋肽IRW可通过下调血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)、细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)和活性氧水平,发挥血管内皮细胞保护作用,从而具有抗AS功效[4]。基于此,我们推测大米α-球蛋白中含有保护血管内皮细胞,进而降低AS风险的功能肽。肠囊外翻法是一种在体外模拟肠道环境检测药物吸收的技术,操作简单,贴近实际吸收水平,配合体外消化方法可快速评价消化产物的吸收状况。而液相质谱串联(LC-ESI/MS)可准确测定肽的氨基酸序列。
1 材料
1.1细胞与培养基原代人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)、血管细胞基础培养基、内皮细胞生长因子-BBE均购自美国ATCC公司[2]。
1.2实验动物4周龄♂仓鼠,购自北京维通利华实验动物公司。
1.3试剂合成肽YGEGSSEEG(纯度97%),购自中国强耀生物公司;胎牛血清(fetal bovine serum,FBS)、TNF-α,购自北京索莱宝公司;Annexin V-FITC/PI双染试剂盒,购自美国Genview公司;VCAM-1、ICAM-1、p-p38、Bax、IKKα兔多抗、IκBα抗体,均购自美国CST公司;p65、β-actin、β-tubulin抗体,购自美国Immunoway公司;Bcl-2抗体购自英国Abcam公司;谷胱甘肽过氧化酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、总抗氧化能力(total anti oxidation capacity,TAOC)酶联免疫试剂盒,购自北京易科拜德公司。
1.4仪器Agilent 1200高效液相色谱仪、Prostar 218 LC半制备液相色谱仪(美国Agilent公司);LCQ Decaxp电喷雾质谱(美国Thermo公司);Novocyte流式细胞仪(美国艾森公司);JY-SCZ2型SDS电泳装置(北京君意东方设备公司);Chameleon V酶标仪(芬兰Hidex公司);2000MM型Kodak Image Station成像系统(美国Kodak公司);MCO-18AC二氧化碳培养箱(日本SANYO公司)。
2 方法
2.1肽段的筛选采用胃蛋白酶和胰蛋白酶两步消化的体外消化模型:蒸馏水配制3%的大米α-球蛋白溶液,用HCl调溶液pH至2.0,加入胃蛋白酶,37℃消化酶解2 h;NaHCO3调pH至5.3,加入胰蛋白酶,再用NaOH调pH至7.8,37℃消化酶解2 h;100°C加热10 min终止反应,2 000×g离心20 min,收集上清液冷冻储存。采用外翻肠囊法对消化产物进行吸收实验:♂ SD大鼠禁食12 h后麻醉,取十二指肠10 cm,用Krebs-Ringer溶液清洗,用玻璃棒小心将小肠外翻,一端扎口,另一端插入取样管,肠囊内加入2 mL Krebs-Ringer溶液,通入95% O2和5% CO2混合气体(2 mL·min-1);将肠囊放入含有15 g·L-1消化产物的Krebs-Ringer溶液中,37℃吸收90 min,肠囊内取样。样品经过凝胶层析初步分离纯化(Sephadex G-15凝胶柱,上样浓度30 g·L-1,上样量3 mL,超纯水1 mL·min-1洗脱,紫外检测280 nm),真空浓缩,冻干。半制备高效液相色谱(RP-HPLC)进一步纯化(Innoval C18色谱柱,上样量1 mL,上样浓度20 g·L-1,流速5 mL·min-1梯度洗脱,检测波长280 nm),收集各组分峰,冻干。利用LC-ESI/MS技术分析肽的氨基酸序列。HPLC色谱条件:色谱柱:Zorbax SB-C18(2.1 mm×150 mm);流动相:A:水(0.1%TFA);B:乙腈(0.1%TFA);梯度:0~40 min,5%~95% B;40~50 min,95%~5% B;进样量:20 μL;流速:0.2 mL·min-1。MS质谱条件:ESI喷雾电压4.5 kV;毛细管温度300℃;正离子检测,MS/MS扫描为Data Dependent Scan;动态排除次数1,时间0.5 min;MS2碰撞能量35%,扫描范围:m/z 900~1400。
2.2细胞分组培养HUVECs细胞复苏后,用含10% FBS、Kit-BBE和青-链霉素(1 ∶1 000)的血管内皮细胞培养基,置于5% CO2和37℃恒温培养箱中培养。取对数生长期的细胞,胰蛋白酶消化贴壁细胞,使用无血清培养基制成细胞悬液待测。实验分为空白对照组,加肽对照组(50 mg·L-1肽处理18 h),模型组(10 μg·L-1TNF-α刺激24 h)和肽干预组(肽处理后TNF-α刺激)。
2.3CCK-8法筛选肽干预浓度细胞以5×107·L-1接种到96孔板(每孔100 μL),给药前同步化过夜。本实验设对照组(无处理)、模型组(TNF-α刺激)和4个肽干预组(分别用25、50、100、200 mg·L-1的肽预处理细胞18 h,后TNF-α刺激细胞),每组设6复孔。每孔加入10 μL的CCK-8溶液,培养箱内孵育2 h,酶标仪测定在450 nm处OD值。
2.4流式细胞术检测细胞凋亡细胞以5×107·L-1接种于6孔板(每孔2.5 mL),给药前换无血清培养基同步化过夜,每组设3复孔。给药后消化收集细胞,并用预冷的PBS清洗2次,2 000 r·min-1离心5 min;用300 μL 1×Binding buffer重悬细胞,加5 μL Annexin V-FITC混匀,避光孵育15 min;上机前5 min加入5 μL PI,补加200 μL 1×Binding buffer,流式细胞仪检测细胞凋亡率。
2.5蛋白质印迹检测相关蛋白表达取对数生长期的细胞,以1×108·L-1的密度接种于培养皿。提取细胞总蛋白(p65检测核蛋白),BCA法蛋白定量,煮沸5 min变性后,进行SDS-PAGE凝胶电泳,半干转印,5%脱脂牛奶封闭2 h,一抗(1 ∶1 000)4℃孵育过夜,TBS洗膜,加入辣根过氧化酶标记的二抗(1 ∶2 000),室温孵育1 h,TBS清洗3次,ECL显色。Image J对条带进行灰度定量分析,分别用β-tubulin(1 ∶5 000)、β-actin(1 ∶5 000)和Histone H3(1 ∶10 000)做内参蛋白。
2.6酶联免疫检测GSH-Px、SOD、TAOC及MDA含量取对数生长期的细胞,以1×108·L-1的密度接种于培养皿。分别收集细胞和培养上清,通过反复冻融(-80℃和37℃间隔5 min,重复3次)裂解细胞,BCA法进行细胞内蛋白定量(实际结果=测定结果×胞内蛋白浓度)。使用SOD、GSH-Px、TAOC等酶联免疫试剂盒,测定细胞裂解液的抗氧化水平,使用MDA酶联免疫试剂盒测定培养上清中MDA的水平。

3 结果
3.1肽序列的测定大米α-球蛋白模拟消化产物,通过外翻肠囊法模拟吸收并收集起来,分离纯化,选择其中一个组分利用液相串联质谱法测定肽的氨基酸序列,并与Uniprot数据库中大米α-球蛋白的序列比对,最终得到一个目标肽的氨基酸序列为YGEGSSEEG(Fig 1)。此外,还通过分别给老鼠灌胃大米α-球蛋白,并检测其血清中的肽含量,验证了大米α-球蛋白经老鼠消化后,可以分解产生肽YGEGSSEEG,并被吸收进入血液中。
3.2肽对TNF-α诱导HUVECs凋亡的影响测定肽YGEGSSEEG对TNF-α诱导HUVECs凋亡的影响(Fig 2)。TNF-α使细胞存活率显著性下降至(80±3)%(P<0.01);用50、100、200 mg·L-1浓度的肽预处理后,再给予TNF-α刺激时,细胞存活率分别上升至(102±4)%、(100±4)%、(101±3)%(P<0.05),达到与空白对照组的水平。进一步利用流式细胞术深入分析肽(50 mg·L-1)对HUVECs凋亡的影响(Fig 3)。图中4个象限分别表示坏死、晚期凋亡、早期凋亡和活细胞,早期和晚期凋亡细胞之和占总数的比例即为细胞凋亡率。空白对照的凋亡率为(14.00±0.54)%,加肽后下降至(11.03±0.79)%(P<0.05)。TNF-α刺激后细胞凋亡率上升至(25.30±0.56)%(P<0.01);肽可明显降低晚期凋亡细胞比例,凋亡率降低至(20.94±1.02)%(P<0.01)。
3.3肽对HUVECs中Bcl-2/Bax表达及p38MAPK磷酸化的影响Fig 4结果显示,与空白对照相比,加肽对照组的Bcl-2表达明显增加、Bax则明显下降(P<0.05)。TNF-α刺激明显性抑制Bcl-2表达,提升Bax的表达(P<0.05)。肽处理后,TNF-α刺激可以有效改善Bcl-2/Bax蛋白的表达(P<0.05)。肽可明显降低TNF-α刺激引起的p-p38表达的增加(P<0.01)。
3.4肽对HUVECs中氧化应激反应的影响肽对细胞氧化应激反应的测定结果如Tab 1所示。TNF-α刺激可以引起细胞的氧化应激反应,降低GSH-Px、SOD和TAOC,提高MDA水平(P<0.05),而肽对TNF-α引起的氧化应激反应无明显的改善作用。

Tab 1 Effects of peptide on levels of GSH-Px, SOD, TAOC, MDA in HUVECs stimulated with TNF-α(±s, n=6)
*P<0.05vscontrol
3.5肽对HUVECs中VCAM-1和ICAM-1蛋白表达的影响如Fig 5所示,TNF-α刺激明显增加ICAM-1 和VCAM-1的表达,加肽后可以明显抑制其增加,但是没有恢复到空白对照组的水平(P<0.05)。
3.6肽对HUVECs中NF-κB通路的影响如Fig 6A所示,加肽对照组IKKα的水平明显降低(P<0.05);TNF-α可使IKKα表达明显升高,IκB-α表达明显降低(P<0.05);肽干预可以有效抑制这一变化趋势(P<0.05)。细胞核内p65的表达水平见Fig 6B,单加肽可明显降低核内p65水平,TNF-α刺激明显升高其水平(P<0.01);且肽可以明显抑制TNF-α引起的核内p65上调,但未恢复至空白对照水平。
4 讨论
炎症反应和氧化应激反应引起的血管内皮细胞损伤在AS形成过程中发挥着十分重要作用。一些防治AS的措施亦通过保护血管内皮细胞来实现[2]。TNF-α作为炎症反应中产生的细胞因子之一,可以诱发血管内皮细胞产生多种促炎因子,引起炎症、氧化应激连锁反应,参与AS的病理生理过程[5]。本研究通过测定肽对HUVECs细胞存活率和凋亡的影响,明确了肽YGEGSSEEG在50 mg·L-1浓度下对TNF-α诱导损伤的HUVECs具有明显的改善作用,证实了YGEGSSEEG是大米α-球蛋白中的核心肽段之一。
研究证实,Bcl-2家族蛋白对细胞凋亡的调控具有重要作用,其成员包括促凋亡蛋白Bax及抑凋亡蛋白Bcl-2等亚家族[6]。单海燕等[7]研究发现,阿托伐他汀通过调节Bcl-2/Bax蛋白表达,延缓血管内皮细胞凋亡,也有大量外源性肽类物质被报道有此功效。p38 MAPK是MAPKs超家族成员之一。p38通路的激活与血管内皮细胞的凋亡关系密切,而p38磷酸化又会引起Bcl-2蛋白表达下调[8]。本研究结果显示,肽YGEGSSEEG具有上调Bcl-2以及下调Bax的作用,且肽的干预可明显抑制细胞内p38的磷酸化。因此,肽YGEGSSEEG可通过调节p38-Bcl-2/Bax通路来抑制HUVECs的凋亡。

Fig 1 The mass spectra of peptide A: Total particle flow diagram; B: Extract ion flow diagram; C: Secondary mass spectrogram

Fig 2 Effects of peptide on viability of HUVECs stimulated with TNF-α (±s, n=6)
#P<0.05vscontrol;*P<0.05vsmodel

Fig 3 Effects of peptide on apoptosis of HUVECs stimulated with TNF-α


Fig 4 Effects of peptide on expressions of Bcl-2, Bax, p-p38 in HUVECs stimulated with TNF-α
C: Control; M: TNF-α model; PC: Peptide control (without TNF-α); PI: Peptide intervention+TNF-α (n=3).*P<0.05,*P<0.01vscontrol;##P<0.01vsmodel.
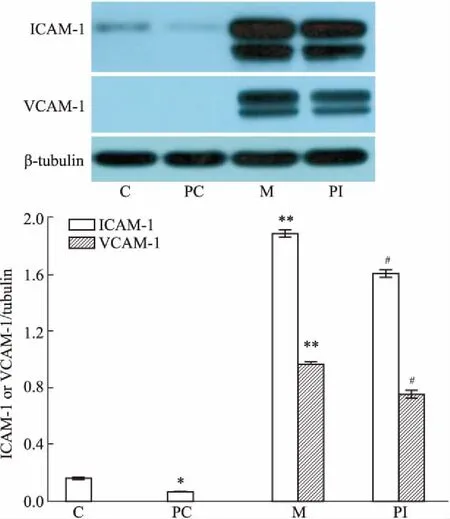
Fig 5 Effects of peptide on levels of ICAM-1 and VCAM-1 in HUVECs stimulated with TNF-α
C: Control; M: TNF-α model; PC: Peptide control (without TNF-α); PI: Peptide intervention+TNF-α (n=3).*P<0.05,*P<0.01vscontrol;##P<0.05vsmodel.

Fig 6 Effects of peptide on levels of IKKα, IκB-α (A) and nuclear p65 (B) in HUVECs stimulated with TNF-α (n=3)
C: Control; M: TNF-α model; PC: Peptide control (without TNF-α); PI: Peptide intervention+TNF-α.*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel.
NF-κB信号通路作为细胞内重要的炎症调节信号通路,参与大量细胞内重要的生理调节。正常情况下,NF-κB与抑制因子IκB-α和IκB-β以结合形式位于胞质内,无生物活性;当炎症因子与细胞特异性结合后,释放IKK激酶,IκB-α磷酸化和降解,NF-κB转运入核,使NF-κB信号通路激活[11]。炎症反应过程中,TNF-α可通过NF-κB信号通路刺激人血管内皮细胞生成黏附因子[12]。Zhou等[13]研究报道,原儿茶醛通过调控NF-κB信号来抑制内皮细胞产生黏附分子。Huang等[14]研究证明了鸡蛋肽IRW可通过阻断NF-κB通路来减缓TNF-α引起的内皮细胞炎症反应。本研究表明,大米肽YGEGSSEEG具有与鸡蛋肽IRW同样的阻断细胞中NF-κB信号通路的功能,是其下调黏附分子表达水平的重要途径。
除炎症反应外,氧化应激也是内皮细胞损伤的重要因素。在健康情况下,机体存在多种抗氧化酶。而病理条件下,内皮细胞功能紊乱,导致细胞膜通透性增大,大量ox-LDL透过细胞膜进入细胞产生大量氧自由基,同时自由基清除能力降低。本研究测定的肽干预组中,GSH-Px、SOD、TAOC以及MDA均没有明显性改善,表明其没有干预HUVECs内的氧化应激反应。
综上所述,大米α-球蛋白肽YGEGSSEEG通过调控p38-Bcl-2/Bax和NF-κB信号通路,抑制TNF-α诱导的HUVECs细胞凋亡以及降低细胞内黏附分子表达,从而发挥血管内皮细胞保护作用。
(致谢:本实验涉及动物实验完成于中国医学科学院药用植物研究所药理实验室,其他分子生物学实验完成于中国农业科学院农产品加工所周素梅课题组实验室。在此对药植所曹丽研究员的大力协助表示感谢!)
参考文献:
[1]Sayo Y, Dobashi H, Matsubara S, et al. Anti-TNF treatment could reduce the risk factor of atherosclerosis through modulation of insulin resistance and adipocytokine expression in rheumatoid arthritis patients[J].Diabetes, 2007,56(1): 163-8.
[2]刘颖琳. 血管内皮细胞炎症反应与动脉粥样硬化的关系对药物研究的启示[J]. 中国药理学通报, 2001,17(4): 361-4.
[2]Liu Y L. Relation of vascular endothelial inflammatory reaction and atherosclerosis and its enlightenmet for research of anti-atherosclerotic drug[J].ChinPharmacolBull, 2001,17(4): 361-4.
[3]Tong L T, Fujimoto Y, Shimizu N, et al. Rice alpha-globulin decreases serum cholesterol concentrations in rats fed a hypercholesterolemic diet and ameliorates atherosclerotic lesions in apolipoprotein E-deficient mice[J].FoodChem, 2012,132(1): 194-200.
(2)这种低K(K≤80 mg/kg)MoO3原料生产出的钼粉粒度大,一次过筛率则大,当钼粉粒度达到3.0 μm以上时成品率高达90%以上,粒度2.5 μm以下时,成品率只有50%左右。
[4]Sarmadi B H, Ismail A. Antioxidative peptides from food proteins: a review[J].Peptides, 2010,31(10): 1949-56.
[5]Napoleone E, Santo A D, Bastone A, et al. Long pentraxin PTX3 upregulates tissue factor expression in human endothelial cells a novel link between vascular inflammation and clotting activation[J].ArteriosclerThrombVascBiol, 2002,22(5): 782-7.
[6]张贝贝, 刘文洪, 李俊峰, 等. 铁皮石斛多糖对高糖诱导的血管内皮细胞Bax、Bcl-2表达的影响[J]. 中国药理学通报, 2015,31(1): 64-70.
[6]Zhang B B, Liu W H, Li J F, et al. Effects of polysaccharides from Dendrobium officinale on expression of Bax and Bcl-2 in vascular endothelial cells induced by high sugar[J].ChinPharmacolBull, 2015,31(1): 64-70.
[7]单海燕, 刘姝, 白小涓, 等. 阿托伐他汀通过调节Bcl-2/Bax蛋白表达延缓血管内皮细胞衰老[J]. 中国动脉硬化杂志, 2012,20(1): 11-5.
[7]Shan H Y, Liu S, Bai X J, et al. Atorvastatin delay the senescence of vsacular endothelial cell induced by angiotensinⅡ through regulating the expression of Bcl-2/Bax protein[J].ChinJArterioscler, 2012,20(1): 11-5.
[8]Changchien J J, Chen Y J, Huang C H, et al. Quinacrine induces apoptosis in human leukemia K562 cells via p38 MAPK-elicited Bcl2 down-regulation and suppression of ERK/c-Jun-mediated Bcl2L1 expression[J].ToxicolApplPharmacol, 2015,284(1): 33-41.
[9]Chai H, Wang Q, Huang L, et al. Ginsenoside Rb1 inhibits tumor necrosis factor-alpha-induced vascular cell adhesion molecule-1 expression in human endothelial cells[J].BiolPharmBull, 2008,31(11): 2050-6.
[10] Majumder K, Chakrabarti S, Morton J S, et al. Egg-derived tri-peptide IRW exerts antihypertensive effects in spontaneously hypertensive rats[J].PLoSOne, 2013,8(11): e82829-42.
[11] Baker R G, Hayden M S, Ghosh S. NF-κB, inflammation, and metabolic disease[J].CellMetab, 2011,13(1): 11-22.
[12] Uchibori R, Tsukahara T, Mizuguchi H, et al. NF-κB activity regulates mesenchymal stem cell accumulation at tumor sites[J].CanRes, 2013,73(1): 364-72.
[13] Zhou Z, Liu Y, Miao A D, et al. Protocatechuic aldehyde suppresses TNF-alpha-induced ICAM-1 and VCAM-1 expression in human umbilical vein endothelial cells[J].EurJPharmacol, 2005,513(1-2): 1-8.
[14] Huang W, Chakrabarti S, Majumder K, et al. Egg-derived peptide IRW inhibits TNF-alpha-induced inflammatory response and oxidative stress in endothelial cells[J].JAgricFoodChem, 2010,58(20): 10840-6.

