金属酯基锌卟啉的合成及其对Li/SOCl2电池的影响
李娜,张增奇,党金宁,卢新生,朱开礼,孙万军,*
(1 甘肃民族师范学院化学与生命科学系,甘肃 合作747000;2 中国科学院青岛生物能源与过程研究所 山东 青岛266101)
锂/ 亚硫酰氯电池(Li/SOCl2)在实际应用的电池中是比能量最高的一次电池,其工作电压约E=3.3 V,理论开路电压E=3.65 V,同时具有能量密度大、放电电压平稳、放电时间长、储存寿命长(可达5-10年)、工作温度范围宽(-55-85 ℃)等诸多优点备受关注,已作为电子设备被广泛应用于商业、医疗、工业和军工等领域,是目前实际应用的电池中比能量最高的一次电池[1-3],但其“安全性”和“电压滞后性”这两个现实问题严重地限制了该类电池的实际应用。电压滞后现象来自于锂负极表面形成的一层致密的LiCl 薄膜,妨碍了SOCl2在正极上被还原的速度,而安全性问题则较为复杂[4]。通常研究者对电池正极材料及电解液的配方进行筛选及优化,尤其是通过加入正极催化剂来提高电池性能,目前主要的正极催化剂有酞菁、卟啉、席夫碱配合物及卤化物(BCX)[5]。
目前关于改善Li/SOCl2电池性能的研究中,研究者都把目光集中在酞著类配合物上。研究证明,通过加入含有金属酞菁化合物的电解液能显著增强Li/SOCl2电池的放电电压和电池容量[6-8]。卟啉和酞菁类化合物都是高共轭的大环类结构,是传递电子的优良载体(能给电子和接收电子)。此外,在SOCl2电解液中,由于溶液极性的影响,卟啉的溶解性高于酞菁,有利于更多的卟啉参与电池的催化反应,从而增强电池反应中的电子转移数目。因此,将卟啉应用于Li/SOCl2电池体系,期望改善其放电电压、电池容量等电学性能,这对理论研究和实际应用具有重要的参考价值[9-10]。
1989年,武汉大学李长明等[11]首次利用四对甲氧基苯基金属卟啉研究了其对亚硫酰氯还原反应的电催化作用主要来自于其阻碍或延缓了LiCI 薄膜在电极表面上的生成,Lee S B 等[12]和Zhang R L 等[13]的研究成果也证明了这一结论。Yong Kook Choi 等[14]用两种钴卟啉分别还原SOCl2时,通过循环伏安法研究其动力学参数表明,催化剂浓度和电极浸泡时间对催化活性有重要影响,催化剂分子首先吸附在电极表面被其还原,反过来催化剂将SOCl2还原,使催化剂复原,完成了整个循环过程。Su X Q 等[15]课题组用H2Pp(3)、CuPp(3a)及ZnPp(3b)作为Li/SOCl2电池的正极催化剂,对其催化性能进行了评价,结果表明,加入H2Pp(3),CuPp(3a)及ZnPp(3b)后,Li/SOCl2电池的放电时间分别增加了480-780 s,此外,对其电池催化机理也进行了初步探讨。最近,我们课题组合成了两种自由卟啉及其金属铜卟啉和锌卟啉[16],与空白相比,当加入含有这些卟啉的电解液时,尤其是酯基金属锌卟啉时,能有效的提高电池的放电电压与放电时间。
卟啉类化合物对Li/SOCl2催化性能的研究尚处于初步研究阶段[17-19]。一般而言,卟啉共轭性越好,电子云密度越大,位阻效应越小,卟啉化合物的催化性能就越好,因此,本文采用Adler-Longo 法和亲核取代法两种方法设计合成了酯基金属锌卟啉化合物[20-21]。首先,以单羟基卟啉H2Pp(1)为原料,然后与1,2-二溴乙烷发生取代反应生成带有活性基团的单溴代卟啉(BrH2Pp),再与丙二酸二乙酯反应,得到一种新型的自由卟啉H2Pp(2)[5-[4-(丙二酸二乙酯)-苯氧基)乙氧基]苯基-10,15,20-三苯基卟啉];同时,制备了该自由卟啉的金属锌卟啉配合物ZnPp,对所合成的化合物进行了元素分析、FT-IR、UV-vis、MS 表征及图谱分析,并将其应用于Li/SOCl2电池,最后结合电池催化结果提出了其可能的催化机理。
1 材料与方法
1.1 材料与试剂
吡咯(C4H5N,使用前重蒸,上海国药集团化学试剂有限公司),对羟基苯甲醛(C7H6O2,上海国药集团化学试剂有限公司),丙二酸二乙酯(CH2(COOC2H5)2,上海国药集团化学试剂有限公司),苯甲醛(C7H6O,天津化学试剂有限公司),1,2-二溴乙烷(C2H4Br2,阿拉丁试剂有限公司),醋酸锌(Zn(CH3COO)2·2H2O,天津市耀华化学试剂有限责任公司),柱层析硅胶(xSiO2·yH2O,80-100 目,青岛海洋化工有限公司),氯化铝锂(广东省化学试剂工程技术研究开发中心),PP 隔膜(厦门市奇磊工贸有限公司),亚硫酰氯和碳膜以及锂片由中国兵器工业集团212 机电信息研究所提供。
1.2 仪器与设备
电子分析天平(BS 124S,赛多利斯科学仪器(北京) 有限公司),紫外-可见光谱仪(UV1800,Shimadzu 岛津国际贸易(上海)有限公司),红外光谱仪(BEQ UZNDX550-FTIR,KBr 压 片,Bruker,德国),元素分析仪(Vario EL-III,德国),WRS-1A数字熔点仪(上海物理光学仪器厂),基质辅助激光解吸附电离飞行质谱仪(MALDI-TOF MS,岛津集团英国克雷斯托分析仪器公司),数字万用表(VC9807A,深圳市胜利龙仪器仪表有限公司),电化学工作站(RST5200,郑州世瑞思仪器科技有限公司),模拟电池装置。
1.3 H2Pp(1)及BrH2Pp 的合成
1.3.1 单羟基卟啉H2Pp(1)的合成
单羟基卟啉H2Pp(1)的合成见图1。
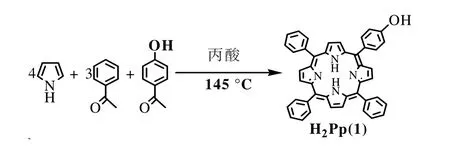
图1 H2Pp(1)的合成路线Fig.1.Syntheses of the metal-free porphyrin H2Pp(1)
卟啉H2Pp (1) 的合成采用著名的Adler-Longo法,并对其合成方法加以改进,具体步骤如下:量取150 mL 的丙酸于500 mL 的三颈烧瓶中,按一定比例,分别加入苯甲醛(4.6 mL,45 mmol)和对羟基苯甲 醛(1.8318 g,15 mmol),回 流 约15 min 后 在10-15 min 内滴加吡咯(4.15 mL,60 mmol),继续反应40-55 min 后停止反应,减压除去丙酸后加入20 mL 左右的无水乙醇,冷却静置过夜,减压抽滤得到紫色固体后,以CH2Cl2为洗脱剂,硅胶过柱,收集第二谱带,得到H2Pp(1)。
产率:6.3%;熔点:>250 ℃;元素实测值(%,C44H30N4O计算值):C83.75(83.82),H4.79(4.75),N8.91(8.88);MS 值:m/z630.74(理论值:630.24);UV-vis (CH2Cl2)λmax /nm:420(Soret band),517,550,590,654(Q bands);FI-IR(KBr压片)ν/cm-1:3449,3058,2922,1641,1505,1469,1351,1262,972,799,709。
1.3.2 溴代卟啉(BrH2Pp)的合成
溴代卟啉(BrH2Pp)的合成见图2。
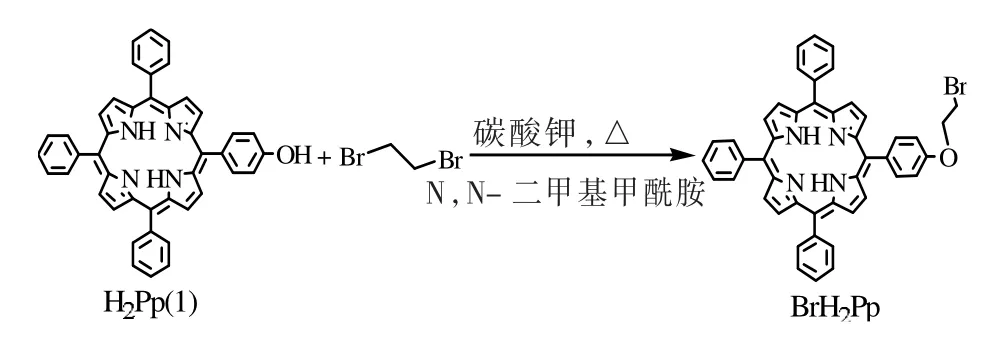
图2 BrH2Pp 的合成路线Fig.2 . Syntheses of the metal-free porphyrin BrH2Pp
步骤如下:称取H2Pp(1)(0.40 g,0.64 mmol)和0.30 g K2CO3于50 mL 的三颈烧瓶中,无水条件下通入N2作为保护(约30 min 后可停止,这样可以减少卟啉二聚物的生成,提高反应产率),1,2-二溴乙烷(1.60 mL,19.2 mmol),再加入15 mL 左右的重蒸DMF 作为溶剂,T=60 ℃下反应10 h,TLC 监测反应至接近完全,停止反应,减压除去DMF,剩余物以CH2Cl2为洗脱剂过硅胶柱分离,收集第一谱带得即到目标产物BrH2Pp(Fig.2 )。
产率:51%;熔点>250 ℃;元素分析实测值(%,C46H33N4OBr 计算值):C74.80(74.90),H4.32 (4.51),N7.68(7.59);MS:m/z736.18(理论值:737.68);UV-vis(CH2Cl2):λmax/nm:418 (Soret band),515,551,591,647(Q bands);FT-IR(KBr 压片):υ/cm-1,3449,3054,2922,2856,1638,1464,1235,1075,968,798,701。
1.3.3 酯基卟啉H2Pp(2)的合成
酯基卟啉H2Pp(2)的合成见图3。
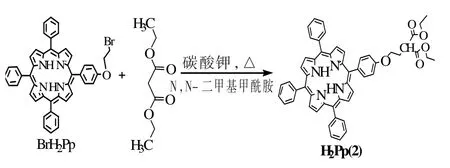
图3 H2Pp(2)的合成路线Fig.3 . Syntheses of the metal-free porphyrinH2Pp(2)
具体步骤如下:将溶有BrH2Pp(0.05 g,0.068 mmol)的DMF(10 mL)加入100 mL 干燥的三颈烧瓶中,并依次加入K2CO3(0.15 g)和丙二酸二乙酯(0.15 g,1.36 mmol),在60 ℃左右磁力搅拌反应24 h。反应结束后,以CH2Cl2为洗脱剂,硅胶过柱分离,收集主色谱带,得到H2Pp(2)。
产率:36%;熔点>250 ℃;元素实测值(%,C53H44N4O5计算值):C 77.94 (77.92),H 5.38 (5.43),N 6.84(6.86);MS:m/z 817.12(理论值:816.94);UV-vis(CH2Cl2):λmax/nm,418(Soretband),516,551,588,647(Qbands);FTIR(KBr 压片):υ/cm-1,3445,3050,2926,2856,1712,1610,1508,1456,1236,1070,965,800。
1.3.4 酯基金属锌卟啉ZnPp 的制备
ZnPp 的合成路线如图4所示。
制备过程如下:分别将溶有0.1 mmol 自由卟啉H2Pp(2)的CH2Cl2溶液加入100 mL 烧瓶中,然后向其中加入20 mL 溶有0.1 mmol 金属醋酸锌(0.10 g)的C2H5OH 溶液,常温下反应24 h,用TLC 适时监测反应过程,然后过滤未反应的金属醋酸锌,减压除去溶剂,以层析硅胶为固定相,CH2Cl2为淋洗剂进行柱层析分离提纯,收集主色带,浓缩后即可得到相应的金属卟啉。
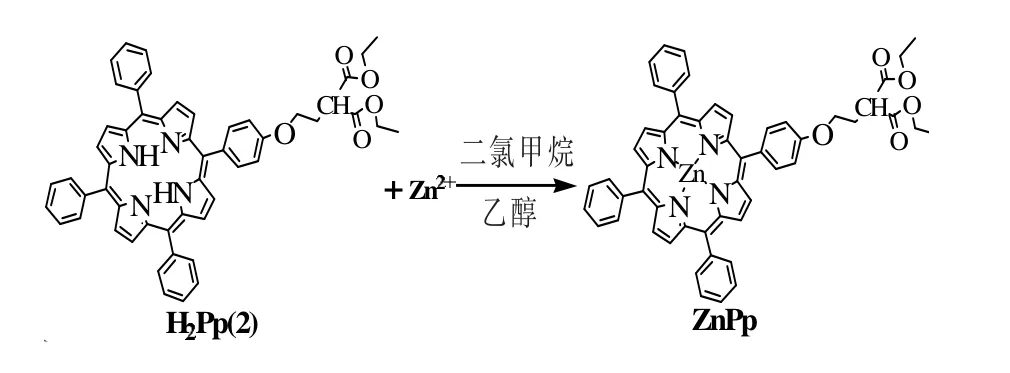
图4 ZnPp 的合成路线Fig.4 Syntheses of the metalloporphyrin ZnPp
产率:90%;熔点:>250 ℃;元素实测值(%,C53H42N4O5Zn 计算值):C76.16 (76.14),H 4.09 (4.07),N 8.04 (8.07);MS:m/z878.55(理论值:880.33);UV-vis(CH2Cl2):λmax/nm,420(Soret band),550,592(Q bands);FT-IR(KBr 压 片):υ/cm-1,3416,2930,2855,1638,1616,1504,1459,1372,1337,1284,1240,1067,997,800。
2 电池性能测试
电池壳体由聚四氟乙烯设计而成,负极为金属锂片,正极为碳膜(电池模型如图5所示),电解液为1.47 mol/L 的LiAlCl4/SOC12,正负极之间由聚丙烯膜(PP 膜)做为隔膜隔开,电极使用前用砂纸打磨。
组装电池前,碳膜、隔膜、催化剂及电池壳体均在70 ℃真空干燥,然后在相对湿度小于3%的手套箱(气氛为干燥空气)中装配电池,将2 mg 酯基金属锌卟啉ZnPp 溶解在1 mL 电解液中,注入到电池模具中进行电化学性能测试[22]。
在干燥空气的氛围中,控制环境温度23-25°C,将组装好的电池在外置恒定电阻Re=100.6 Ω 时连续放电至2 V,平均电流为70 mA,每一秒记录一次数据,记录电池放电电压随时间的变化关系,以Li/SOCl2电池的放电电压对放电时间作图。
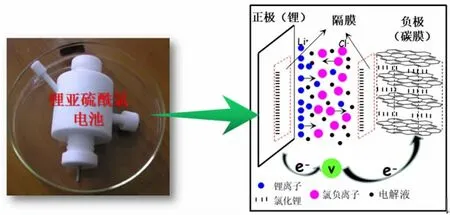
图5 Li/SOCl2 电池模型示意图(左)和结构示意图(右)Fig.5 The model (left) and structural diagram (right) of Li/SOCl2 battery
3 结果与讨论
与空白相比,当加入含有ZnPp 的电解液时,Li/SOCl2电池放电电压和放电时间均有增加,结果(图6)显示:
(1)加入含有ZnPp 的Li/SOCl2电池的放电时间由空白的1080 s 增加到了1643 s,放电时间延长了563 s,增幅为52.13%。
(2)加入卟啉催化剂ZnPp 后其放电电压处于3 V 以上的时间得到延长,相对于空白延长了95.5 s,这对Li/SOCl2电池的实际应用非常重要,说明酯基金属卟啉化合物ZnPp 加入后能使电池的放电性能得到增强,或者说是使电池在3 V 以上的放电稳定性得到了提高。
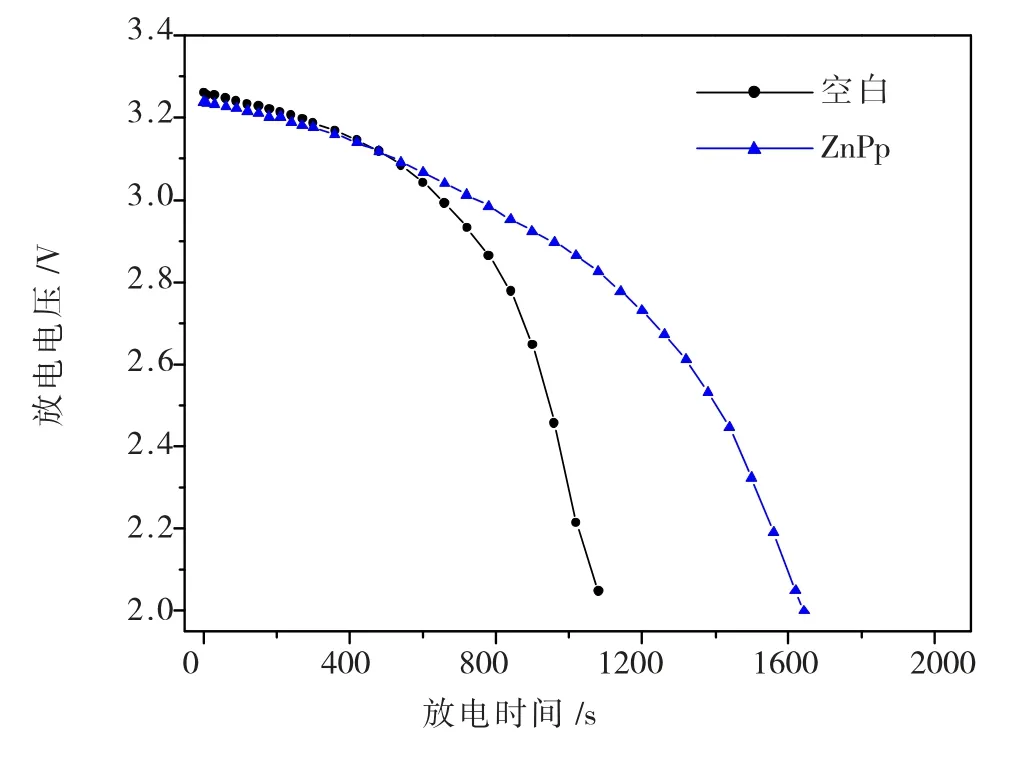
图6 金属酯基锌卟啉ZnPp 催化Li/SOCl2 电池的放电电压与放电时间的关系图Fig.6 . The discharge curves of Li/SOCl2 battery
为了进一步分析讨论电池放电电压Uav、放电时间s、电池容量C和电池相对容量量X(%)与ZnPp 之间的关系,采用以下公式:平均电压

电池容量
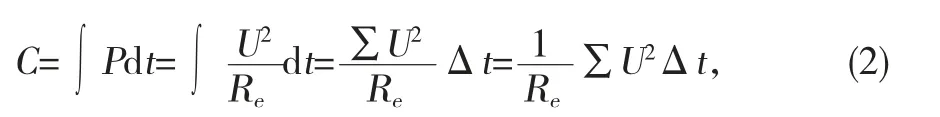
电池相对能量

其中,Re=100.6 Ω。
将相关数据代入式(3)中计算,电池的相对能量图如7 所示。
从图7可知:与空白相比,加入酯基金属锌卟啉ZnPp 化合物后电池容量提高到了135.46 J,增幅达39.27%。
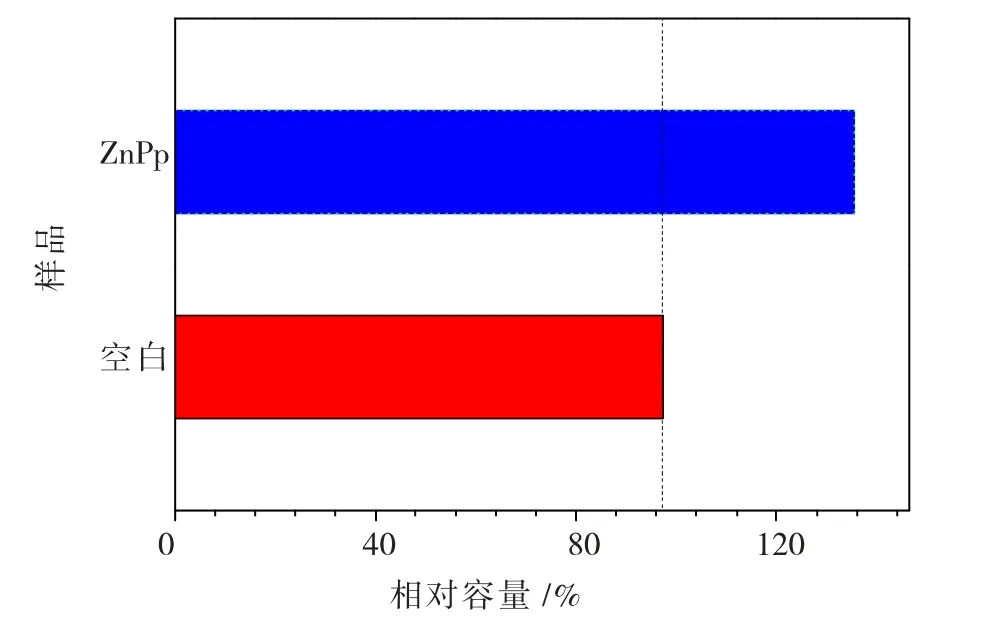
图7 Li/SOCl2 电池相对容量图Fig.7 Energy of Li/SOCl2 battery in presence of ZnPp
在Li/SOCl2电池体系中,金属Li 为负极,活性物质SOCl2为正 极,LiAlCl4(SOCl2)作为电解液,碳极 作为惰性电极,电池反应如下:
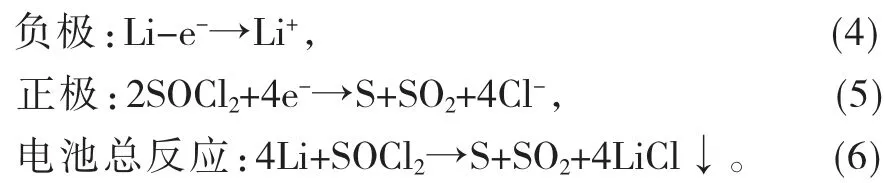
为什么该酯基金属锌卟啉ZnPp 对Li/SOCl2电池有如此较高的催化活性?根据实验结果及吕向菲等[23]所提出的催化机理,本文分析了其中的原因,提出了单核金属卟啉的“双活性点模型”的催化机理。金属酯基锌卟啉ZnPp 催化还原SOCl2经历了3 个过程,其中ZnPp·SOCl2还原为关键步骤。
第一过程,SOCl2吸附在ZnPp 的表面,SOCl2中的O 与ZnPp 中的Zn2+发生配位,形成ZnPp·SOCl2加合物(式(7));然后,加合物ZnPp·SOCl2发生两步快速的电子转移(式(8)),脱去Cl- 生成中间产物ZnPp·SOCl,最后,生成产物ZnPp,S 和SO2(式(9)):

第二过程,卟啉自身和其外围取代基都可以作为催化活性的位点,这种协同作用使Li/SOCl2电池的电化学性能得到改善。
第三过程,在Li/SOCl2电池放电过程中,锂负极Li+表面会形成一层致密的LiCl 薄膜,其反应式为Li++Cl-→ LiCl,将会产生电压滞后现象,而金属酯基锌卟啉ZnPp 的加入则延缓或阻碍了LiCl 薄膜的形成,内阻减小,提高了氧化还原反应发生的效率,使得电池电压和放电时间得到了改善[24]。
4 结论
(1) 本文成功合成了一种新的酯基金属锌卟啉ZnPp 化合物。
(2)与空白电池相比,当在Li/SOCl2电池的电解液中添加ZnPp 后,其放电时间延长了563 s(空白为1080 s),电池容量提高了39.27%,表明该催化剂能有效改善Li/SOCl2电池的催化性能。
(3) 通过对Li/SOCl2电池催化机理的进一步分析,提出了单核金属卟啉的“双活性点模型”的催化机理,为Li/SOCl2电池进一步设计研究和应用奠定了一定基础。

