线粒体融合蛋白-1对牙周膜干细胞成骨分化能力的影响
翟启明 李蓓 刘露 张青 金钫
牙周炎是一种慢性炎症性疾病,表现为牙周支持组织持续破坏,可导致牙齿丧失。然而目前的牙周治疗手段并不能修复已丧失的牙周组织。牙周膜中存在一类具有自我分化能力的间充质干细胞——牙周膜干细胞(Periodontal ligament stem cells,PDLSCs)[1]。以往研究表明,牙周炎来源的PDLSCs在脱离微环境多次传代后,仍表现出成骨分化能力下降[2-3],因此明确炎症PDLSCs成骨分化能力下降的调控机制是对于牙周组织再生修复具有重要意义。
线粒体作为细胞中重要的细胞器,参与细胞的增殖、分化、凋亡等过程[4]。线粒体融合蛋白-1(Mitofusin-1,Mfn1)位于线粒体外膜上,参与调控线粒体融合分裂的动态过程[5],同时能够介导内质网-线粒体偶联。研究表明,线粒体动态行为异常与线粒体形态调控、钙信号调控、内质网应激等都有密切联系[6]。然而,Mfn1在调控PDLSCs再生能力过程中发挥的作用尚未见报道。
本研究通过PCR检测正常、炎症来源、以及模拟炎症微环境下PDLSCs中Mfn1的表达水平,并进一步通过在P-PDLSCs中转染siMfn1下调P-PDLSCs中的Mfn1观察其成骨分化能力改变,探讨Mfn1在PDLSCs中对成骨分化能力的影响,为牙周病的治疗提供理论基础和治疗靶点。
1 材料与方法
1.1 主要试剂和仪器
α-MEM培养基、L-谷胺酰胺、PBS缓冲液、1 000 U/ml青霉素、1 000 U/ml链霉素(Gibco,美国);胰蛋白酶(Amresco,美国);胎牛血清(四季青,浙江天杭生物科技公司);I型胶原酶、β-甘油磷酸钠、维生素C、地塞米松、茜素红、TNF-α(Sigma,美国);Trizol Regent(Life Technologies,美国);siMfn1(Santa Cruz,美国);cDNA反转录试剂盒及实时定量PCR试剂盒(Takara,日本);体式显微镜、倒置相差显微镜及照相系统、激光共聚焦显微镜(Olympus,日本);6孔板、平底96孔板(Falcon,美国);二氧化碳恒温培养箱、酶联免疫检测仪(Thermo,美国);CFX96实时荧光定量PCR仪(Bio-Rad,美国);流式细胞仪(Beckman-Coulter,美国)。
1.2 方法
1.2.1 PDLSCs的分离培养 收集年龄20~40岁因正畸需要拔除的健康正畸牙、智齿及牙周炎患者的牙齿(健康及牙周炎来源牙齿各20颗),PBS冲洗后刮取牙周膜组织,I型胶原酶37℃消化1 h。等体积含10%胎牛血清的α-MEM终止消化,800 r/min离心5 min,弃上清液。α-MEM培养基/重悬后接种于6孔板,置于恒温37℃、5%CO2孵箱中培养。待细胞爬出组织块,获取原代牙周膜干细胞。
1.2.2 PDLSCs的干细胞鉴定 取第1代H-PDLSCs与 P-PDSLCs,消化、离心、PBS清洗、重悬后,加入 1.5 ml EP管中,加入 2μl鼠抗人 CD29、CD90、CD45、CD34抗体,避光孵育1 h,PBS清洗,流式细胞仪检测细胞表面标志物。
1.2.3 IL-1β体外模拟炎症微环境 选取第4代的H-PDLSCs,传代至6孔板,细胞汇合度达80%后,在H-PDLSCs中分别加入0、5μg/ml IL-1β培养,每2天换液1次。
1.2.4 siMfn1转染细胞 转染前将细胞接种至6孔板,待细胞汇合度达90%~95%时,转染前2 h换无血清无双抗培养液。以Lipo 6000为载体,实验组转入siMfn1,对照组仅加入Lipo 6000,6 h后终止转染。24~48 h后提取RNA,检测其干扰效率。
1.2.5 成骨诱导培养 接种细胞后,加入成骨诱导培养基诱导(地塞米松100 nmol/L,10%胎牛血清的α-MEM、维生素 C 50 mg/L、β甘油磷酸钠 10 mmol/L)。成骨诱导第7天提取两组RNA,实时定量PCR检测RUNX2、ALP和OCN成骨相关基因表达。成骨诱导第28天进行茜素红染色及氯化十六烷基吡啶定量:60%异丙醇室温固定5 min,ddH2O水化处理细胞2 min,染色1 min,ddH2O冲洗2次,大体及镜下观察矿化结节形成情况。照相后每孔加入氯化十六烷基吡啶,充分溶解,96孔板,每组6个复孔,酶联免疫检测仪检测吸光值。
1.2.6 RT-PCR检测方法检测 Mfn1、ALP、RUNX2与OCN mRNA表达 将所需样本去除培养基,PBS清洗2遍。用Trizol一步法抽提总RNA,RNA质检合格后逆转录合成cDNA。PCR引物序列见表1。本研究所用引物皆由上海生工生物工程技术有限公司合成。以GAPDH为内参,检测基因相对表达量。
1.3 统计学分析
用SPSS 16.0软件对数据进行统计分析,采用两独立样本t检验,结果以±s表示。双侧P<0.05为差异有统计学意义。

表1 基因引物序列Tab 1 Primer sequences
2 结 果
2.1 PDLSCs间充质干细胞鉴定
流式细胞仪检测结果表明,H-PDLSCs与 PPDLSCs中,间充质干细胞标记物CD29、CD90均呈强阳性表达,造血系统来源细胞表面标记物CD34、CD45均呈阴性表达,以上结果说明本次实验所分离培养的PDLSCs为间充质干细胞(图1)。
2.2 牙周炎来源的P-PDLSCs成骨分化能力下降
分别分离培养正常及炎症来源牙周膜干细胞HPDLSCs与P-PDLSCs,经成骨诱导7 d后,P-PDSLCs中成骨相关基因ALP、RUNX2与OCN表达量较HPDLSCs低(图2A)。成骨诱导28天后茜素红染色及氯化十六烷基吡啶结果显示,P-PDLSCs的矿化结节形成能力低于H-PDLSCs(图 2B、2C)。上述实验验证了牙周炎来源的PDLSCs成骨分化能力下降。
2.3 IL-1β模拟炎症微环境下的PDLSCs成骨分化能力下降
与H-PDLSCs组相比,炎症因子IL-1β模拟炎症微环境下的 PDLSCs,成骨诱导 7 d后,其 ALP、RUNX2、OCN表达量下降(图3A)。同时成骨诱导28 d后,其茜素红染色及氯化十六烷基吡啶结果显示,其矿化结节形成能力下降(图3B、3C)。上述实验说明,在应用5μg/ml的IL-1β刺激7 d的情况下,可以引起PDLSCs成骨分化能力下降,这种趋势与牙周炎患者体内分离出的P-PDLSCs的成骨分化能力下降表现一致。由此可知,炎症微环境可导致PDLSCs成骨分化能力下降。
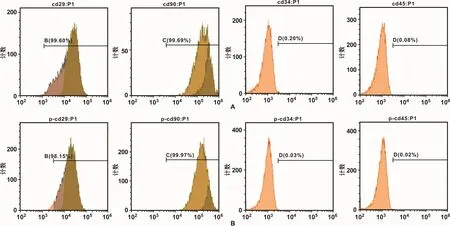
图1 流式细胞仪检测H-PDLSCs与P-PDLSCs细胞表面标记物的表达情况Fig 1 The examination ofmesenchymal stem cell phenotype by flow cytometric analysis

图2 H-PDLSCs与P-PDLSCs成骨分化能力的比较Fig 2 The comparison of osteogenesis differentiation capability between H-PDLSCs and P-PDLSCs
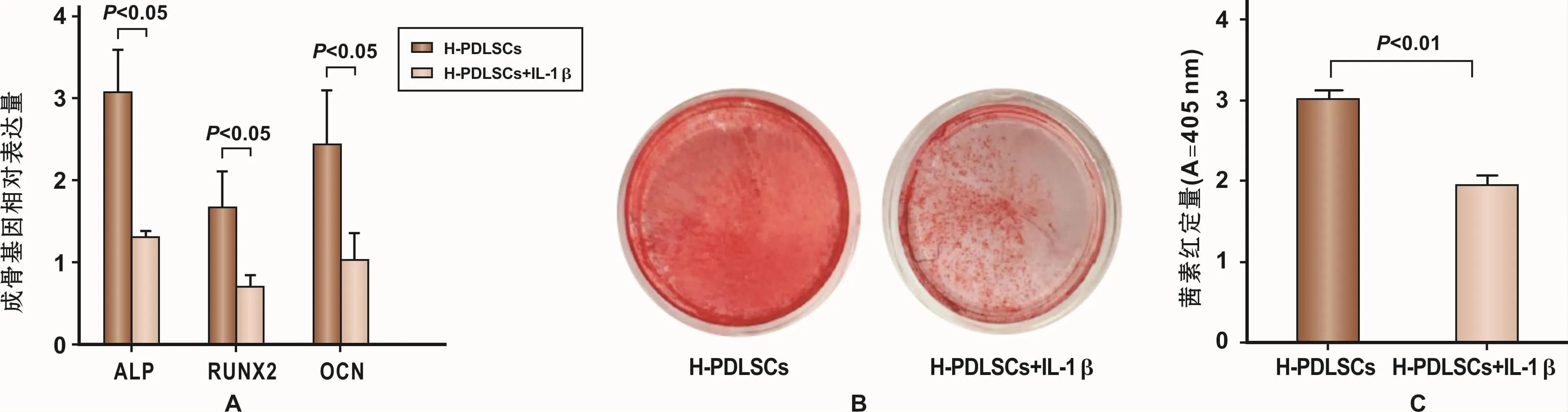
图3 IL-1β模拟体外炎症微环境下PDLSCs成骨分化能力Fig 3 The osteogenesis differentiation capability of H-PDLSCs stimulated by IL-1β
2.4 炎症微环境下PDLSCs中Mfn1表达升高
RT-PCR结果显示,与正常来源的H-PDLSCs相比,牙周炎来源的P-PDLSCs中Mfn1基因表达量显著升高(图 4A)。同时,在H-PDLSCs+IL1β组中,IL-1β模拟体外微环境下的Mfn1表达量也呈升高趋势(图4B)。
2.5 下调Mfn1基因促进PDLSCs成骨分化
小干扰RNA siMfn1能够特异性下调Mfn1基因的表达。在P-PDSLCs中转染SiMfn1后,基因水平检测M fn1下调效果,RT-PCR结果表明转染有效(图5A)。

图4 Mfn1在3组细胞中的表达Fig 4 MORF level in the 3 groups
在P-PDLSCs中下调Mfn1后进行成骨诱导。成骨诱导7 d,RT-PCR结果显示成骨基因ALP、RUNX2、OCN表达量升高(图5B);成骨诱导28 d,茜素红染色及氯化十六烷基吡啶结果显示,P-PDLSCs+SiMfn1组较P-PDLSCs组矿化结节形成能力增加(图5C、5D)。
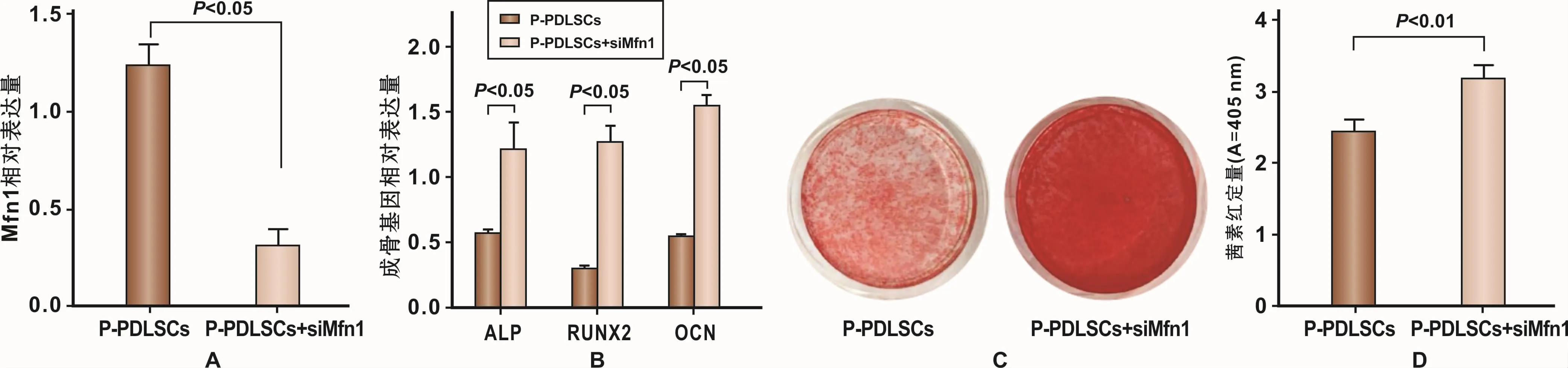
图5 下调Mfn1表达对P-PDLSCs成骨分化能力的影响Fig 5 The evaluation of osteogenesis differentiation capability of P-PDLSCs following down-regulation of Mfn1
3 讨 论
越来越多的研究表明,线粒体功能异常与众多疾病的发生发展密切相关。线粒体作为细胞的“能量工厂”,是细胞中能量的主要来源,参与多种物质代谢和钙稳态的调控,同时对于细胞的增殖、凋亡具有重要意义[7]。不同于其他细胞器,线粒体拥有其自身的遗传体系和遗传物质,是具有自我复制能力的半自主细胞器。线粒体具有双层膜结构,它并不静止的存在于细胞中,而是处于不断融合与分裂的动态运动中[8],由此产生了细胞中大小、长短、形态不一的线粒体。线粒体可以通过这种高度运动的状态,使不良线粒体可以通过相互融合的方式得以修复,也可以通过分裂进而启动线粒体自噬,使细胞内质量较差的线粒体得以清除[9-10]。有研究表明,线粒体动态异常与帕金森疾病、心肌梗死、动脉粥样硬化等疾病具有重要相关性[11-12]。课题组前期研究发现,炎症微环境中PDLSCs出现内质网应激[13],而细胞中的内质网与线粒体存在线粒体融合蛋白介导的结构偶联[14]。另有研究发现,侵袭性牙周炎与部分线粒体基因缺失突变有关[15]。然而,在炎症微环境下,PDLSCs中线粒体融合蛋白是否发生改变,以及其是否能进一步影响PDLSCs的成骨分化尚不清楚。
线粒体融合蛋白-1(mitofusin 1,Mfn1)位于线粒体外膜,是一种GTP酶蛋白,当其被GTP水解酶,可以促进线粒体外膜的快速融合[8]。此外,线粒体外膜上的Mfn1还能够与内质网膜上的Mfn2相互连接,搭建起内质网与线粒体间的“物理桥梁”[14]。研究表明,当Mfn1发生突变后,会引起线粒体融合功能的降低,进一步引起细胞功能的紊乱[16-17]。IL-1β是一种致炎因子,在给予PDLSCs脂多糖刺激后,可检测到IL-1β的分泌[18],同时可以激活多个炎症相关通路[19],因此本实验采用IL-1β模拟炎症微环境。本研究的实验结果表明,与正常来源PDLSCs相比,炎症及IL-1β模拟炎症微环境下的PDLSCs中Mfn1表达量升高,说明炎症微环境影响Mfn1的表达。同时,本研究也验证了炎症来源及模拟炎症微环境下的PDLSCs成骨分化能力下降,而下调P-PDLSCs中的Mfn1表达水平后,其成骨分化能力增强,表明Mfn1对于PDLSCs的成骨分化能力具有调控作用。
以上结果表明,在炎症环境中,线粒体融合蛋白-1的表达发生改变,并可能由此影响了其介导的线粒体融合及内质网-线粒体偶联,从而使线粒体发生功能紊乱、代谢异常或线粒体内遗传物质的,而进一步导致PDLSCs成骨分化能力的下降。在临床上,针对性的下调Mfn1表达水平,或使用Mfn1抑制药物,可能会成为治疗牙周炎的新靶点。然而,炎症是如何影响Mfn1的表达,以及Mfn1表达改变后,会引起哪些体功能的变化从而导致了成骨分化能力的下降,这些机制仍需要深入研究和探讨。
[1]Seo BM,Miura M,Gronthos S,etal.Investigation ofmultipotent postnatal stem cells from human periodontal ligament[J].Lancet,2004,364(9429):149-155.
[2]Liu N,Shi S,Deng M,et al.High levels ofβ-catenin signaling reduce osteogenic differentiation of stem cells in inflammatorymicroenvironments through inhibition of the noncanonicalWnt pathway[J].J Bone Miner Res,2011,26(9):2082-2095.
[3]Liu Y,Liu W,Hu C,et al.MiR-17 modulates osteogenic differentiation through a coherent feed-forward loop in mesenchymal stem cells isolated from periodontal ligaments of patientswith periodontitis[J].Stem Cells,2011,29(11):1804-1816.
[4]Kasahara A,Scorrano L.Mitochondria:From cell death executioners to regulators of cell differentiation[J].Trends Cell Biol,2014,24(12):761-770.
[5]Youle RJ,van der Bliek AM.Mitochondrial fission,fusion,and stress[J].Science,2012,337(6098):1062-1065.
[6]Son MJ,Kwon Y,Son MY,et al.Mitofusins deficiency elicitsmitochondrialmetabolic reprogramming to pluripotency[J].Cell Death Differ,2015,22(12):1957-1969.
[7]Luchsinger LL,de Almeida MJ,Corrigan DJ,et al.Mitofusin 2 maintains haematopoietic stem cells with extensive lymphoid potential[J].Nature,2016,529(7587):528-531.
[8]Otera H,Mihara K.Molecularmechanisms and physiologic functions ofmitochondrial dynamics[J].JBiochem,2011,149(3):241-251.
[9]Westrate LM,Drocco JA,Martin KR,et al.Mitochondrial morphological features are associated with fission and fusion events[J].PLoSOne,2014,9(4):e95265.
[10]Song M,Franco A,Fleischer JA,et al.Abrogating mitochondrial dynamics inmouse hearts acceleratesmitochondri-al senescence[J].Cell Metab,2017,26(6):872-883.
[11]Kasahara A,Cipolat S,Chen Y,etal.Mitochondrial fusion directs cardiomyocyte differentiation via calcineurin and Notch signaling[J].Science,2013,342(6159):734-737.
[12]Mei YQ,Pan ZF,Chen WT,et al.A flavonoid compound promotes neuronal differentiation of embryonic stem cells via PPAR-βmodulating mitochondrial energy metabolism[J].PLoSOne,2016,11(6):e0157747.
[13]Xue P,Li B,An Y,et al.Decreased MORF leads to prolonged endoplasmic reticulum stress in periodontitis-associated chronic inflammation[J].Cell Death Differ,2016,23(11):1862-1872.
[14]van Vliet AR,Verfaillie T,Agostinis P.New functions of mitochondria associated membranes in cellular signaling[J].Biochim Biophys Acta,2014,1843(10):2253-2262.
[15]郭园,王啸轩,栾庆先.线粒体基因7.4kbp大片段缺失突变与侵袭性牙周炎的关系研究[J].实用口腔医学杂志,2014,30(1):99-102.
[16]ForniMF,Peloggia J,Trudeau K,etal.Murinemesenchymal stem cell commitment to differentiation Is regulated by mitochondrial dynamics[J].Stem Cells,2016,34(3):743-755.
[17]Son JM,Sarsour EH,Kakkerla Balaraju A,et al.Mitofusin 1 and optic atrophy 1 shiftmetabolism tomitochondrial respiration during aging[J].Aging Cell,2017,16(5):1136-1145.
[18]Kong X,Liu Y,Ye R,et al.GSK3βis a checkpoint for TNF-α-mediated impaired osteogenic differentiation ofmesenchymal stem cells in inflammatorymicroenvironments[J].Biochim Biophys Acta,2013,1830(11):5119-5129.
[19]Mao CY,Wang YG,Zhang X,et al.Double-edged-sword effect of IL-1βon the osteogenesis of periodontal ligament stem cells via crosstalk between the NF-κB,MAPK and BMP/Smad signaling pathways[J].Cell Death Dis,2016,7:e2296.

