响应曲面法优化酶解豆粕蛋白制备降糖肽的工艺
余 敏,黄晶晶,付瑞燕,谢宁宁,*,殷俊峰,鄢 嫣,张福生
(1.安徽省农业科学院农产品加工研究所,安徽合肥 230031;2.安徽农业大学茶与食品学院,安徽合肥 230036)
降糖肽通常指能够用于治疗II型糖尿病的一类活性肽[1],目前主要来源于苦瓜[2]、山杏[3]、人参[4]、海产[5]和乳[67]等。而葡萄糖苷酶抑制剂作为降糖肽的一种[8],能够竞争性抑制小肠葡萄糖苷酶活性,延缓或抑制葡萄糖吸收,有效降低餐后血糖[9]。豆粕,是大豆经过冷榨制油后得到的副产品,蛋白质含量约为45%~52%。豆粕蛋白经过酶解处理后,才能够生成具有多种生物功能的活性肽,主要包括抗氧化肽[10]、血管紧张素转化酶(ACE)抑制肽[1112]、金属螯合肽[13]等。研究团队前期研究发现,豆粕蛋白酶解产物具有优异的α葡萄糖苷酶抑制活性,可作为葡萄糖苷酶抑制剂降糖肽的良好来源。目前降糖肽的生产工艺包括将苦瓜汁稀释后经过超滤分离降糖肽[2]或采用碱溶酸沉法提取山杏蛋白[3]等,生产成本较高,环境污染较重。同时,豆粕蛋白酶解产物浓度高、溶解性好,且未见豆粕蛋白降糖肽的相关研究报道。因此,利用蛋白酶解豆粕生产降糖肽前景较好[4]。
本研究以大豆豆粕为原料,采用蛋白提取和酶解技术,运用单因素实验和响应曲面实验设计优化碱性蛋白酶(Alcalase)水解大豆豆粕工艺,并进行工艺验证,以期为豆粕蛋白的开发利用提供新的解决策略。
1 材料与方法
1.1 材料与仪器
大豆豆粕 合肥立新食品科技有限公司(粗蛋白质≥46.0%);盐酸、硫酸 分析纯,国药集团化学试剂有限公司;十二水磷酸氢二钠、二水磷酸二氢钠、碳酸钠 分析纯,北京化工厂;石油醚 分析纯,天津市津东天正精细化学试剂厂;α葡萄糖苷酶 液态,酶活≥50 units/mg蛋白质,上海源叶生物科技有限公司;碱性蛋白酶 液态,酶活0.6 AU/g,丹麦诺和诺德公司;4硝基苯酚βD吡喃葡萄糖苷 PNPG,液态,上海宝曼生物科技有限公司。
JA1103N型电子天平 上海民桥精密科学仪器有限公司;PHS3C型pH计 上海仪电科学仪器股份有限公司;TGL16M型离心机 长沙湘智离心机仪器有限公司;FD1CE型冷冻干燥机 北京德天佑科技发展有限公司;HR801型酶标分析仪 深圳市华科瑞科技有限公司;ZD85型气浴恒温振荡器 江苏金坛市精达仪器制造有限公司;HH型数显恒温水浴锅 江苏金坛市金城国胜实验仪器厂。
1.2 实验方法
1.2.1 工艺流程 大豆豆粕→脱脂→碱提取、酸沉淀→冷冻干燥→大豆蛋白粉→溶解→调节pH成碱性→加酶→酶解→灭酶→调节pH→离心→取上清液→测定α葡萄糖苷酶的抑制率。
1.2.2 蛋白提取 将大豆豆粕浸泡于石油醚中,多次更换石油醚,直至石油醚层用旋转蒸发仪蒸干后无剩余物质,说明脱脂彻底。抽滤,置于通风橱中室温干燥12 h,密封保存。
采用碱溶酸沉法[3]提取大豆豆粕分离蛋白。将脱脂大豆豆粕用去离子水溶解,料液比1∶10(w∶v)。待完全溶解后用0.2 mol/L NaOH溶液调节pH至9.0,静置60 min,抽滤,收集液体于室温下以4000 r/min离心15 min,收集上清液。然后用0.2 mol/L HCl溶液将上清液的pH调至4.0,静置30 min,再次于室温下以5000 r/min离心15 min,取其下层沉淀物质,在干燥器中密封保存。
蛋白提取率(%)=提取的蛋白干重/豆粕中总蛋白干重×100
其中,干重是在恒温干燥箱中将材料烘干(105 ℃)至恒重,用分析天平称量获得。
1.2.3 酶解 称取适量大豆豆粕蛋白粉,加入适量去离子水溶解配制成具有一定浓度的蛋白溶液。将温度调节至酶解反应温度,用NaOH溶液与HCl溶液将pH调节至反应所需值,加入一定比例的碱性蛋白酶,放入气浴恒温振荡器中进行恒温酶解,保持反应体系pH恒定,达到预定反应时间后,将酶解液放入沸水浴15 min,使酶钝化。酶解液在室温中冷却后,用NaOH溶液与HCl溶液调节pH至中性,于室温下以4000 r/min离心10 min,所需的豆粕蛋白降血糖粗肽存在于上清液中,将其冷冻保存备用。采用TNBS法测定蛋白水解度(DH)[14]。
1.2.4 活性测定 在2 mL的离心管中依次加入5 μL 30 U/mL的α葡萄糖苷酶溶液、10 μL的样品溶液、620 μL 0.1 mol/L pH为6.8的磷酸盐缓冲液(PBS),混匀后在37.5 ℃条件下反应20 min。然后加入10 μL 10 mmol/L的PNPG溶液,混匀后在37.5 ℃条件下反应30 min。最后加入650 μL 0.2 mol/L的碳酸钠溶液终止反应。用分光光度计测定每个样品在410 nm波长下的最大吸光度[15]。α葡萄糖苷酶抑制率计算公式为:
α葡萄糖苷酶抑制率(%)=[A空白(A样品-A样品对照)]/A空白×100
其中,A空白、A样品、A样品对照分别为空白组、样品组和样品对照组对应的吸光度值。
1.2.5 单因素实验 选择初始pH(6.0、7.0、8.0、9.0、10.0、11.0)、酶解温度(35、40、45、50、55、60、65 ℃)、酶解时间(1、2、3、4、5、6 h)、加酶量(1.0%、1.2%、1.4%、1.6%、1.8%、2.0%、2.2%、2.4%、2.6%、2.8%、3.0%)和料液比(1∶100、2∶100、3∶100、4∶100、5∶100、6∶100、7∶100、8∶100、9∶100)5个因素作单因素实验,考察各单因素对酶解产物α葡萄糖苷酶抑制活性的影响。将其中一个作为单因素时,其他四个因素的固定实验水平分别是初始pH9.0、酶解温度45.0 ℃、酶解时间6 h、加酶量2%(w∶w)和料液比1∶20(w∶v)。
1.2.6 响应曲面分析方法 根据BoxBehnken中心组合实验设计的原理,综合单因素实验结果,选择单因素实验中的显著因素(初始pH、酶解温度和酶解时间)进行优化[16],见表1。

表1 响应曲面分析因素及水平表Table 1 Independent variables and their levels used in the response surface design
1.3 数据统计与分析
每次实验重复3次,取平均值。实验数据以平均值±标准偏差的形式表示,采用DesignExpert 8.0.5软件设计响应曲面实验方案并进行方差分析。
2 结果与分析
2.1 蛋白提取率
采用碱溶酸沉法提取豆粕分离蛋白,提取率为60.56%,与已有研究结果相似。李桂菊[16]发现,蛋白提取率达到最高值66.51%。
2.2 酶解单因素实验
2.2.1 初始pH对酶解产物抑制活性的影响 图1显示,初始pH在8.0~10.0时酶解产物对α葡萄糖苷酶抑制活性较高,初始pH为9.0时达到最高点,为13.5%(p<0.05)。当初始pH小于或大于9.0时,酸碱条件会影响酶的活性和底物的构象[17]。因此反应体系的初始pH应控制在9.0左右。

图1 初始pH对酶解产物活性的影响Fig.1 Effect of initial pH value on enzymatic hydrolysates activity注:不同字母表示差异显著(p<0.05),图2~图5同。
2.2.2 酶解时间对酶解产物抑制活性的影响 图2显示,酶解产物对α葡萄糖苷酶的抑制活性在酶解4 h左右时达到了最高点与5 h时α葡萄糖苷酶抑制率无显著差异(p>0.05),但显著高于其他酶解时间(p<0.05),而在4 h后呈缓慢下降趋势,这可能是由于酶解底物中包含了可溶性蛋白和不溶性蛋白,可溶性蛋白的敏感性肽键会在最初阶段快速断裂,而不敏感肽键断裂缓慢;而不溶性蛋白的酶解过程中,酶吸附在不溶性蛋白的表面,首先水解结合较稀疏的聚合肽,然后再缓慢水解中心的肽键[18]。另外,酶解6 h后具有活性的肽链被过度酶解,结构被破坏,导致酶解产物的抑制活性大大降低。综合考虑,反应体系的的酶解时间应控制在4 h左右。

图2 酶解时间对酶解产物活性的影响Fig.2 Effect of hydrolysis time on enzymatic hydrolysates activity
2.2.3 温度对酶解产物抑制活性的影响 图3显示,温度从40 ℃上升至50 ℃时,酶解产物对α葡萄糖苷酶的抑制活性缓慢增加,在50 ℃时达到最高(p<0.05)。随着温度继续升高,蛋白酶的活性受到抑制,酶解的速度降低,酶解产物对α葡萄糖苷酶的抑制活性也会降低,与薛照辉[19]等的研究结果相似,他发现碱性蛋白酶水解鹰嘴豆分离蛋白在50 ℃时水解度达到最大。因此反应体系的的酶解温度应控制在50 ℃左右。

图3 酶解温度对酶解产物活性的影响Fig.3 Effect of hydrolysis temperature on enzymatic hydrolysates activity
2.2.4 加酶量对酶解产物抑制活性的影响 图4显示,加酶量小于1.5%时,其变化对酶解产物的α葡萄糖苷酶抑制活性影响很小。当加酶量高于1.5%时,由于底物相对较少,酶含量相对较高,所以酶解产物的抑制活性显著增加(p<0.05)。结果表明,只要加酶量大于2.0%后,加酶量将不再影响酶解产物对α葡萄糖苷酶的抑制活性。另外,由于酶本身也是蛋白质,也会发生酶解,加酶量过高则会干扰酶解产物的组成[2021]。因此,从经济和效率考虑,加酶量应保持在2.0%左右。

图4 加酶量对酶解产物活性的影响Fig.4 Effect of enzyme amount on enzymatic hydrolysates activity
2.2.5 初始料液比对酶解产物抑制活性的影响 图5显示,当初始料液比为5∶100时,酶解产物的抑制活性达到最高点,显著高于料液比1∶100和3∶100时的抑制率(p<0.05),而且此后无显著变化(p>0.05)。这可能是因为植物蛋白中含有植物蛋白酶抑制剂,能与蛋白酶作用与底物共享蛋白酶的结合基团,表现出竞争性抑制作用[17]。因此反应体系的初始料液比应控制在5∶100左右。
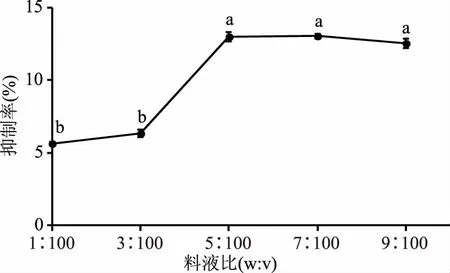
图5 初始料液比对酶解产物活性的影响Fig.5 Effect of initial solidliquid ratio on enzymatic hydrolysates activity
可见,初始pH、酶解时间、酶解温度这三个因素影响显著(p<0.05),加酶量以及料液比影响不显著(p>0.05)。因此,在响应曲面实验中只对初始pH、酶解时间和酶解温度这三个因素进行优化,选择料液比为5∶100、加酶量为2%作为固定实验条件。
2.3 响应曲面法优化酶解工艺
2.3.1 响应曲面分析结果 根据DesignExpert 8.0.5软件设计的三因素三水平的响应曲面实验,进行响应曲面实验,结果见表2。
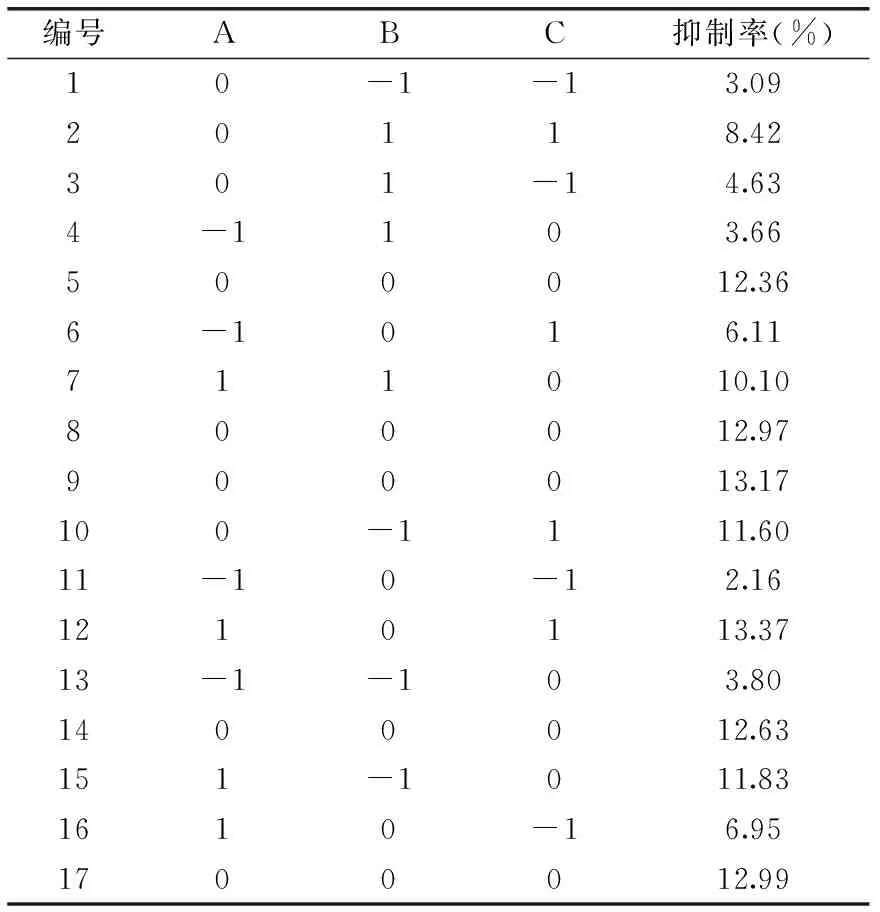
表2 响应曲面实验结果Table 2 Results of response surface methodology
采用DesignExpert 8.0.5软件程序对以上的实验数据进行二次多元回归拟合,分析结果得出碱性蛋白酶(Alcalase)酶解大豆豆粕蛋白制备降糖肽的回归方程为:
Y=335.53975+51.44350A+3.39438B+7.67712C0.039750AB+0.30875AC0.059000BC-2.63200A20.028445B20.76112C2
为了检验上述方程的有效性,对回归模型进行方差分析,结果见表3。
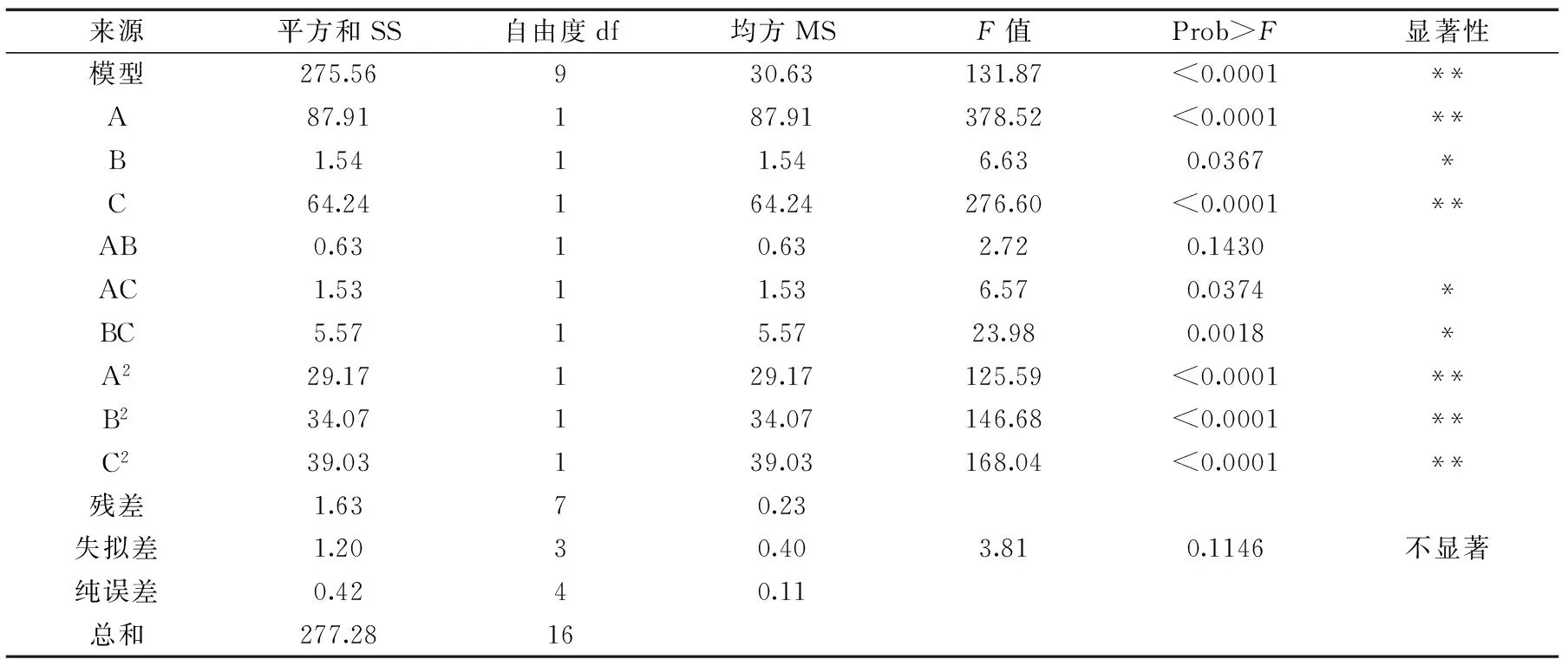
表3 响应曲面回归模型方差分析Table 3 Variance analysis of regression equation
表3表明模型p<0.0001,说明碱性蛋白酶酶解大豆豆粕蛋白制备降糖肽的α葡萄糖苷酶抑制率的回归方程模型极显著,同时失拟差p为0.1146>0.05不明显,进一步说明了该模型的合理性。因此可以用此模型对整个实验结果进行分析和预测。模型的分析参考类似研究[2223],均是从模型p值、失拟差等角度分析模型的统计学意义,判断回归方程预测的准确性。
三个因素对酶解产物抑制活性的影响比较复杂。在上述回归方程的所有一次项中,对于酶解产物抑制活性的影响顺序为A>C>B,其中A、C两项影响极显著(p<0.0001),所以初始pH和酶解时间对酶解产物的抑制活性影响较大;在所有的平方项中,A2、B2、C2三项的影响极显著(p<0.0001);而交互项的影响就相对较小。结合表3中的F值大小,各因素对碱性蛋白酶酶解大豆豆粕蛋白制备降糖肽的α葡萄糖苷酶抑制率的作用顺序依次为:初始pH>酶解时间>酶解温度。
2.3.2 响应曲面分析图示 采用DesignExpert 8.0.5软件,带入实验数据,分别将模型中的初始pH(A)、酶解温度(B)、酶解时间(C)其中一个因素固定在0水平不变,得到其余两个因素之间相互作用对于酶解产物抑制活性的影响。通过软件的Model Graphs分别合成三因素间交互作用的三维图和等高线图,结果见图6~图11。

图6 初始pH与酶解温度交互作用的三维图Fig.6 Response surface plots of initial pH value and hydrolysis temperature on the hydrolysates activity

图7 初始pH与酶解温度交互作用的等高线图Fig.7 Contour map of initial pH value and hydrolysis temperature on the hydrolysates activity

图8 酶解温度与酶解时间相互作用的三维图Fig.8 Response surface plots of hydrolysis temperature and time on the hydrolysates activity
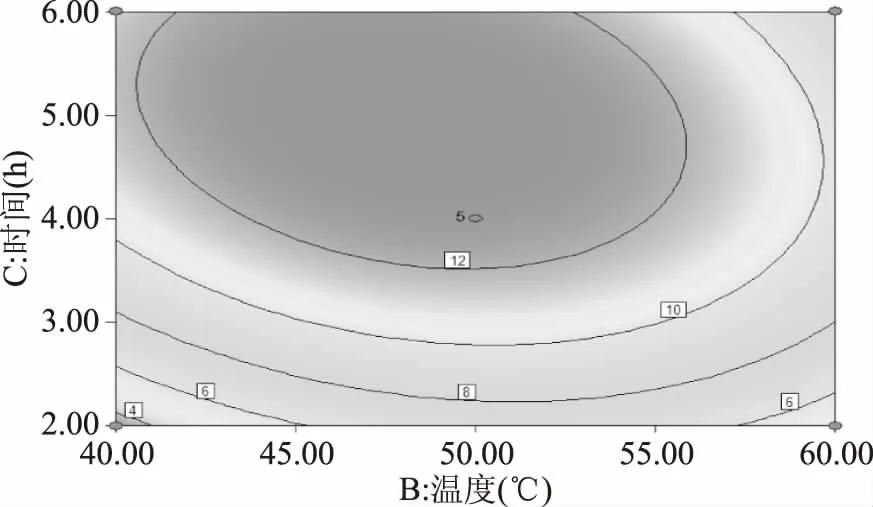
图9 酶解温度与酶解时间交互作用的等高线图Fig.9 Contour map of hydrolysis temperature and time on the hydrolysates activity
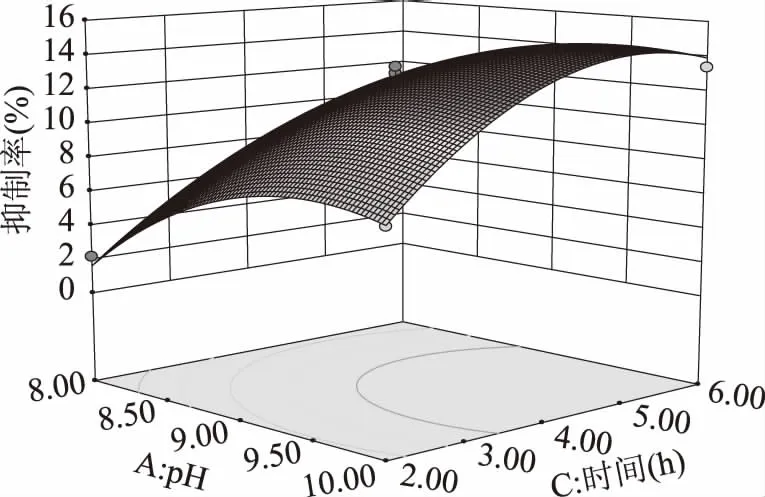
图10 初始pH与酶解时间交互作用的三维图Fig.10 Response surface plots of initial pH value and hydrolysis time on the hydrolysates activity

图11 初始pH与酶解时间交互作用的等高线图Fig.11 Contour map of initial pH value and hydrolysis time on the hydrolysates activity
观察图6~图11,可见设计的三个因素中对酶解液降血糖活性影响最大的是初始pH,其次是酶解时间,而酶解温度对活性影响最小。
2.3.3 最佳酶解工艺条件的确定 使用Design-Expert 8.0.5软件对上述回归方程进行分析,确定最佳酶解工艺条件为:初始pH9.55、酶解温度48.54 ℃,酶解时间5.29 h。在此工艺条件下,酶解产物的抑制活性预测值为14.80%。
考虑到实验条件的可行性等问题,修正酶解工艺条件为:初始pH9.5,酶解温度49 ℃,酶解时间5.5,在此条件下,3次平行实验进行验证,得到豆粕降血糖粗肽对α葡萄糖苷酶的抑制活性为14.82%±0.23%,高于预测值0.02%。同时,由于水解度与酶解产物活性有一定关系[24],测量发现该酶解工艺条件下蛋白水解度为23.26%。证明了响应曲面分析法对于酶解工艺的优化结果准确可靠。
3 结论
在单因素实验基础上,采用响应曲面优化了碱性蛋白酶水解大豆豆粕蛋白制备葡萄糖苷酶抑制剂降糖肽的工艺,获得的最优工艺参数为:初始pH9.5,酶解温度49 ℃,酶解时间5.5 h,料液比5∶100,加酶量2%。采用该工艺条件进行制备时,蛋白水解度为23.26%,降血糖肽对α葡萄糖苷酶的抑制率为14.82%±0.23%%。研究表明,在此工艺条件下制备的豆粕蛋白葡萄糖苷酶抑制剂降糖肽具有很好的降血糖活性,同时豆粕蛋白作为天然成分,没有人工合成药物的副作用。此外,研究还可以进一步深入,包括对酶解产物进行分离纯化、结构鉴定,获得纯品;另外也可以开发功能性饮料等产品。
[1]晏黎,田静. 降糖药物的研究进展[J]. 中国医药导报,2008,5(2):2224.
[2]盛清凯,姚惠源. 苦瓜多肽P的分离及其降糖活性[J]. 无锡轻工大学学报,2005,24(1):4951.
[3]顾欣,李莉,侯雅坤,等. 响应面法优化山杏仁蛋白提取工艺研究[J]. 河北林果研究,2010,25(2):162168.
[4]PalSingh B,Vij S,Hati S. Functional significance of bioactive peptides derived from soybean[J]. Peptides,2014,54:171179.
[5]葛焕琦,蔡寒青,王涛,等. 人参糖肽注射液治疗2型糖尿病30例[J]. 吉林大学学报:医学版,2003,29(2):206207.
[6]刘桂琴,朱翠凤,李艳飞,等. 海洋胶原肽对2型糖尿病大鼠过氧化应激标志物表达的影响[J]. 中国组织工程研究与临床康复,2008,12(23):44694472.
[7]印虹,马畅,韩东宁,等. 乳源β酪啡肽7对高血糖大鼠小肠黏膜氧化应激的影响[J]. 食品科学,2011,32(3):208211.
[8]冯潍,李娜娜,许继敏,等. 天然活性多糖的降血糖机制研究[J]. 科技信息,2012,12(34):152153.
[9]Yu Z P,Yin Y G,Zhao W Z,et al. Antidiabetic activity peptides from albumin against aglucosidase and aamylase[J]. Food chemistry,2012,88(6):7880.
[10]Li Y W,Li B. Characterization of structureantioxidant activity relationship of peptides in free radical systems using QSAR models:Key sequence positions and their amino acid properties[J]. Journal of Theoretical Biology,2013,318:2943.
[11]Jing P,Qian B,He Y,et al. Screening milkderived antihypertensive peptides using quantitative structure activity relationship(QSAR)modelling andinvitro/invivostudies on their bioactivity[J]. International Dairy Journal,2014,35(1):95101.
[12]Wang H K,Zhang S T,Sun Y,et al. ACEinhibitory peptide isolated from fermented soybean meal as functional food[J]. International Journal of Food Engineering,2013,9(1):18.
[13]Deng S,Huo J,Xie C. Preparation by enzymolysis and bioactivity of iron complex of fish protein hydrolysate(FeFPH)from low value fish[J]. Chinese Journal of Oceanology and Limnology,2008,26:300306.
[14]Xie N N,Wang C,Ao J,et al. Nongastrointestinal-hydrolysis enhances bioavailability and antioxidant efficacy of casein as compared with itsinvitrogastrointestinal digest[J]. Food Research International,2013,51(1):114122.
[15]周琳娜. 杜仲叶的发酵及其α葡萄糖苷酶抑制活性[D].北京:北京林业大学,2012.
[16]李桂菊,王晓强,何启刚,等. 碱溶时间对大豆蛋白提取率和得率的影响[J].安徽农业科学. 2011,51(4):6667.
[17]刘萍,陈黎斌,杨严俊,等. 酶解玉米蛋白制备降血压肽的研究[J]. 食品工业科技,2006,27(5):117122.
[18]侯雅坤,王晟,黄昆,等. 核桃蛋白酶解工艺优化与酶解液抗氧化活性分析[J]. 食品与发酵工业,2012,38(4):99103.
[19]薛照辉,石颖娜,李勇,等. 碱性蛋白酶水解鹰嘴豆分离蛋白的工艺优化[J]. 中国粮油学报,2008,23(5):7678.
[20]Clemente A,Vioque J,SánchezVioque R,et al. Protein quality of chickpea(CicerarietinumL.)protein hydrolysates[J]. Food Chemistry,1999,67:269274.
[21]薛照辉,吴谋成,尹经章. 复合酶水解菜籽清蛋白的研究[J]. 中国粮油学报,2004,19(3):5761.
[22]饶丹华,白婵,耿胜荣,等. 响应面法优化鲟鱼精蛋白的提取工艺[J]. 食品工业科技,2017,38(4):272277.
[23]陈树俊,李乐,石玥,等. 响应面法优化酶解制备核桃多肽工艺[J].食品工业科技,2017,38(16):142149,158.
[24]焦宝利,田少君,毛小平,等. 大豆蛋白酶解产物抗氧化活性与水解度相关性研究[J]. 粮食与油脂,2015,28(2):2832.

