超声波辅助提取石榴根皮总黄酮及其抑制亚硝化反应活性
王占一,毕海丹,王玉海,郑丹丹,戴 博,李卓瓦
(1.枣庄学院生命科学学院,山东枣庄 277160;2.空军总医院药学部,北京 100142)
石榴(PunicagranatumL.)为石榴科石榴属木本植物,资源分布极其广泛,我国南北各省均有栽培[1]。石榴的药用和食用部位主要为其果实部分,而自然淘汰的老根或作为石榴盆景淘汰的老桩经常作为废物被丢弃,造成资源浪费。梁代陶弘景在《本草经集注》中记载,石榴根皮具有杀虫、涩肠、止带等功效,是古代一种常用的中药材。近年来,大量研究证明黄酮类成分广泛存在于木本植物的根皮中,目前,研究较多的为菠萝蜜[2]、白簕[3]、梓树[4]等,而石榴根皮中是否含有黄酮类成分,国内外鲜有文献报道。罗丽等[56]研究发现,采用超声波辅助提取植物药材中的活性成分,具有条件温和、环境友好、可操作性强等诸多优点,使提取过程能够在相对较短时间内完成,有效避免了活性成分被氧化而丧失其功效,并提高了提取效率。但是,采用超声波辅助提取石榴根皮中黄酮类成分的研究,国内还未见文献报道。
癌症是当前威胁人类生活的最大杀手,根据世界卫生组织统计,全世界每年约有500万人被癌症夺取生命。在众多致癌物中,亚硝胺是最令人关注的一类化学致癌物,因此,抑制亚硝化反应的研究直接关系人体健康[7]。从防癌抗癌角度考虑,可以采取清除亚硝胺的合成前体亚硝酸盐、阻断亚硝胺的合成反应来达到防癌目的[89]。天然植物中的黄酮类物质对亚硝化反应具有较强的抑制作用,国内学者在这方面研究较多,例如,叶敏等[10]测定了响铃草总黄酮体外清除亚硝酸盐能力和阻断亚硝胺合成能力;王晓波等[11]测定了鸡骨草总黄酮体外抑制亚硝化反应活性,均取得了较好的阳性结果。因此,本研究以石榴根皮为材料,采用超声波辅助提取材料中总黄酮,并测定纯化后的产物对亚硝酸盐的清除能力和对亚硝胺合成的阻断能力,为石榴根皮总黄酮的工业化生产,促进石榴资源的充分开发利用提供参考。
1 材料与方法
1.1 材料与仪器
石榴根皮 采自山东峄城“万亩石榴园”核心产区,经枣庄学院闫志佩教授鉴定为正品石榴根皮,在恒温鼓风干燥箱中60 ℃干燥后,粉碎并过40目筛,备用;芦丁对照品 纯度>98%,批号:100080-201202,中国食品药品检定研究院提供;无水乙醇、碳酸钠、硝酸铝、氢氧化钠、盐酸、亚硝酸盐、柠檬酸、磷酸氢二钠、对氨基苯磺酸、盐酸苯乙二胺、a萘胺、二甲胺 均为分析纯,天津市东丽区天大化学试剂厂;蒸馏水 枣庄学院生物学省级教学示范中心提供。
HNCQY型低温超声波萃取仪 上海汗诺仪器有限公司;MP502B型电子分析天平 上海精密科学仪器有限公司;756型紫外可见分光光度计 上海光学仪器一厂;FW135型多功能粉碎机 天津泰斯特仪器有限公司;RE2000A型旋转蒸发器 上海亚荣生化仪器厂;RV5型真空泵 英国Edwards公司;HHS2型电热恒温水浴锅 金坛市大地自动化仪器厂;DGH9240型电热恒温鼓风干燥箱 上海一恒科技有限公司。
1.2 实验方法
1.2.1 芦丁标准曲线的制定 参照文献[12]的方法,略有改动。精密称取芦丁对照品12.5 mg置于小烧杯中,用75%乙醇溶解并转移定容至25 mL容量瓶中,即得500 μg/mL的芦丁对照品溶液。分别移取0、0.2、0.4、0.6、0.8、1.0、1.2 mL于10 mL具塞比色管中,加入5% NaNO2溶液0.3 mL,摇匀,静置6 min,加入10% Al(NO3)3溶液0.3 mL,摇匀,静置6 min,加入4% NaOH溶液5 mL,混匀,用75%乙醇定容至10 mL后静置20 min,在510 nm 波长处测定吸光度(A值),并以A值为纵坐标,芦丁系列浓度为横坐标,得回归方程A=0.6254C+0.0116(r=0. 9995),质量浓度在0~60 μg/mL范围内与A值之间线性关系良好。
1.2.2 石榴根皮中总黄酮的制备与含量测定 精确称取干燥后石榴根皮粉末5 g,按照规定的料液比加入设定体积分数的乙醇溶液,置于低温超声波萃取仪中,设定超声功率,提取至设定的反应时间。反应结束后,3000 r/min离心30 min,分离所得上清液,回收乙醇溶剂,干膏至于小烧杯中,用75%乙醇溶解并定容至100 mL,作为样品溶液。取样品溶液适量用D101大孔吸附树脂静态吸附,抽滤,用75%乙醇洗脱后,抽滤,滤液减压蒸干后得到石榴根皮总黄酮固形物,称重,备用。
准确称取精制后的石榴根皮总黄酮固形物2.0 mg,至于小烧杯中,用75%乙醇定容至100 mL,作为样品溶液,按照“1.2.1”项下实验方法测定A值,计算样品中总黄酮得率及纯度,并用于抑制亚硝化反应活性研究。

式(1)

式(2)
1.2.3 石榴根皮总黄酮提取工艺实验
1.2.3.1 单因素实验 单因素实验中,固定条件为:料液比1∶20 g/mL、超声功率250 W、超声时间35 min,考察乙醇体积分数(40%、50%、60%、70%、80%)对石榴根皮总黄酮得率的影响;固定条件为:乙醇体积分数60%、超声功率250 W、超声时间35 min,考察料液比(1∶10、1∶15、1∶20、1∶25、1∶30 g/mL)对石榴根皮总黄酮得率的影响;固定条件为:乙醇体积分数60%、料液比1∶20 g/mL、超声时间35 min,考察超声功率(150、200、250、300、350 W)对石榴根皮总黄酮得率的影响;固定条件为:乙醇体积分数60%、料液比1∶20 g/mL、超声功率250 W,考察超声时间(25、30、35、40、45 min)对石榴根皮总黄酮得率的影响。
1.2.3.2 BoxBehnken实验设计 在单因素实验基础上,采用BoxBehnken实验设计原理,以石榴根皮总黄酮得率(Y)为响应值,选取单因素实验中的4个因素,建立四因素三水平的响应面优化实验。每组实验平行3次,取平均值。因素水平表见表1。

表1 响应面实验因素水平表Table 1 Level and factors of response surface experimental design
1.2.4 石榴根皮总黄酮抑制亚硝化反应
1.2.4.1 石榴根皮总黄酮对亚硝酸盐清除率的测定 参照文献[10]的方法,略有改动。分别吸取1.2.2项下样品溶液0.2、0.4、0.6、0.8、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0 mL于12支25 mL具塞比色管中,依次加入50 μg/mL的NaNO2溶液1.0 mL,pH3.0的柠檬酸磷酸氢二钠缓冲液(15.254 g柠檬酸、5.836 g磷酸氢二钠定容至1000 mL)10.0 mL,于37 ℃水浴锅中保温1 h,取出后加入质量分数0.4%的对氨基苯磺酸2.0 mL,摇匀后静置5 min,再加入质量分数0.2%的盐酸萘乙二胺1.0 mL,用蒸馏水稀释至刻度,摇匀后静置15 min。以VC作对照,用分光光度计在确定最大吸收波长λmax=540 nm处测定吸光度,并按照下式计算亚硝酸盐清除率:

式(3)
式中:A0为未加样品溶液时NaNO2溶液的吸光度(以试剂作空白对照);A为加入样品溶液时NaNO2溶液的吸光度。
1.2.4.2 石榴根皮总黄酮对亚硝胺合成阻断率的测定 参照文献[13]的方法,略有改动。分别吸取1.2.2项下样品溶液0.2、0.4、0.6、0.8、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0 mL于12支25 mL比色管中,依次加入pH3.0的柠檬酸磷酸氢二钠缓冲液10.0 mL,69.5 μg/mL的NaNO2溶液1.0 mL,45.08 μg/mL的二甲胺溶液1.0 mL,用蒸馏水稀释至刻度,于37 ℃水浴锅中保温1 h。准确吸取1.0 mL加入到7 cm2的培养皿中,再加入质量分数0.5%的Na2CO3溶液0.5 mL,于紫外分析仪(λ=254 nm)上辐照15 min。取出后依次加入质量分数1%的对氨基苯磺酸1.5 mL,质量分数0.1%的α萘胺1.5 mL,蒸馏水0.5 mL,摇匀后静置15 min。以VC作对照,用分光光度计在确定最大吸收波长λmax=525 nm处测定吸光度,并按照下式计算对亚硝胺合成的阻断率:

式(4)
式中:A0为未加样品溶液时NaNO2溶液的吸光度(以试剂作空白对照);A为加入样品溶液时NaNO2溶液的吸光度。
1.3 数据分析
BBD实验设计采用DesignExpert 8.0.5统计分析软件,数据分析处理采用SPSS 20.0和Microsoft excel 2010软件。实验结果均以平均值±标准偏差表示(n=3)。
2 结果与分析
2.1 石榴根皮总黄酮的提取工艺参数优化
2.1.1 单因素实验结果与分析
2.1.1.1 乙醇体积分数对总黄酮得率的影响 如图1所示,乙醇体积分数在40%~60%范围内,随着乙醇体积分数的增大,总黄酮得率有明显提高,当乙醇体积分数为60%时,总黄酮得率达到最大值。此后随着乙醇体积分数的增加,总黄酮得率呈现明显的下降趋势。根据“相似者相溶”原理,体积分数为60%的乙醇溶液和材料中总黄酮极性相似,因此,总黄酮得率较高,而提取溶液高于或低于这个极性,总黄酮得率相应降低,因此,确定乙醇体积分数60%左右。
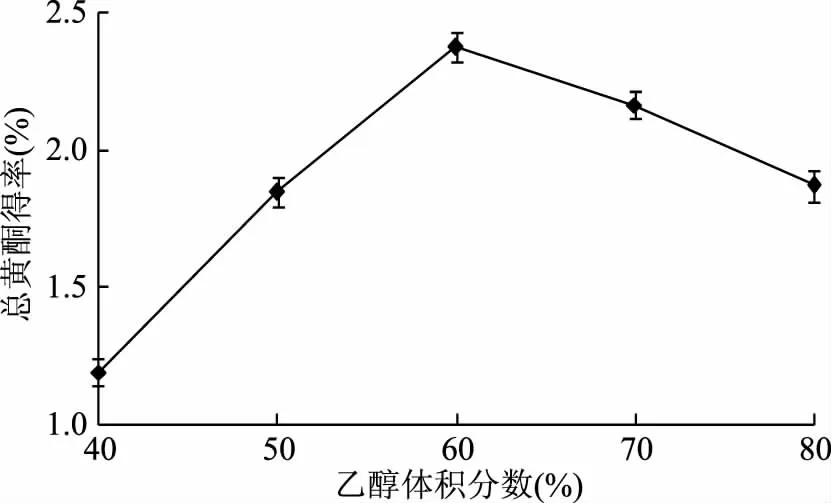
图1 乙醇体积分数对总黄酮得率的影响Fig.1 Effects of ethanol concentration on the extraction yield of total flavonoids
2.1.1.2 料液比对总黄酮得率的影响 如图2所示,料液比在1∶10~1∶20 g/mL范围内,随着溶剂用量的增大,总黄酮得率有明显的提高,当料液比为1∶20 g/mL时,总黄酮得率达到2.35%。此后继续增大料液比对总黄酮得率的影响不大,甚至出现下降趋势。原因是原料质量一定,增大溶剂用量,会提高总黄酮得率,但是,当料液比例达到一定值后,材料中的总黄酮基本提取完全,故再增加料液比例,总黄酮得率不再提高,基于经济方面考虑,确定料液比1∶20 g/mL左右为宜。
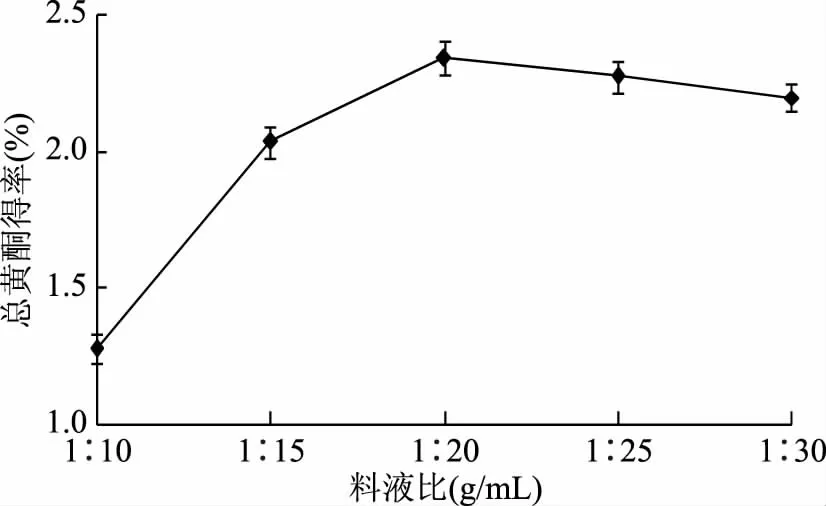
图2 料液比对总黄酮得率的影响Fig.2 Effects of solid/liquid ratio on the extraction yield of total flavonoids
2.1.1.3 超声功率对总黄酮得率的影响 如图2所示,超声功率在150~250 W范围内,随着超声功率的增大,总黄酮得率有明显的提高,当超声功率为250 W时,总黄酮得率达到2.33%。当超声功率超过250 W后,总黄酮得率随超声功率增加变化趋势并不明显。原因是超声功率较低时,空化泡的最大半径与起始半径的比值增大,空化强度增大,即声强愈高,空化效应愈强烈,有利于总黄酮成分的浸出;但是,当超过一定值时,声强过高,会产生大量无用的气泡,从而束缚了浸出效率的提高[6],从节约能源角度考虑,确定超声功率为250 W左右。
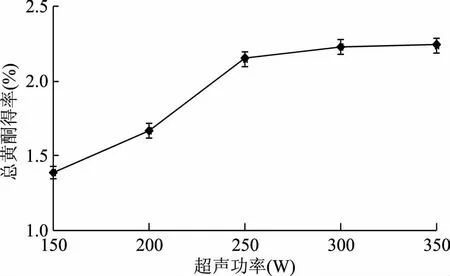
图3 超声功率对总黄酮得率的影响Fig.3 Effects of ultrasonic power on the extraction yield of total flavonoids
2.1.1.4 超声时间对总黄酮得率的影响 如图4所示,超声时间在25~35 min范围内,随着超声时间的增大,总黄酮得率有明显的提高,当超声时间35 min时,总黄酮得率达到2.34%。当超声时间超过35 min后,总黄酮得率随超声时间增加变化趋势并不明显。原因是黄酮类成分从固相向液相传递是一个复杂过程,故而延长提取时间,总黄酮得率升高。但是,提取时间太长,原料与提取溶剂之间的浓度差变小;同时,部分产物被分解而影响了提取效果,从而使得总黄酮得率升高趋势缓慢。因此,确定超声时间为35 min左右。

图4 超声时间对总黄酮得率的影响Fig.4 Effects of ultrasonic time on the extraction yield of total flavonoids
2.1.2 BoxBehnken实验设计回归模型的建立及方差分析 根据DesignExpert 8.0.5软件中所提供的实验方案安排实验。响应面实验方案与实验结果见表2。(n=3)对表2中数据进行回归拟合,得到各因素与响应值之间的二次回归方程为:

表2 响应面实验方案与实验结果Table 2 Arrangement and corresponding results of BoxBehnken experimental design
Y=2.74+0.14X1+0.23X2+0.069X30.17X4-0.02X1X2+0.25X1X30.15X1X4+0.17X2X3-0.12X2X4+0.29X3X40.48X120.42X220.15X320.25X42
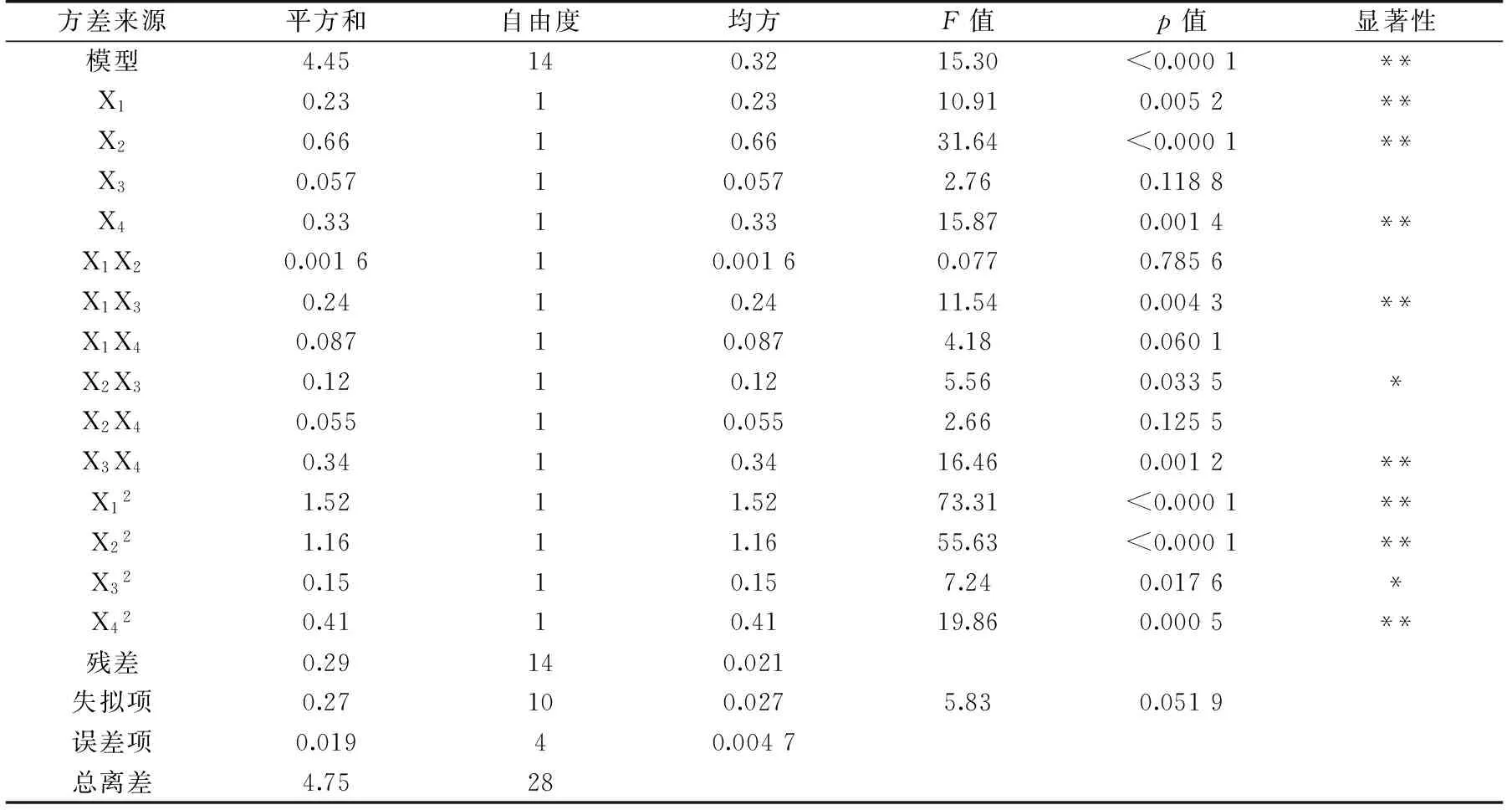
表3 回归方程方差分析结果Table 3 Analysis of variance of regression equation
2.1.3 两因素交互效应分析 图5为两因素交互作用显著的响应面与等高线图,响应面的变化情况和等高线的稀疏程度可以直观反映各因素之间的交互作用对石榴根皮总黄酮的影响。等高线呈圆形时表示两因素交互作用不显著,而呈椭圆形或马鞍形时则表示两因素交互作用显著[1617]。由图5a可知,乙醇体积分数的变化曲面比超声功率的变化曲面陡峭,说明乙醇体积分数比超声功率对总黄酮得率的影响更显著一些,与方差分析结果相符。同理,由图5b和5c可知,两两因素交互作用时,料液比和超声时间均比超声功率对总黄酮得率的影响显著,均与方差分析结果相符。图5所示的等高线均呈明显的椭圆形,说明乙醇体积分数和超声功率、料液比和超声功率及超声功率与超声时间之间交互作用均显著,对总黄酮得率的影响较大。
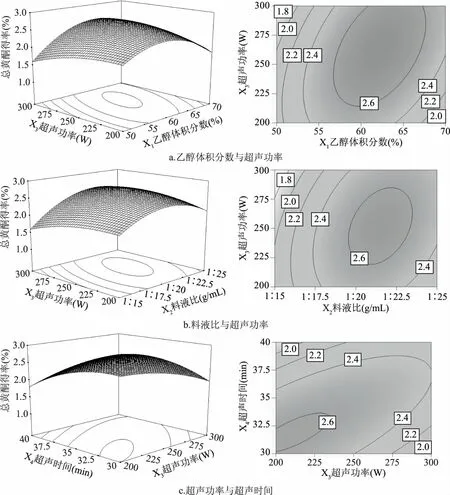
图5 各因素交互作用的响应面与等高线图Fig.5 Response surface and contour plots
2.1.4 最佳工艺条件的确定及验证 通过响应面分析得到超声波辅助提取石榴根皮总黄酮的最佳工艺条件:乙醇体积分数62.8%,料液比1∶21.95 g/mL,超声功率271.5 W,超声时间33.75 min,在此条件下预测总黄酮得率为2.84%。实际操作中稍作调整确定的最佳工艺条件为乙醇体积分数63%,料液比1∶22 (g/mL)超声功率270 W,超声时间34 min。进行3次平行验证实验,测得总黄酮平均得率为2.81%,与理论值非常接近,误差仅为1.06%。
2.2 石榴根皮总黄酮抑制亚硝化反应实验结果
应用式(2)计算得出纯化后的石榴根皮总黄酮固形物纯度约为75%,进而得出1.2.2项下,用于抑制亚硝化反应实验的样品溶液中总黄酮真实浓度为15 μg/mL。样品溶液总黄酮对亚硝酸盐清除率的测定结果见图6,对亚硝胺合成阻断率的测定结果见图7。
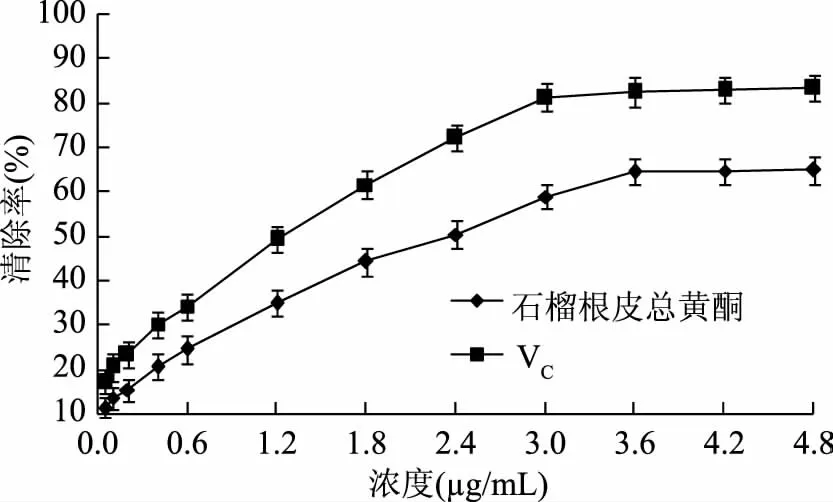
图6 石榴根皮总黄酮及VC对亚硝酸盐的清除率Fig.6 The sodium nitrite scavenging rates of total flavonoids from pomegranate root bark and VC
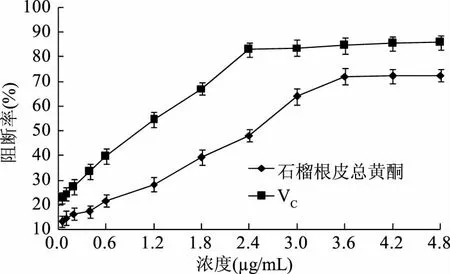
图7 石榴根皮总黄酮及VC对亚硝胺合成的阻断率Fig.7 The nitrosamine synthesis inhibiting rates of total flavonoids from pomegranate root bark and VC
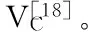
由图7可知,在0.12~3.6 μg/mL范围内,随着浓度的增加,石榴根皮总黄酮对亚硝酸胺合成的阻断率明显增加,当浓度为3.6 μg/mL时,阻断率达到71.9%。石榴根皮总黄酮浓度与对亚硝酸胺合成的阻断率之间存在着正相关关系,拟合方程为y=16.48x+11.35,决定系数R2=0.990。通过拟合方程算出石榴根皮总黄酮对亚硝酸胺合成的阻断作用的IC50=2.345 μg/mL。同理,VC对亚硝酸盐清除作用的IC50=1.087 μg/mL,石榴根皮总黄酮对亚硝酸胺合成的阻断作用低于VC。已有学者研究表明,木蝴蝶总黄酮等酚类成分具有较强清除亚硝酸盐和抑制亚硝胺合成能力,且清除(抑制)作用与植物酚类化合物的含量密切相关[1921],这与本研究的结果一致。黄酮类化合物是一类多羟基酚类化合物,酚羟基极易发生氧化、缩合、聚合等变化,所以具有较强的抗氧化能力[22]。亚硝酸盐是一种氧化剂,黄酮类成分能与亚硝酸根通过氧化还原反应而清除亚硝酸盐,并抑制亚硝胺的合成数量[23]。
3 结论
本文以石榴根皮为研究对象,在单因素实验基础上,采用BoxBehnken Design(BBD)实验设计,以总黄酮得率为考察指标,优选出超声波提取石榴根皮总黄酮的最佳工艺条件为乙醇体积分数63%,料液比1∶22 g/mL,超声功率270 W和超声时间34 min,在此条件下石榴根皮总黄酮得率为2.81%,与模型预测值接近。石榴根皮总黄酮具有较强的清除亚硝酸盐能力和抑制亚硝胺合成能力,质量浓度为3.6 μg/mL时,对亚硝酸盐的最大清除率为64.5%,清除作用的IC50=2.408 μg/mL,对亚硝胺合成的最大阻断率为71.9%,阻断作用的IC50=2.345 μg/mL,在质量浓度0.12~3.6 μg/mL范围内,石榴根皮总黄酮与对亚硝酸盐清除效果和抑制亚硝酸胺合成效果之间均呈一定的正相关关系。
[1]汪小飞,周耘峰,黄埔,等. 石榴品种数量分类研究[J]. 中国农业科学,2010,52(5):10931098.
[2]李海滨,胡晓旭,普开,等. 响应面法优化野菠萝蜜根皮总黄酮的微波提取工艺[J]. 食品工业科技,2014,35(6):226229.
[3]蔡凌云,黎元祥,陈蕉,等. 白簕根皮总黄酮提取工艺研究[J]. 食品科学,2009,30(4):1518.
[4]邵金华,何福林,陈霞,等. 梓树根皮总黄酮分离纯化及其抑菌活性研究[J]. 食品与机械,2017,33(2):140144.
[5]罗丽,梁琪,张炎,等. 响应面法优化超声波辅助提取沙枣果总黄酮工艺[J]. 食品工业科技,2013,34(5):269274.
[6]Pan G Y,Yu G Y,Zhu C H,et al. Optimization of ultrasoundassisted extraction(UAE)of flavonoids compounds(FC)from hawthorn seed(HS)[J]. Ultrasonics Sonochemistry,2012,19(3):486490.
[7]Lei Y,Chen Z L,Shen J M,et al. Reinvestigation of the nitrosamine formation mechanism during ozonation[J]. Environmental Science & Technology,2009,43(14):54815487.
[8]黄高凌,翁聪泽,倪辉,等. 琯溪蜜柚果皮提取物抑制亚硝化反应的研究[J]. 食品科学,2007,28(12):3639.
[9]Sun Y C,Mi J C,Lee J H,et al. Nnitrosamine inhibition by strawberry,garlic,kale,and the effects of nitritescavenging and Nnitrosamine formation by functional compounds in strawberry and garlic[J]. Food Control,2007,18(5):485491.
[10]叶敏,邵艳萍. 响铃草总黄酮清除自由基及抑制亚硝化作用的研究[J]. 天然产物研究与开发,2013,25(5):667671.
[11]王晓波,黄叠玲,刘冬英,等. 鸡骨草总黄酮清除自由基及抑制亚硝化作用研究[J]. 时珍国医国药,2012,23(4):942944.
[12]岳秀杰,李超,扶雄. 超声提取辣木叶黄酮优化及其抗氧化活性[J]. 食品工业科技,2016,37(1):226231.
[13]冯纪南,黄海英,余瑞金,等. 柑橘皮黄酮提取工艺及抑制亚硝化反应[J]. 光谱实验室,2013,30(5):23722378.
[14]郭庆启,黄丽洋,王振宇,等. BoxBehnken响应面设计优化微波辅助提取大豆胚芽黄酮的工艺[J]. 食品工业科技,2011,32(2):214216.
[15]陈贵堂,赵立艳,刘瑞,等. 响应面优化酶法辅助提取金针菇根部多糖的工艺研究[J]. 食品工业科技,2013,34(24):209213.
[16]豆亚静,张晓龙,常立新,等. 响应面优化超声波法提取黑豆异黄酮的工艺研究[J]. 食品工业科技,2013,34(5):259263.
[17]常立新,贾长虹,郁春乐. 响应面优化玉米芯黄酮的提取工艺研究[J]. 食品工业科技,2014,35(2):259263.
[18]樊倩,韦庆益,袁尔东,等. 植物中络氨酸酶的筛选及不同抑制剂对其活性的影响[J]. 食品工业科技,2012,33(10):9193.
[19]刘可心,兰永强,杨娜,等. 木蝴蝶总黄酮的提取及体外清除亚硝酸盐及阻断亚硝胺合成的研究[J]. 食品工业科技,2016,30(6):669674.
[20]Lu M J,Chen C. Enzymatic tannase treatment of green tea increasesinvitro,inhibitory activity against Nnitrosation of dimethylamine[J]. Process Biochemistry,2007,42(9):12851290.
[21]郭琦,高春燕. 地参酚类化合物对亚硝酸盐的清除作用[J]. 食品工业科技,2017,38(19):5761.
[22]刘智峰. 酶法超声波辅助提取香椿叶中总黄酮及抗氧化性研究[J]. 食品工业科技,2015,36(20):314319.
[23]Liu J,Lin S,Wang Z,et al. Supercritical fluid extraction of flavonoids from Maydis stigma and its nitritescavenging ability[J].Food & Bioproducts Processing,2011,89(4):333339.

