猪血红蛋白超声提取工艺响应面优化及超声对其结构的影响
马素敏,何立超,李成梁,孙 媛,靳国锋,*,马美湖
(1.华中农业大学食品科技学院,湖北武汉 430070;2.武汉设计工程学院食品与生物科技学院,湖北武汉 430205)
动物血液是畜禽屠宰加工的主要副产物,动物血液营养全面,其含有丰富的必需氨基酸以及具有高生物利用率的血红素铁,同时血液中的蛋白质与乳、豆类中蛋白质相比,一般不会引起过敏反应[1]。动物血液主要由红细胞(占全血体积的20%~40%)和悬浮状液体血浆(60%~80%)组成。全血中蛋白质含量为17%~18%,水分含量为75%~82%,红细胞中血红蛋白含量约占总血液总蛋白质含量的70%[2]。
到目前为止,人们对血红蛋白的开发利用主要是将其制成增色剂[35]、铁增强剂、脂肪替代品、动物饲料及宠物食物[6],运用于食品加工和营养强化、饲料工业等领域。近些年也有研究将血红蛋白进行水解制备成具有补铁、抗菌、抗氧化、血管紧张素转移酶抑制等功能活性的配料[6]。同时,血红蛋白也是合成具有抗肿瘤、抗炎作用的血卟啉等卟啉类化合物的重要原料——氯化血红素的前体物质[7]。此外,也有研究报道血红蛋白可作为合成高分子絮凝剂替代品,用于污水处理等分离纯化产业[8]。因此,动物血红蛋白的开发利用具有非常广阔的应用前景。
血红蛋白产品的开发,其提取工艺是关键,在获得较高血红蛋白提取率的基础上,掌握工艺处理对血红蛋白结构产生的影响(如卟啉环结构是否完整,血红素是否从蛋白疏水空穴游离),这样才能方便其进一步开发利用。血红蛋白的提取工艺主要分为物理法、化学法、机械法,物理方法又分为反复冻融法和超声波法,化学方法主要有添加表面活性剂法以及自溶法,机械法可以分为胶体磨法、高压均质法以及匀浆机法等[910]。其中超声波法具有破碎效率高,时间短,无有机试剂残留、防止剪切黏度升高等优点[11],是近年来研究应用比较多的一种方法。但是,超声处理也有其潜在的缺点:提高了处理液温度,并且其强烈的剪切力可能破坏蛋白质结构,导致酶活性丧失,功能特性的改变,蛋白聚集等[12]。有研究报道[13],超声波处理不会引起一些具有高水平β结构和低水平α结构的蛋白质(如超氧化物歧化酶、富组亲动蛋白等)的二级结构发生显著变化,但是会引起一些具有高α螺旋含量蛋白质(如肌红蛋白、牛血清白蛋白)的二级结构发生变化。
目前关于超声破碎猪红细胞提取血红蛋白的研究多集中在其工艺的优化上,超声条件对于提取得到的血红蛋白结构以及其中血红素卟啉环结构的影响研究几乎没有。本研究利用响应面方法优化超声提取血红蛋白工艺,并在此基础上应用光谱学等手段研究了超声波提取工艺对血红蛋白及其卟啉环结构的影响,为后续研究血红素等卟啉类化合物的结构性质以及开发相关卟啉类产品奠定基础。
1 材料与方法
1.1 材料与仪器
猪血 华中农业大学农贸生鲜超市;标准血红蛋白 日本东京化成工业株式会社;柠檬酸三钠、氢氧化钠、氯化钠、氯化钾、磷酸二氢钾、磷酸氢二钠 均为分析纯;Triton X100 国药集团化学试剂有限公司。
VCX750型超声细胞粉碎仪 美国SONICS公司;Nanodrop 2000C型紫外可见分光光度计 美国热电公司;Nexus 470傅里叶变换红外光谱仪 美国梅特勤公司;JASCOJ810型圆二色谱仪 日本JASCOJ公司;InVia型共焦显微拉曼光谱仪 英国RENISHAW公司;Sigma330N型冷冻离心机 德国Sigma公司;ALPHA14型真空冷冻干燥机 德国Christ公司
1.2 实验方法
1.2.1 ACD抗凝剂的制备 称取柠檬酸0.48 g,柠檬酸钠1.32 g,葡萄糖1.47 g,溶于100 mL蒸馏水中,高压灭菌后备用。20 mL新鲜血液加入3.5 mL ACD抗凝剂。
1.2.2 血红蛋白的超声提取工艺 取一定体积新鲜抗凝猪血,1700×g离心10 min后血液分层,收集下层红细胞,用pH7.4 PBS缓冲液洗涤三次。量取20 mL红细胞加入不同体积的蒸馏水,在不同超声时间、超声振幅、脉冲激发与间歇时间比下破碎红细胞,破碎过程中采用碎冰降温。破碎液在10000×g下离心30 min,弃下层细胞碎片收集上清液为血红蛋白提取液,记录体积。
1.2.3 血红蛋白含量测定及计算 采用碱性羟基高铁血红素法测定血红蛋白含量,在Vinaya等[14]的基础上稍作变化,按照1∶151比例取血红蛋白提取液200 μL与30 mL碱性试剂Triton X100进行混合。血红蛋白测定的标准曲线为:y=0.00185x-0.01111,相关系数R2=0.9996。这说明在样品浓度范围16~160 mg/mL内,该方程拟合程度高可用于血红蛋白浓度的测定计算。按照下面公式[15]计算血红蛋白提取率。
式中,Y为血红蛋白提取率(%),C1为由标准曲线所求得破碎液中血红蛋白浓度(mg/mL);V1为20 g红细胞加水超声破碎后的破碎液体积(mL);C2为购买猪血的血红蛋白浓度(mg/mL);V2为20 g红细胞所来源的猪血体积(mL)。
1.2.4 单因素实验 采用1.2.2工艺进行超声破碎红细胞提取血红蛋白,固定超声时间为15 min,间歇与脉冲激发时间比为1∶1,水与红细胞体积比为3∶1时,研究不同超声振幅(20%、25%、30%、35%、40%)对血红蛋白提取率的影响。固定超声振幅为25%,间歇与脉冲激发时间比为1∶1,水与红细胞体积比为3∶1,研究不同超声时间(5、10、15、20、25 min)对血红蛋白提取率的影响。固定超声振幅为25%,超声时间为15 min,水与红细胞体积比为3∶1,研究不同间歇与脉冲激发时间比(1∶3、1∶2、1∶1、2∶1、3∶1)对血红蛋白提取率的影响。固定超声振幅为25%,超声时间为15 min,间歇与脉冲激发时间比为1∶1,研究不同水与红细胞体积比(2∶1、3∶1、4∶1、5∶1、6∶1)对血红蛋白提取率的影响。
1.2.5 响应面实验设计 通过单因素实验,筛选出各因素合适的水平,然后采用Designexpert 8.0.6进行响应面设计,基于BoxBehnken进行四因素三水平实验。实验因素与水平的编码表如表1。

表1 响应面实验因素及水平表Table 1 The factors and levels of the response surface experiment
1.2.6 血红蛋白结构表征 取一定量在最优超声工艺条件下制备的血红蛋白冻干样品(冻干条件为:40 ℃,0.02 MBar,35 h)与标准血红蛋白,利用紫外光谱、红外光谱、圆二色谱、显微共焦激光拉曼光谱方法研究分析超声提取工艺对血红蛋白结构(包括卟啉环)的影响。
1.2.6.1 紫外可见光谱 配制0.1 mg/mL的血红蛋白样品和标准品,在200~800 nm下进行紫外可见光谱全扫描,对二者的吸收光谱进行比较。
1.2.6.2 红外图谱分析 采用溴化钾压片法进行红外光谱扫描测定。分别称取血红蛋白样品与标准品冻干粉末若干,加入一定量溴化钾进行研磨,测定条件设置为:扫描范围为4000~400 cm-1,扫描次数64次,仪器分辨率4 cm-1。
1.2.6.3 圆二色谱 取一定量血红蛋白样品和血红蛋白标准品分别溶于pH7.4的磷酸缓冲液中,配制成浓度为0.05 mg/mL的待测溶液。测定条件:使用0.1 cm的石英比色皿,温度设置25 ℃,扫描速率为100 nm/min,扫描范围为190~260 nm。
1.2.6.4 显微共焦激光拉曼光谱 取血红蛋白样品与标准品冻干粉末在室温下进行拉曼光谱测定。测定条件为:激光波长633 nm,激光分辨率2 cm-1,扫描波数范围:200~2000 cm-1,激光功率15 mW。
1.3 数据处理
通过SPSS软件进行单因素方差分析,每组实验重复三次。采用origin 8.5软件绘制实验折线图。采用Designexpert 8.0.6进行响应面设计及方差分析,得到响应面设计表及方差分析结果。
2 结果与分析
2.1 单因素实验
2.1.1 超声振幅对红细胞破碎释放血红蛋白提取率的影响 从图1可以看出,当其它因素一定时,随着超声振幅的增加,血红蛋白提取率呈现先增加后减少的趋势,当超声振幅达到25%时,血红蛋白提取率达到最高。超声振幅与输出超声功率呈现良好线性关系[11],而超声空化作用和超声波功率有关,振幅越大,输出超声功率越大,空化作用强度越大,则红细胞破碎越完全。但振幅太大,空化作用会趋于饱和,同时也容易产生局部过热使得已溶出的血红蛋白发生聚集沉淀[16]和导致部分红细胞变性,从而阻碍了血红蛋白的释放[17]。因此,在破碎过程中要注意采取碎冰降温或者其它降温方式。
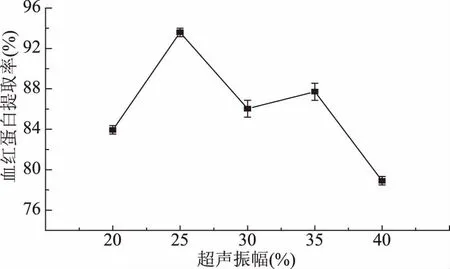
图1 超声振幅对血红蛋白提取率的影响Fig.1 The effects of ultrasonic amplitude on hemoglobin yield
2.1.2 超声时间对红细胞破碎释放血红蛋白提取率的影响 从图2可以看出,当其它因素一定时,随着超声时间的增加,血红蛋白提取率呈现先增加后减少的趋势,当超声时间达到10 min时,血红蛋白提取率达到最高。也就是说10~25 min之间,血红蛋白提取率随着超声作用时间的延长而降低,这是因为超声时间越长,超声波在破碎细胞的同时产生的空化气泡越多并且释放的热量形成的瞬间高温会对红细胞产生加热作用,时间越长,被加热的红细胞数目越多,这可能会使部分红细胞变性[17],从而阻碍了血红蛋白的释放,同时长时间的超声作用会使得已溶出血红蛋白由于非共价作用聚集沉淀[16],从而使得血红蛋白提取率降低了。
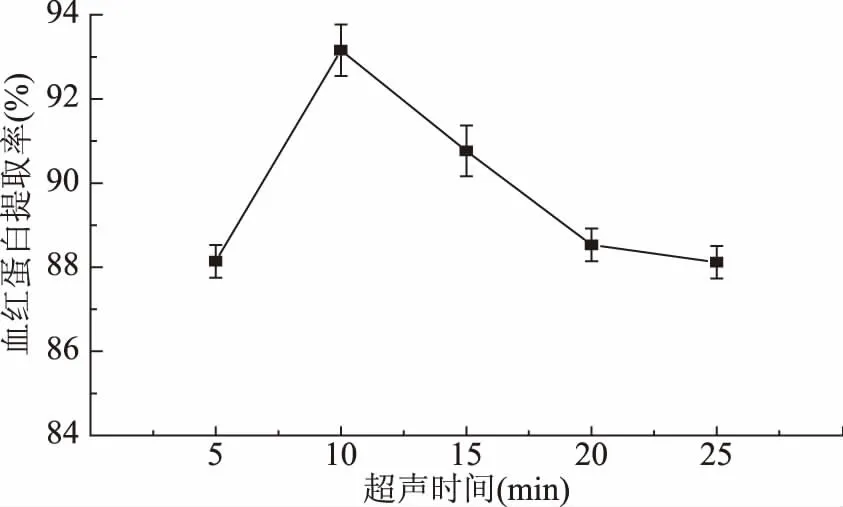
图2 超声时间对血红蛋白提取率的影响Fig.2 The effects of ultrasonic time on hemoglobin yield
2.1.3 间歇与脉冲激发时间比对红细胞破碎释放血红蛋白提取率的影响 从图3可以看出,随着间歇时间(s)与脉冲激发时间(s)比值的逐渐增大,血红蛋白提取率呈现先增加后减少的趋势。当二者比例为2∶1时,血红蛋白提取率达到最大。间歇时间与超声波空化作用和热效应息息相关,是消除超声波热效应的有效手段之一。间歇时间里容易产生气泡,大大提高了超声过程中发生空化作用的机率[18],空化产生的极大压力使得更多的红细胞更容易破碎,因此血红蛋白含量会升高。当间歇时间一定时,脉冲激发时间越长即超声时间越长,血红蛋白提取率先增加后减少这与前面的结论也是一致的。
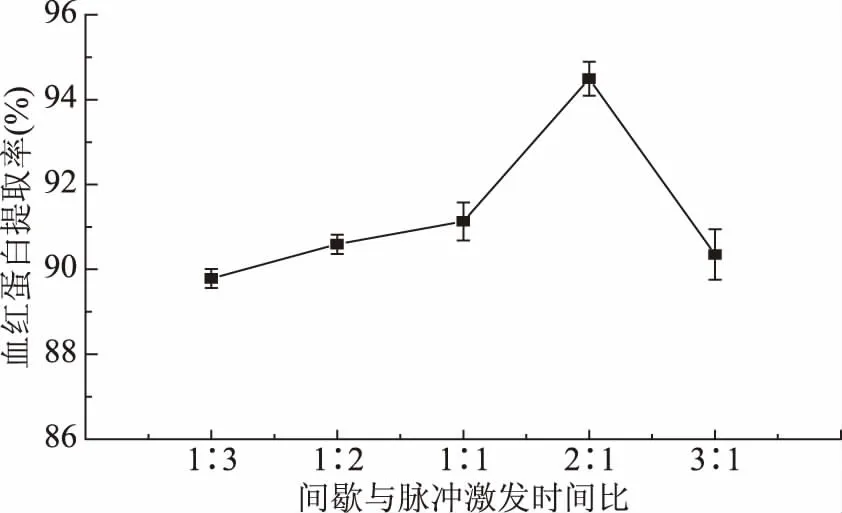
图3 间歇与脉冲激发时间比对血红蛋白提取率的影响Fig.3 The effects of ratios of quiescent interval to impluse excitation time on hemoglobin yield
2.1.4 水与红细胞体积比对红细胞破碎释放血红蛋白提取率的影响 从图4可以看出,当其它因素一定时,随着水与红细胞体积比的增加,血红蛋白提取率呈现上升趋势,当加水量达到红细胞体积的4倍后时,血红蛋白提取率增加缓慢。这是因为加入水后红细胞细胞膜外的渗透压降低了从而导致红细胞吸水胀破,同时超声波的空化作用也加速了红细胞的破碎,因而血红蛋白提取率升高[19]。但是从经济方面和后续实验考虑,4倍加水体积后血红蛋白提取率增加缓慢,且加水量过多使血红蛋白浓度降低较多,不利于后期酶解实验的进行,因此初步确定加水量为红细胞体积的4倍。

图4 水与红细胞体积比对血红蛋白提取率的影响Fig.4 The effects of volume ratios of water to red blood cell on hemoglobin yield
2.2 响应面实验结果及数据分析
2.2.1 响应面实验设计方案及结果 在单因素实验基础上,采用BBD组合实验,以血红蛋白提取率作为响应值,分别考察超声振幅、超声时间、间歇与脉冲激发时间比以及水与红细胞体积比对超声破碎红细胞制备血红蛋白的影响。由Designexpert 8.0.6统计分析软件设计的响应面分组及实验结果见表2。

表2 响应面实验方案及结果Table2 The scheme and results of response surface experiment


表3 模型方差分析结果Table 3 Analysis result of model variance
2.2.3 响应面图分析 通过响应面分析软件得到的三维曲面图和二维等高线图可以很直观的反映各因素间的交互作用。图5反应的是对血红蛋白提取率具有显著影响的三个交互作用即 AB、AC、AD的三维图像(a1、b1、c1)以及二维等高线(a2、b2、c2),可以看出b1的曲面最陡峭,b2的二维等高线最接近椭圆形,这说明AC的交互作用即超声振幅和间歇与脉冲激发时间比的交互作用最强,对血红蛋白提取率的影响极显著[21]。
图5b1所示为AC交互作用的三维曲面图。当超声时间和水与红细胞体积比分别固定在10 min和4∶1时,血红蛋白提取率达到最大预测值时的超声振幅为25.79%,间歇与脉冲激发时间比为1.89∶1。在超声振幅和间歇与脉冲激发时间比的范围内,当间歇与脉冲激发时间比较低时,血红蛋白提取率随着超声振幅的增加而快速增加,随着超声振幅的连续增加,提取率缓慢下降;当间歇与脉冲激发时间比较高时,血红蛋白提取率随着超声振幅的增加而增加缓慢,随着超声振幅的进一步增加,提取率快速降低。当超声振幅较低时,随着间歇与脉冲激发时间比的增加,血红蛋白提取率也增加;当超声振幅较高时,提取率随着间歇与脉冲激发时间比的增加而减少[22]。其次,超声振幅的响应曲面比间歇与脉冲激发时间比的响应曲面陡峭,说明超声振幅对血红蛋白提取率的影响高于间歇与脉冲激发时间比。这与上述的方差分析结果相符合。

图5 AB、AC、AD的交互作用对血红蛋白提取率的响应面图Fig.5 Response surface plots of variable parameters(AB,AC,AD)on the yield of hemoglobin
2.2.4 验证实验 通过响应面优化出最优条件为:超声振幅26.03%,超声时间10.14 min,间歇与脉冲激发时间比为1.86∶1,水与红细胞的体积比为4.27∶1,此时血红蛋白提取率为92.8136%。根据实际情况,选择超声振幅为26%,超声时间为10.15 min,间歇与脉冲激发时间比为2∶1,水与红细胞体积比为4.25∶1,在此条件下进行验证实验,测得的血红蛋白提取率为91.4763%,与回归方程所得的预测值相差1.34%,由此可认为实测值与预测值具有良好的吻合性,该回归模型与实际情况拟合良好,具有较好的预测性。本文通过响应面优化出的最佳血红蛋白提取率(91.4763%)与郝玉兰等[15]的研究结果(92.33%)近似,但最优超声时间与超声功率都比之降低,分析原因可能是采用的动物血液品种及来源不同、超声波装置及型号不同,故破碎效果不同。
2.3 超声提取工艺对血红蛋白结构变化
2.3.1 超声处理对血红蛋白结构影响的紫外可见图谱分析 血红蛋白的紫外可见吸收光谱中出现的电子带分别为:280 nm(色氨酸,酪氨酸中苯基)、360 nm(ε带)、406 nm(Soret带)、576 nm(Q带)[23],其中与位于血红蛋白疏水口袋中的血红素密切相关的电子条带为:Soret带以及Q带,它们也是卟啉类化合物鉴别的重要特征。Soret带的强度、位置、形状与卟啉环联系紧密,Q带的位置则反映了血红素周围环境的变化[24]。如图6所示,超声后血红蛋白相较于未超声血红蛋白而言,Soret带红移了近3 nm,且Q带的位置、形状也发生了变化,由单峰变化为肩峰。说明血红蛋白经过超声处理后其蛋白结构已经发生变化,且血红蛋白配体血红素基团在这个过程中也受到扰动,但其结构即卟啉环并未发生断裂(Soret带仍存在)。

图6 超声处理对血红蛋白结构影响的紫外图谱Fig.6 UVVis spectra of the ultrasound treated hemoglobin sample 注:a:未超声血红蛋白;b:超声后血红蛋白;图7~图9同。
2.3.2 超声处理对血红蛋白结构影响的红外光谱分析 在红外光谱中,酰胺Ⅰ带和酰胺Ⅱ带可以提供蛋白质构象变化的信息。酰胺Ⅰ带反映的是C=0伸缩振动,常出现于1600~1700 cm-1范围内,提供蛋白质二级结构信息。酰胺Ⅱ带是NH弯曲振动及CN伸缩振动的偶合峰,常出现于1500~1600 cm-1[25]。酰胺Ⅰ带和酰胺Ⅱ带能更敏锐的反应出蛋白质二级结构变化,因此分析酰胺Ⅰ带和酰胺Ⅱ带变化更有利于分析超声条件对血红蛋白结构变化的影响[25]。如图7所示,与未超声Hb相比较,超声后血红蛋白样品的酰胺I带吸收峰位置由1654 cm-1偏移至1656 cm-1,酰胺II带吸收峰位置由1539 cm-1转移至1540 cm-1,并且经过超声处理后两峰强度都减弱,这表明超声处理使得血红蛋白的二级结构发生了变化[26]。
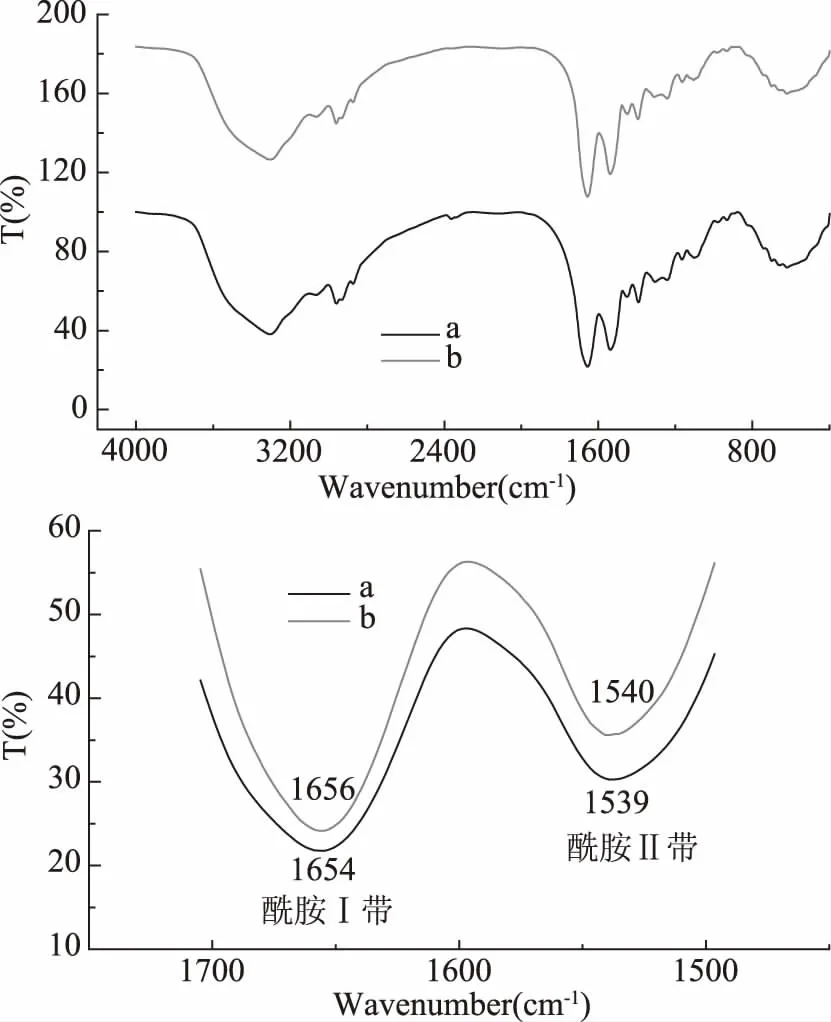
图7 超声处理对血红蛋白结构影响的红外图谱Fig.7 FTIR spectra of the ultrasound treated hemoglobin sample
2.3.3 超声处理对血红蛋白结构影响的圆二色谱分析 如图8所示,以未超声血红蛋白作为对照,其在194 nm处有一正峰,在210 nm以及222 nm处各存在一负峰[27],可以发现,超声处理后的样品在194 nm处的正峰强度增强,在两负峰处的强度减弱,并且位于210 nm处峰出现稍微红移的现象,这表明超声处理后血红蛋白α螺旋结构损失。α螺旋比其它二级结构如β折叠等更紧密,它们一起维持蛋白稳定。超声处理后的血红蛋白其α螺旋所占比例相较于未超声血红蛋白的86.6%降低至60.3%,β折叠则由4.7%上升至26.1%。α螺旋的减少和β折叠的增加会导致血红素中心暴露[28]。通过上述现象可以得出,超声破碎红细胞制备血红蛋白样品这一过程对血红蛋白的结构有一定影响,会引起蛋白结构变化,从而使血红素暴露出来。

图8 超声处理对血红蛋白结构影响的圆二色谱图Fig.8 CD spectra of the ultrasound treated hemoglobin sample
2.3.4 超声处理对血红蛋白结构影响的显微共焦激光拉曼光谱分析 血红蛋白拉曼光谱因血红素的拉曼散射截面相对而言较大,因此主要反映的是血红素的一些振动特征[29]。与血红素密切相关的一些标志峰多集中在低频区,而具有蛋白质性质的拉曼谱带则多集中在高频区。图9中,未超声血红蛋白拉曼强度约是超声后血红蛋白拉曼强度的8陪。未超声血红蛋白和超声后血红蛋白样品均在低频区有两个较显著的峰,分别是ν1(670±2) cm-1以及ν2(756±4) cm-1,对应的分别是Fe与配体以及卟啉环的特征峰[30,31],同样地,在高频区中的ν4(1453±2) cm-1,ν5(1584±2) cm-1是血红素铁与各配位体结合的特征峰,ν31399 cm-1是表征血红素氧化状态的特征峰[32]。这些与血红素卟啉环密切相关的特征峰在超声处理前后都存在,仅仅拉曼峰强度减弱,这初步说明超声处理得到的血红蛋白的卟啉环并未断裂,这与紫外图谱分析结果一致。但是由于血红素四周蛋白结构在超声作用下发生变化,导致血红素状态也发生变化(血红素中心从疏水性内穴暴露在外,荧光强度大大增强,对拉曼测定造成一定干扰),因此峰强度大大减弱。
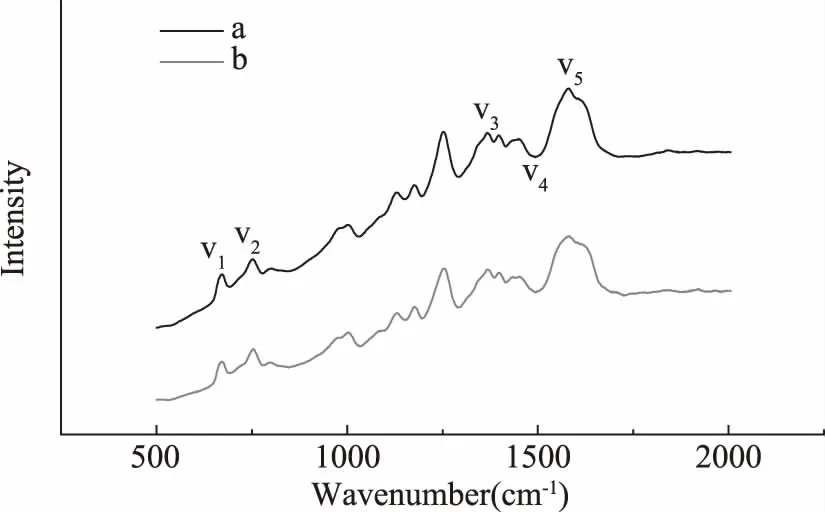
图9 超声处理对血红蛋白结构影响的显微共焦激光拉曼光谱Fig.9 Confocal MicroRaman spectra of the ultrasound treated hemoglobin sample
3 结论
本实验对超声波破碎红细胞提取血红蛋白的工艺进行优化,最终响应面优化结果为:超声振幅为26%,超声时间为10.15 min,间歇与脉冲激发时间比为2∶1,水与红细胞体积比为4.25∶1,此时血红蛋白提取率为91.4763%。在此工艺基础上,研究了超声处理对提取得到的血红蛋白结构及其中卟啉环结构的影响,得出该超声工艺会使血红蛋白二级结构发生改变,从而会使得疏水空穴中的血红素暴露出来,但是其中卟啉环结构并未发生断裂。这为后续进一步研究卟啉环上的取代反应、开发相关卟啉类产品打下了一定基础。
[1]Sorapukdee S,Narunatsopanon S. Comparative study on compositions and functional properties of porcine,chicken and duck blood[J]. Korean Journal for Food Science of Animal Resources,2017,37(2):228241.
[2]Tarté R. 4Meat protein ingredients[J]. Handbook of Food Proteins,2011,2008(7):5691.
[3]Hsieh Y H P,Ofori J A. Food grade proteins from animal by-products:their usage and detection methods[M].Florida:CRC Press,2011:1335.
[4]黄群,马美湖,于美娟,等. 亚硝基血红蛋白研究进展[J]. 肉类工业,2004,14(11):2731.
[5]张立娟,邢绍平,孔保华,等. 糖基化血红蛋白着色剂在肉制品中的应用[J]. 肉类工业,2011,21(10):911.
[6]Toldrá F,Mora L,Reig M. New insights into meat byproduct utilization[J]. Meat Science,2016,120:5459.
[7]Lin L,Hu J. Inhibition of hepadnavirus reverse transcriptaseε RNA interaction by porphyrin compounds[J]. Journal of Virology,2008,82(5):230512.
[8]Piazza G J,Lora J H,Garcia R A. Flocculation of kaolin and lignin by bovine blood and hemoglobin[J]. Journal of Chemical Technology & Biotechnology,2015,90(8):14191425.
[9]蔡君. 猪血生物法制备血红素及珠蛋白肽的工艺研究[D].武汉:湖北工业大学,2013.
[10]Monaghan M,Browne S,SchenkeLayland K,et al. Disruption of microbial cells for intracellular products[J]. Enzyme & Microbial Technology,1986,8(4):194204.
[11]Garcia R A,Clevenstine S M,Piazza G J. Ultrasonic processing for recovery of chicken erythrocyte hemoglobin[J]. Food & Bioproducts Processing,2015,94(94):19.
[12]Jambrak A R,Mason T J,Lelas V,et al. Effect of ultrasound treatment on particle size and molecular weight of whey proteins[J]. Journal of Food Engineering,2014,121(1):1523.
[13]Hu H,Cheung I W Y,Pan S,et al. Effect of high intensity ultrasound on physicochemical and functional properties of aggregated soybeanβconglycinin and glycinin[J]. Food Hydrocolloids,2015,45:102110.
[14]Shah V B,Shah B S,Puranik G V. Evaluation of non cyanide methods for hemoglobin estimation[J]. Indian Journal of Pathology and Microbiology,2012,54(4):764768.
[15]赫玉兰,卢士玲,吴亚楠,等. 响应面优化超声波法提取牛血红蛋白工艺[J]. 食品工业科技,2015,36(10):259263.
[16]Jiang L,Wang J,Li Y,et al. Effects of ultrasound on the structure and physical properties of black bean protein isolates[J].Food Research International,2014,62(6):595601.
[17]宋珊珊. 杂合肽PM23的分子设计与表达和从猪血中提取血红素技术的研究[D]. 青岛:中国海洋大学,2009.
[18]杨云贵,朱万平,张富强,等. 间歇式超声波法提取猪血中的氯化血红素[J]. 宜宾学院学报,2009,9(6):6264.
[19]刘振荣,王君,张向东,等. 超声波法提取氯化血红素的初步研究[J]. 辽宁大学学报:自然科学版,2003,30(4):373377.
[20]周玲,阚建全,汪学荣,等. 超声波法提取猪血液中血红蛋白的研究[J]. 食品科学,2009,30(4):6366.
[21]Altemimi A,Watson D G,Choudhary R,et al. Ultrasound assisted extraction of phenolic compounds from peaches and pumpkins.[J]. Plos One,2016,11(2):120.
[22]Liu Y,Gong G,Zhang J,et al. Response surface optimization of ultrasoundassisted enzymatic extraction polysaccharides from Lycium barbarum.[J]. Carbohydrate Polymers,2014,110(38):278284.
[23]邵倩. 纳米结构对蛋白质构象影响的电化学及谱学研究[D]. 南京:南京师范大学,2012.
[24]Mir M U H,Maurya N,Beg I,et al. An insight into the binding of an ester functionalized gemini surfactant to hemoglobin[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects,2016,507:3645.
[25]丁稳. 血红蛋白直接电化学行为及构建水合肼生物传感器[D]. 南京:东南大学,2015.
[26]Fang Q,Wang Y,Hu T,et al. Interaction of the minocycline with extracelluar protein and intracellular protein by multi-spectral techniques and molecular docking[J]. Journal of Molecular Structure,2017,1130:425433.
[27]周振. 血红素辅基对肌红蛋白构象影响的光谱研究[D]. 长春:吉林大学,2007.
[28]Qian Y,Xu X,Wang Q,et al. Electrochemical probing of the solution pHinduced structural alterations around the heme group in myoglobin[J]. Physical Chemistry Chemical Physics Pccp,2013,15(39):169418.
[29]卢明子,郭延军,赵莲,等. 拉曼光谱在血红蛋白结构及功能研究中的应用进展[J]. 光谱学与光谱分析,2014,34(2):439444.
[30]Atkins C G,Schulze H G,Chen D,et al. Using Raman spectroscopy to assess hemoglobin oxygenation in red blood cell concentrate:An objective proxy for morphological index to gauge the quality of stored blood?[J]. Analyst,2017,142:21992210.
[31]吴正洁. 温度对人红细胞及血红蛋白结构功能的影响[D]. 广州:暨南大学,2007.
[32]Nagai M,Nagai Y,Aki Y,et al. Heme orientation of cavity mutant hemoglobins(His F8 Gly)in eitherαorβsubunits:Circular dichroism,1HNMR,and resonance raman studies[J]. Chirality,2016,28(8):585592.

