海南省南繁区玉米链格孢叶斑病病原菌鉴定及其生物学特性
郑肖兰, 赵 爽,2, 韩小雯,2, 习金根, 郑金龙, 梁艳琼, 吴伟怀, 李 锐, 贺春萍, 易克贤,3
(1.中国热带农业科学院环境与植物保护研究所,海南海口 571101; 2.海南大学环境与植物保护学院,海南海口 570228;3.中国热带农业科学院热带生物技术研究所,海南海口 571101)
链格孢属(Alternariasp.)是一类极为常见的真菌,广泛分布在农作物、树木、空气、土壤、污水等多种基质中,是重要的植物病原菌。在美国农业部真菌寄主索引中记录了4 000多种链格孢属真菌,是农作物的主要致病菌之一,它能引起包括玉米、小麦、烟草、马铃薯、番茄、苹果、梨等几十种农作物发病,如发生黑斑病、褐斑病、叶斑病、赤星病等,严重影响了农作物的产量,给我国农业生产带来了巨大损失[1]。
玉米作为主要的粮食作物,优质、高产玉米和制种玉米不断被推广[2],在生产上玉米叶斑病的危害日趋严重,在我国云南、辽宁、黑龙江、甘肃和吉林等省部分玉米种植区均有发生,该病主要危害玉米叶片和苞叶,病斑不规则、透光、中央灰白色、边缘褐色。玉米生长季节发生的叶斑病主要有大斑病、小斑病和褐斑病,部分地区可能发生灰斑病以及弯孢属(Curvalaria)、链格孢属(Alternariasp.)病原菌引起的叶斑病[3]。几种病害的发生规律大体相似,病原菌都以病残体越冬,借风雨传播,病害一般从下部叶片开始发生,高温高湿天气有利于病害流行[4],由于气候原因,病原菌对宿主侵染危害会因宿主、环境等差异表现出不同的病害形态[5],从外观上比较难以辨别[6]。因此,本研究对海南省南繁区玉米叶斑病病菌进行分离鉴定,并研究其生物学特性。
1 材料与方法
1.1 试验材料
1.1.1供试材料供试材料为于海南省三亚市田独镇南滨农场玉米南繁基地采集到的病叶。
1.1.2供试培养基(1)PDA培养基:马铃薯200.0 g煮出液、葡萄糖18.0 g、琼脂20.0 g,加水至 1 000 mL。(2)PSA培养基:马铃薯200.0 g煮出液、蔗糖20.0 g、琼脂20.0 g,加水至 1 000 mL。(3)玉米绿叶煎汁培养基:玉米绿叶100.0 g煮出液、20.0 g琼脂、4.0 g CaCO3,加水至1 000 mL。(4)PDA+玉米绿叶煎汁培养基:PDA和玉米绿叶煎汁培养基等量混合。(5)PSA+玉米绿叶煎汁培养基:PSA和玉米绿叶煎汁培养基等量混合。(6)燕麦培养基:30.0 g燕麦煮出液、15.0 g蔗糖、20.0 g琼脂,加水至 1 000 mL。(7)Czapek培养基:MgSO4·7H2O 0.50 g、K2HPO41.00 g、KCl 0.50 g、NaNO32.00 g、FeSO4·7H2O 0.01 g、蔗糖20.00 g、琼脂20.00 g,加水至 1 000 mL。上述培养基均于121 ℃高压灭菌20 min后备用。如果需要加入抗生素,则待培养基冷却至40~60 ℃,加入50.0 μg/mL四环素、100.0 μg/mL 链霉素,摇匀倒平板备用。
1.1.3试剂琼脂、葡萄糖、蔗糖、CaCO3、MgSO4·7H2O、K2HPO4、KCl、NaNO3、FeSO4·7H2O、淀粉、链霉素、四环素、HCl、NaOH、麦芽糖、乳糖、D-木糖、D-果糖、L-精氨酸、L-丝氨酸、L-赖氨酸、L-谷氨酰胺、L-亮氨酸、L-脯氨酸、L-缬氨酸、苏氨酸、甘氨酸等。
1.1.4仪器设备打孔器、培养皿、锥形瓶、超净工作台、电子天平、摇床、恒温培养箱、冰箱、高压蒸汽灭菌锅、电子显微镜、水浴锅、酒精灯、剪刀、镊子等。
1.2 试验方法
1.2.1病原菌的分离与鉴定
1.2.1.1病原菌的分离与纯化从海南省三亚市田独镇南滨农场玉米南繁基地采集症状典型的玉米叶斑病病叶,采用常规组织分离和单孢分离法进行分离纯化,获得的菌株(命名为C22菌株)置于斜面培养基低温(4 ℃)保存。
1.2.1.2柯赫氏法则验证参照柯赫氏法则,将培养好的菌落,接种至新鲜健康的玉米叶片上,玉米叶片接菌后,底部铺上1层侵透无菌水的灭菌滤纸,保鲜膜封口。看发病症状是否与原来症状相同,然后再次分离病叶上的孢子,看孢子形态特征与原分离菌株形态是否相同。
1.2.1.3ITS保守序列鉴定PCR扩增采用真菌ITS区段的通用引物。ITS1:5′-GGAAGGTAAAAGTCAAGG-3′;ITS4:5′-TCCTCCGCTTATTGATATGC-3′。反应体系如下:PCR扩增反应总体积为20.0 μL,10×PCR反应缓冲液2.0 μL,2.0 mmol/L dNTP 2.0 μL,25.0 mmol/L MgCl21.2 μL,20.0 μmol/L 引物ITS1 0.2 μL,20.0 μmol/L引物ITS4 0.2 μL,5.0 U/μLTaqDNA聚合酶0.1 μL,模板DNA 10.0~20.0 ng,ddH2O补充至20.0 μL。反应参数设定:94 ℃ 3 min;94 ℃ 45 s,60 ℃ 45 s,72 ℃ 1 min,35个循环;72 ℃延伸10 min,4 ℃ 保存。PCR扩增产物用1%琼脂糖凝胶电泳检测。取3 μL上述PCR扩增产物,用1×TAE制备1%琼脂糖凝胶进行点样,在5 V/cm恒电压条件下电泳30 min后,取出凝胶在紫外灯下观察并照相。剩余产物送往生工生物工程(上海)股份有限公司测序。扩增产物回收、测序后,将序列与NCBI数据库进行同源性分析,进行菌株鉴定,并构建其系统进化树。
1.2.2病原菌C22菌株的生物学特性研究
1.2.2.1培养基对菌丝生长的影响选用PDA培养基、PSA培养基、玉米绿叶煎汁培养基、PDA+玉米绿叶煎汁培养基、PSA+玉米绿叶煎汁培养基、燕麦培养基和Czapek培养基,用直径为0.5 cm的打孔器打取PDA培养基上的菌落边缘,菌丝块分别接种在各种培养基的平板中央,在26 ℃恒温箱中培养。接种4 d后用十字交叉法测量菌落直径,每个处理重复4次,取菌落直径的平均值,同时观察菌落形态,主要记录菌落边缘规则程度、菌落的致密程度、菌落正反两面的颜色、菌落的凸起情况以及菌落的光滑程度等培养性状。
1.2.2.2不同温度对菌株C22菌丝生长的影响将培养好的分离菌,用打孔器打成直径为0.5 cm的菌饼,移于直径为 9.0 cm 的PDA平板中央。设10、15、20、25、28、37 ℃共6个温度梯度,每个温度4皿(4次重复)。4 d后测量菌落直径。
1.2.2.3不同pH值对菌株C22菌丝生长的影响用 1 mol/L HCl和1 mol/L NaOH调节PDA培养基的pH值分别为5、6、7、8、9、10、11,将培养6 d的菌块置于各种pH值的平板中央(4次重复),在28 ℃下培养。4 d后取出培养菌,观察菌落的生长特征,测定菌落大小。
1.2.2.4不同碳源对菌株C22菌丝生长的影响以固体Czapek培养基为基础培养基,再分别以蔗糖、麦芽糖、乳糖、D-木糖、D-果糖、可溶性淀粉替换原Czapek培养基中的蔗糖(使最终参试培养基中的纯碳含量为 0.701 8 g/L),配制成含有不同碳源的培养基,经高压灭菌后接种(4次重复)。置于 28 ℃ 下培养5 d,观察菌落生长特征,测定菌落直径。
1.2.2.5不同氮源对菌株C22菌丝生长的影响以固体Czapek培养基为基础培养基,分别用L-精氨酸、L-丝氨酸、L-赖氨酸、L-谷氨酰胺、L-亮氨酸、L-脯氨酸、L-缬氨酸、苏氨酸、甘氨酸替代NaNO3(纯氮0.329 4 g/L)作氮源,配成含有不同氮源的培养基,高压灭菌后接种(4次重复)。置于28 ℃下培养5 d,观察菌落生长特征,测定菌落直径。
1.2.2.6光照对菌株C22菌丝生长的影响将直径为 0.5 cm 的菌丝块接种于PDA平板中央,分别置于全日光照、全日黑暗2种条件下,于28 ℃恒温培养箱中培养(重复4次),5 d 后测量菌落直径。
2 结果与分析
2.1 玉米叶斑病病原菌鉴定
2.1.1链格孢霉叶斑病病害症状2016年2月于海南省三亚市田独镇南滨农场玉米南繁基地调查发现,链格孢菌主要在玉米生长后期危害叶片、叶鞘及苞叶。初期病部出现水渍状小圆斑点,逐渐扩展成椭圆形至近圆形的病斑,中央灰白色至纯白色,边缘红褐色,病健部交界明显。病斑扩展不受叶脉限制,大小为(0.5~1.5)cm×(0.5~0.8)cm。后期病部可见黑色霉层,一些病斑中间破裂穿孔,严重的整株叶片发病直至叶片死亡。采集病叶分离纯化得到病原菌C22菌株。
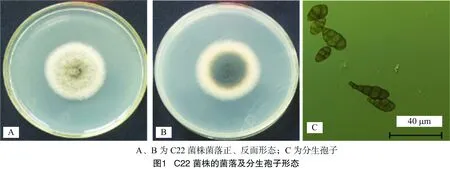
2.1.2病原菌C22菌株的形态特征观察C22菌株菌落的形态学鉴定见图1,在PDA培养基上该病原菌菌落呈圆形或近圆形,墨绿色或黑色;气生菌丝旺盛,灰白色(图1-A、图1-B);分生孢子梗淡褐色,直或稍弯曲;分生孢子大小为(18~42)μm×(6~15)μm,单生或簇生,一般簇生2~6个,形状变化极大,呈卵形、椭圆形、倒棍棒形,表面有缢缩,无喙或喙短,褐色至暗褐色,光滑或具瘤,孢痕明显,具横膈膜1~7个,多为4~5个(图1-C)。因此,将其初步鉴定为链格孢菌(Alternariaalternata)。
2.1.3C22菌株的柯赫氏法则验证叶片发病后首先出现水渍状小点,扩大后为圆形叶斑,边缘黄褐色。许多叶斑连成不定型大片病斑,病情发展迅猛(图2-A)。从病斑中分离出的病原菌接种至玉米叶片的发病症状(图2-B)与原叶片表现相同,分离后获得与原分离菌株相同形态的病原真菌,结果显示,供试菌株即为所观察到的玉米叶斑病的病原菌。
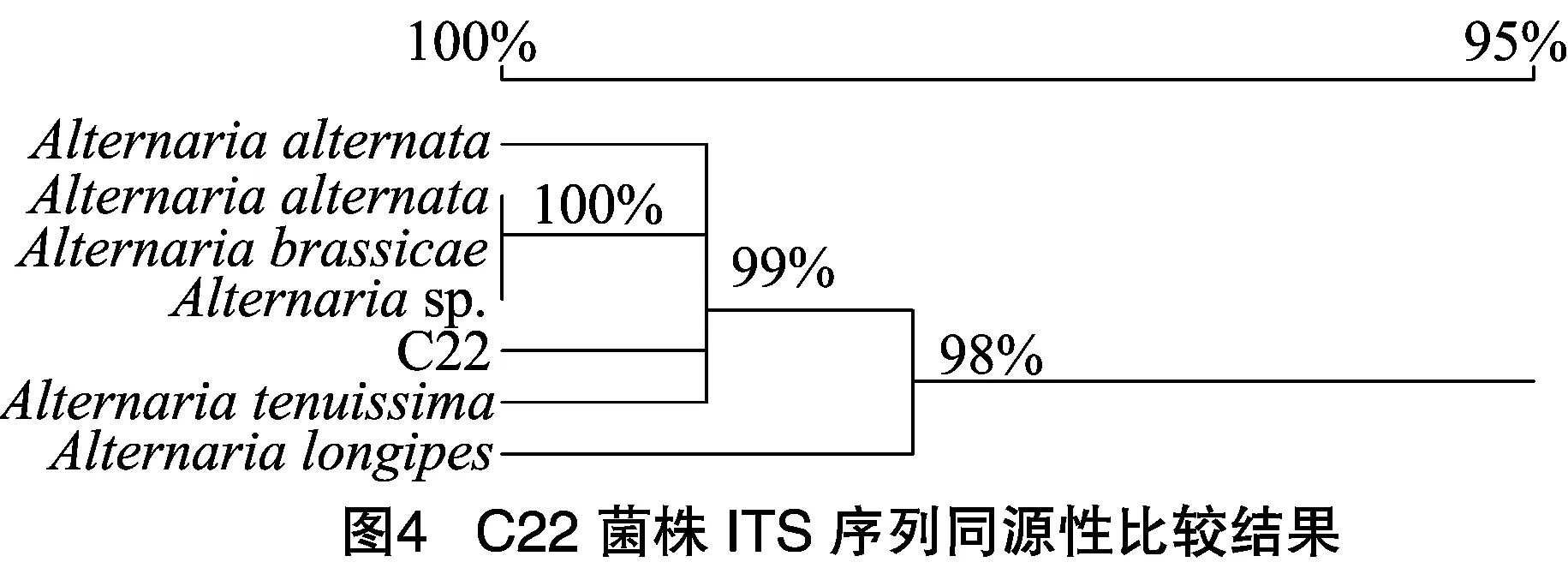
2.1.4C22菌株的ITS保守序列鉴定由C22菌株的ITS保守区PCR扩增电泳图(图3)可知,C22菌株均能扩增出1条650 bp左右的条带。经NCBI比对显示,C22菌株与链格孢属(Alternaria)几株真菌序列相似性最高。由图4可知,C22菌株与GenBank中已报道的链格孢(Alternariaalternata)、细极链格孢(Alternariatenuissima)、芸薹链格孢(Alternariabrassicae)、链格孢属(Alternariasp.)等亲缘关系较近,C22菌株与上述几种链格孢同源性达到99%以上,结合形态学特征确认致病菌是链格孢菌(Alternariaalternata),为半知菌亚门、丝孢纲、丝孢目、暗孢科、链格孢属真菌。
2.2 病原菌C22菌株的生物学特性研究
2.2.1不同培养基对链格孢菌菌丝生长的影响不同培养基对链格孢菌丝生长的影响结果见图5、图6。从结果可以看出,在不同培养基上链格孢菌的菌落形态有一定的差异。7种培养基培养结果表明,该病原菌在PDA、PSA、玉米绿叶煎汁、PDA+玉米绿叶煎汁、PSA+玉米绿叶煎汁、燕麦、Czapek这7种培养基上均能生长,且平均生长直径在3.7~4.0 cm之间,差异不十分明显,其中C22菌株在PDA+玉米绿叶煎汁培养基上生长较好,在燕麦和Czapek培养基上生长稍弱。在PDA+玉米绿叶煎汁培养基上该病原菌菌落形状规则,呈圆形,墨绿色或黑色绒状,气生菌丝较旺盛,灰白色,有明显轮纹;C22菌株在PSA、PDA、PSA+玉米绿叶煎汁培养基上菌落相似,菌落直径差异小,呈圆形或近圆形,墨绿色绒状,气生菌丝旺盛,有轮纹;在燕麦培养基上菌落形状规则,圆形,菌落呈浅墨绿色;在Czapek和玉米绿叶煎汁培养基上菌落呈灰白色,菌落规则,无明显轮纹,气生菌丝少,无色素产生。


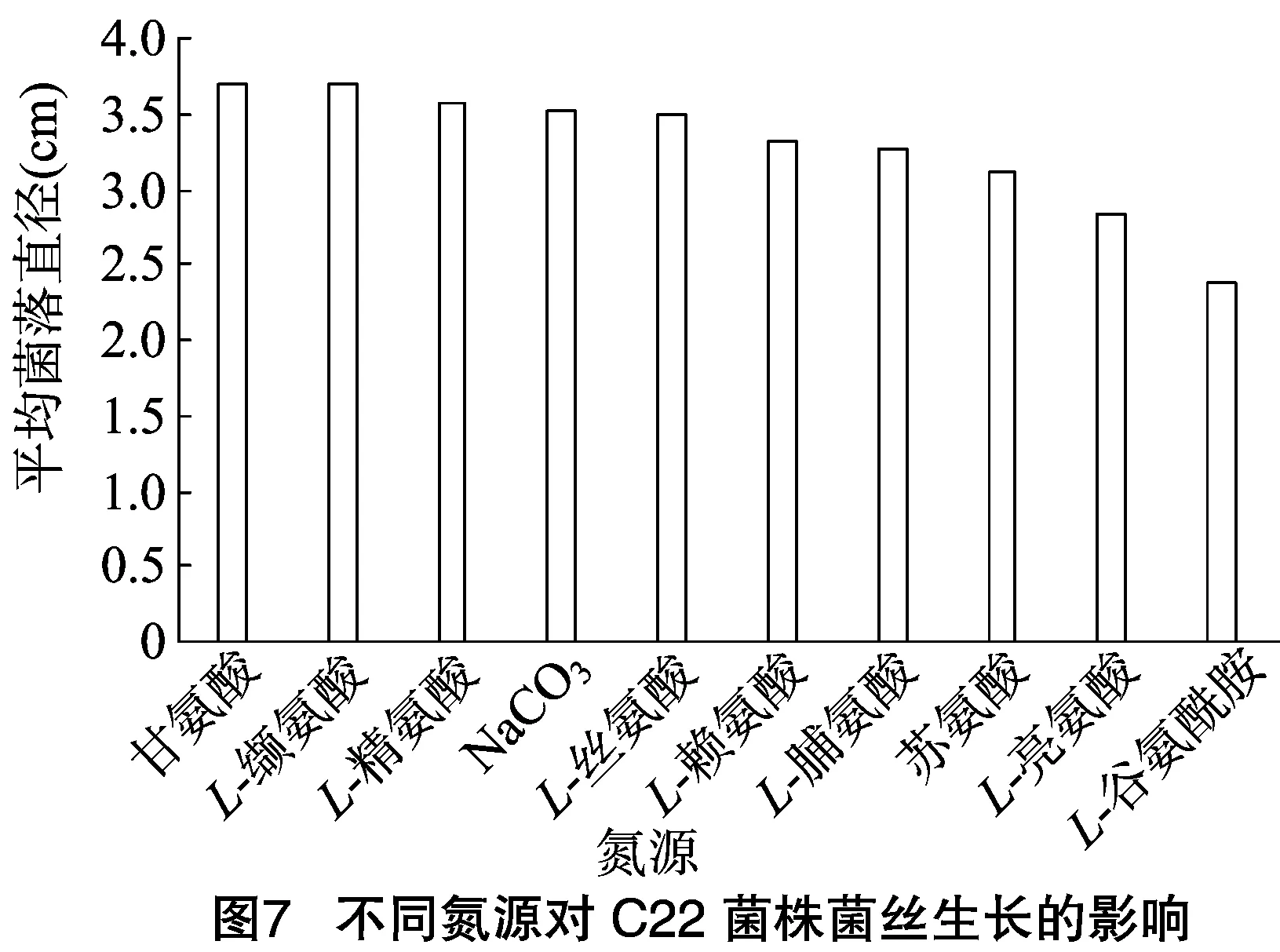
2.2.2不同氮源对C22菌株菌丝生长的影响不同氮源对链格孢菌菌丝生长的影响见图7、图8,可见在所有的参试培养基中C22菌株的气生菌丝稀薄,总体上除L-亮氨酸上菌落呈灰白色外,其他菌落中心均呈褐色且边缘呈灰白色,其中以甘氨酸、L-缬氨酸、L-精氨酸、NaNO3、L-丝氨酸为氮源时,C22菌株菌丝生长较快,平均菌落直径为3.5~3.7 cm;以L-赖氨酸、L-脯氨酸和苏氨酸为氮源时,C22菌株菌丝生长较慢,平均菌落直径为3.1~3.3 cm;而以L-谷氨酰胺、L-亮氨酸为氮源时C22菌株菌丝生长最慢,平均菌落直径分别为2.4、2.8 cm。


2.2.3不同碳源对C22菌株菌丝生长的影响不同碳源对链格孢菌丝生长的影响见图9、图10,结果显示参试的不同碳源培养基上C22菌株菌落颜色、直径及气生菌丝差异都较大,其中以蔗糖、乳糖、淀粉为碳源时C22菌株的菌落呈褐色,气生菌丝较少;以木糖、麦芽糖、果糖和葡萄糖为碳源时C22菌株的菌落呈白色,气生菌丝较多,且以木糖和麦芽糖为碳源时菌丝呈发散状,以果糖和葡萄糖为碳源时菌落边缘整齐;而对照菌丝稀薄,几乎呈透明状。以麦芽糖为碳源时菌丝生长最快,平均菌落直径达到4.6 cm,其次生长较好的是可溶性淀粉培养基,平均菌落直径为4.0 cm;在木糖、蔗糖、乳糖培养基上C22菌株平均菌落直径分别为3.5、3.4、3.3 cm;CK、果糖、葡萄糖培养基上C22菌株平均直径分别为3.1、3.0、2.7 cm。


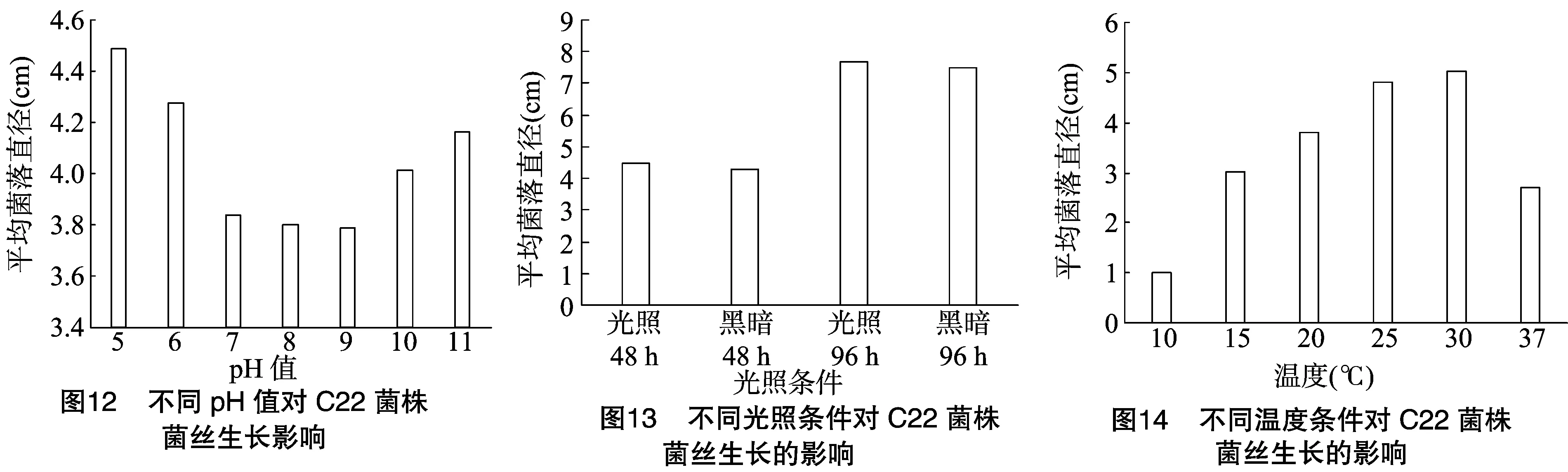
2.2.4pH值对链格孢C22菌株菌丝生长的影响不同pH值对C22菌株菌丝生长的影响见图11、图12,C22菌株菌丝在参试pH值5~11培养基下的生长状况略有不同,菌落平均直径在3.8~4.5 cm之间;其中pH值为5、6时C22菌株的气生菌丝生长最好,且平均菌落直径较大,分别为4.5、4.3 cm;当pH值为7、8、9时,C22菌株平均菌落直径均约为3.8 cm;当pH值为10、11时,C22菌株平均菌落直径分别为4.0、4.2 cm;总的来说,C22菌株菌丝生长承受的pH值范围很广,而且试验结果显示C22菌株在偏酸或偏碱的情况下菌丝平均生长直径比中性时大,但气生菌丝则随着碱性偏大而略显稀薄(图11)。

2.2.5不同光照对C22菌株菌丝生长的影响不同光照对菌丝生长的影响见图13,该供试菌株在28 ℃条件下培养 24 h 后,对连续光照或黑暗处理48、96 h的菌落生长直径进行测定,其中在光照条件下菌丝生长稍好,但光照条件对菌丝生长速率的影响与黑暗条件下差异不明显,总体趋势是连续光照更有利于菌丝生长。
2.2.6不同温度对C22菌株菌丝生长的影响不同温度对菌丝生长的影响见图14,不同温度对病原菌C22菌株菌丝生长速率的影响很大,病原菌在供试温度范围内均能生长,适宜菌丝生长的温度范围为20~30 ℃,菌丝生长速率随温度的升高而增大,不同温度之间差异较明显,20 ℃以下及30 ℃以上生长速率明显下降;其中最适宜的生长温度为30 ℃,此时平均菌落直径为5.2 cm。
3 结论与讨论
本研究通过田间症状描述、形态学分析、ITS分子鉴定等,对海南省南繁区玉米叶斑病的病原菌进行鉴定,确定是由链格孢菌侵染引起。试验采用科赫氏法则、菌丝生长速率法等对玉米叶斑病病原菌进行验证及生物学特性研究。结果表明,不同的氮源、碳源、光照、培养基、pH值等条件对菌丝生长均有影响。病原菌在供试培养基上都能生长,但生长最适培养基是PDA+玉米绿叶煎汁培养基;最适的氮源是L-缬氨酸和甘氨酸;20~30 ℃为菌丝生长较适宜的温度范围,其中30 ℃时菌落直径最大,是最适宜菌丝生长的温度;病原菌对酸碱度适应范围较广,pH值为5时菌丝生长最好;光照对菌丝生长几乎没有影响,但长时间的光照更有利于菌丝生长。
White等对参试链格孢菌生物学特性的试验结果发现,最适合菌丝体生长的培养基为PDA+玉米绿叶煎汁、PDA[7],这与阎合研究的链格孢菌在PDA上生长较快[8]一致;最适宜菌丝生长的氮源是甘氨酸、L-缬氨酸、L-精氨酸、NaNO3、L-丝氨酸,此结果与魏薇的研究结果[9]基本一致,本研究数据显示以甘氨酸、L-缬氨酸为氮源的培养基更适合菌丝生长,但与NaCO3差异不明显。最适pH值为5,总体上C22菌株对酸碱度适应范围较广,但在pH值为10、11的偏碱性条件下菌丝生长速率没有下降,反而略有提高的结果与吴新颖对链格孢叶斑病的研究结果[10]不完全一致。光照条件对菌丝生长有一定的刺激性,但差异不明显,总体上光照更有利于菌丝生长。菌丝生长的适宜温度为20~30 ℃,且30 ℃时菌丝生长速率最大,与吴新颖的研究结果[10]一致。通过对玉米链格孢菌C22菌株生物学特性的研究,为阐明病菌生长和环境条件的关系,进一步解释玉米链格孢叶斑病的发生和发展规律提供了重要依据。
参考文献:
[1]蒋乃华. 从国际玉米市场态势看中国玉米经济发展策略[J]. 华中农业大学学报(社会科学版),2002(3):22-25.
[2]杨虎. 20世纪玉米种业发展研究[D]. 南京:南京农业大学,2011.
[3]董金皋,邓福友,王春芬,等. 我国玉米大斑病菌生理小种的温度效应研究[J]. 植物保护学报,1996,23(4):305-309.
[4]李继平,苓强,李敏权,等. 玉米叶点霉叶斑病菌生物学特性[J]. 植物保护学报,2013,40(4):383-384.
[5]周舒扬,汪春蕾,乔志新. 玉米链格孢菌叶枯病病原菌的分子鉴定[J]. 中国农学通报,2010,6(11):261-263.
[6]孙霞. 链格孢属真菌现代分类方法研究[D]. 泰安:山东农业大学,2006.
[7]White T J,Bruns T,Lee S,et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]. San Diego:Academic Press,1990:315-322.
[8]阎合. 甘草链格孢叶斑病研究[D]. 兰州:甘肃农业大学,2009.
[9]魏薇. 小蓟叶片上链格孢菌的研究[D]. 大庆:黑龙江八一农垦大学,2008.
[10]吴新颖. 万寿菊链格孢叶斑病研究[D]. 长春:吉林农业大学,2006.

