对医疗器械单一审核程序中见证检查工作的思考
【作 者】温晶,肖江宜,王爱君
国家食品药品监督管理总局食品药品审核查验中心,北京市,100061
医疗器械单一审核程序(Medical Device Single Audit Program, MDSAP)是国际医疗器械监管者论坛(International Medical Device Regulators Forum,IMDRF)设置的工作项目之一。该项目旨在制定一套审核程序统一满足多个国家监管机构的审核要求,主要用于经评估获得认可的检查机构对医疗器械生产企业的质量管理体系进行的检查。MDSAP不仅对生产企业的质量管理体系检查制定了一系列较为详细的检查流程和标准(相关内容见《医疗器械单一审核程序中质量管理体系检查工作的介绍》[1]),对申请进行该项目检查的第三方检查机构也制定了一系列的评估流程和要求[2-5],评估其是否具备了对生产企业进行相关体系检查的能力。在对检查机构的评估中,见证检查是现场评估的重要环节,MDSAP工作组选派评估组参与第三方机构对生产企业的体系检查,通过现场观察检查机构的检查行为确认其检查能力是否能够达到相关要求。
2017年3月,受巴西卫生监督局(ANVISA)邀请,国家食品药品监督管理总局食品药品审核查验中心派出观察员参与了MDSAP工作组对TüV莱茵北美有限公司(TüV Rheinland of North America, Inc.)和SGS英国公司(SGS United Kingdom Ltd.)两家第三方机构进行的见证检查工作,通过现场观察和与各方交流,初步了解了MDSAP工作组见证检查的流程和检查重点。
1 见证检查相关流程
1.1 见证检查的目的
获得认可的检查机构必须经过相应评估:检查机构需要向监管机构理事会秘书处提出申请,相关资料审核合格后评估项目管理人会组织相关评估工作,其中见证检查是现场评估的重要环节,目的是通过监管机构的评估组观摩检查机构在医疗器械生产企业检查中的行为,确认检查机构在下列方面的表现:①是否符合IMDRF/MDSAP WG/N3文件[6]中第9部分过程要求中的要求;②判定生产企业是否符合监管要求的能力;③可靠地向监管机构报告检查结果,包括不符合项的能力;④选择具备必要能力的检查组的能力。
1.2 见证检查基本流程[7-8]
1.2.1评估项目管理人制定计划
制定内容如下:①与检查机构联系获得检查计划;②确定见证检查任务,通知检查机构,获得生产企业相关信息;③选取评估组,指定评估组长,提供评估所需要的信息;④与评估组及检查机构联系,确定现场见证检查时间、检查计划、检察人员相关信息、生产企业相关资料等。
1.2.2现场见证检查
(1)首次会议:评估组长介绍评估组及检查组成员。阐明见证检查的目的和规程。确认检查中和检查后与检查组交流意见的方式和渠道。回答检查组的提问等。
(2)观察检查组的现场检查行为:见证检查期间评估人员不能影响检查组的检查工作。应该安排时间让检查组报告检查流程、检查计划及检查中发现的问题。评估人员将观察检查中的发现填入见证检查评估表。
(3)审核检查报告:检查组根据检查进程,在不超过15个自然日内将检查报告提交给生产企业和评估组长。评估组长和评估组成员共同评价该报告在与检查中发现问题的一致性、与法规需求的符合性、与检查工作叙述的真实性和完整性等方面是否符合要求。评估组在现场见证检查或审核检查报告过程中如果发现了不符合项应记录下来。评估组长主要负责见证检查报告和不符合项报告的撰写工作,评估组全体成员参与、审核和批准该报告。末次会议前,评估组将见证检查报告和不符合项报告提供给检查机构。
(4)末次会议:收到检查机构的检查报告15个自然日内评估组长与检查机构及评估项目管理人协商,使用电话会议的形式召开末次会议。会上评估组长向检查组及检查机构代表告知不符合项内容及结论,允许检查机构进行解释和说明。
(5)后续工作:评估组长收到和审核了检查机构针对不符合项的整改计划后,向评估项目管理人提交见证检查报告、不符合项报告及相关建议。评估项目管理人审核见证检查报告和相关信息,整理和汇总相关文件,提交给技术审查委员会做最终决定,适当时更新MDSAP评估程序中的相关内容。
2 见证检查的具体内容
见证检查制定了非常详细的检查内容,主要包含了十个部分,共涉及检查点216项,其中关键检查点33项[9]。具体情况见表1。
3 现场执行情况
3.1 分工
由于检查前评估组得到了检查组的检查计划,评估组进行内部分工,检查期间基本做到每个评估人员全程观察和记录同一个检查人员的相关检查情况。
3.2 观察
见证检查的十部分内容中,第1、2、10三部分是对检查工作的整体评价,第3至9部分的内容与MDSAP规定的检查机构需要进行的检查项目基本一致,两次见证检查期间,检查组基本按照规定的检查项目进行检查,同时与评估组沟通解释相关工作,评估组进行记录,观察与检查进度保持同步。检查过程中评估组成员不得与企业直接接触,也不得干扰检查人员的检查活动。
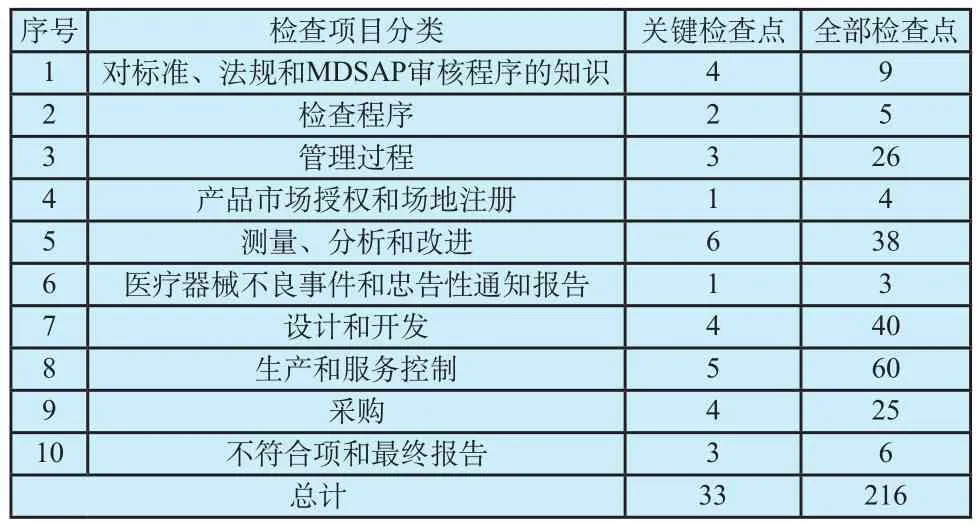
表1 见证检查的检查点汇总表Tab.1 Summarized elements of witnessed audit assessment
3.3 交流
每一天检查组宣布完成当天上午和下午两阶段检查任务后,检查组和评估组会分别进行组内交流讨论,汇总完成的任务及发现的问题情况。完成一天评估任务后,检查组首先要求生产企业人员进行回避,由评估组向检查组告知当天观察结果,听取相关解释并提出建议;沟通结束后检查组通知生产企业人员进场,向其告知当天的检查结果,听取企业意见。
4 见证检查的结果
通过现场观察和审核检查报告[10],评估组确认检查组的检查内容是否涵盖了全部的关键检查点和70%以上的非关键检查点,是否存在不符合项等情况。根据流程撰写和提交见证检查报告、不符合项报告及相关建议。
5 特点及启示
5.1 流程标准化
MDSAP分别制定了两套较为详细和标准的流程:对医疗器械质量管理体系的检查流程和对检查机构检查能力的评估流程。以见证检查为例,MDSAP在该项目下的文件主要有见证检查程序文件、见证检查流程图、检查点详细清单、生产企业相关信息表、见证检查报告模板五个文件,涵盖了从任务启动、执行过程到最终结果的全过程。在程序文件中详细列明了项目各个阶段的目的、负责人、步骤和主要工作内容,在检查清单中利用Execl的逻辑公式对评估员填入的结果进行统计计算,对见证检查报告也详细规定了格式和填写要求,尽量做到检查和评估过程的标准化,减少了自由裁量权和错误率。
5.2 规则透明化
在FDA官网的MDSAP Documents项下可以下载质量管理体系检查和检查机构评估的全部相关文件。体系检查完全按照MDSAP检查流程和构成分项下的相关要求执行,见证检查完全按照MDSAP评估流程和构成分项下见证检查的相关要求执行,生产企业、检查机构及监管机构三方共同遵守相关要求(相关文件的下载地址为:https://www.fda.gov/MedicalDevices/InternationalPrograms/MDSAPPilot/ucm377578.htm)。
5.3 标准国际化
作为MDSAP检查机构评估内容的一部分,见证检查的标准以ISO/IEC 17021-1:2015、IMDRF MDSAP WG/N3(ed2)及IMDRF MDSAP WG/N4三个文件中的相关要求作为基础,其他国家监管机构的相关法规(如美国FDA 21 CFR part 820、巴西RDC n. 16等)作为补充,形成了一套兼容参与MDSAP检查的五个国家关于医疗器械的其他适用要求的国际化标准。
5.4 评估组的关注点
两次见证检查过程中,通过与评估组交流及现场观察,我们发现在现场检查时评估组最关注的是检查机构是否按照相关程序及计划开展检查、检查是否细致、抽样方法是否合理、取证是否完全。评估人员也有个人关注点,一位评估人员与我们交流了四点评估心得:第一是比较关注检查人员是否能从企业产品特点出发寻找关键检查点并贯彻落实,找到相关证据。第二是关注风险控制及与之相关的设计研发、CAPA及不良事件等相关内容,例如管理和设计方面产生问题时在关闭过程中如何验证、设计变更如何处理、抽样验证情况等。第三是鉴于检查内容虽然分为七大部分,但是实际检查中的各项检查点之间的关联性很强,他比较关注检查人员之间的交流是否足够。第四是现场检查时评估人员会随手记录关键仪器编号,观察检查人员在审核设备的控制和维护时是否注意到与相关文件记录对照。
6 结语
由于我国各级检查机构与第三方机构在机构设置、人员构成、能力评估等方面存在较大区别,不宜完全照搬MDSAP中的相关规定和要求,但作为吸收了发达国家医疗器械监管政策和经验的最新成果,MDSAP中关于见证检查方面的内容为监管机构评价各个检查机构的现场检查能力提供了较为完整和可操作性较强的流程和标准,对于加强我国检查机构的能力建设和体系建设,推动我国与发达国家法规、检查标准的统一及检查成果的互认有很强的参考意义。
[1]温晶, 肖江宜, 王爱君. 医疗器械单一审核程序中质量管理体系检查工作的介绍[J]. 中国医疗器械杂志, 2018, 42(1): 53-55.
[2] IMDRF MDSAP Working Group. IMDRF MDSAP WG/N5–Regulatory authority assessment method for the recognition and monitoring of medical device auditing organizations[EB/OL].2013-12-09. https://www.fda.gov/downloads/MedicalDevices/InternationalPrograms/MDSAPPilot/UCM450648.pdf.
[3] IMDRF MDSAP Working Group. IMDRF MDSAP WG/N6–Regulatory authority assessor competence and training requirements[EB/OL]. 2013-12-09. https://www.fda.gov/downloads/MedicalDevices/InternationalPrograms/MDSAPPilot/UCM450649.pdf.
[4] IMDRF MDSAP Working Group. IMDRF MDSAP WG/N8–Guidance for regulatory authority assessors on the method of assessment for MD SAP auditing organizations[EB/OL].2015-10-02. https://www.fda.gov/downloads/MedicalDevices/InternationalPrograms/MDSAPPilot/UCM470218.pdf.
[5] IMDRF MDSAP Working Group. IMDRF MDSAP WG/N11–MDSAP assessment and decision process for the recognition of an auditing organization[EB/OL]. 2014-09-18. https://www.fda.gov/downloads/MedicalDevices/InternationalPrograms/MDSAPPilot/UCM450652.pdf.
[6] IMDRF MDSAP Working Group. IMDRF MDSAP WG/N3(ed2)– Requirements for medical device auditing organizations for regulatory authority recognition[EB/OL]. 2016-03-24. https://www.fda.gov/downloads/MedicalDevices/InternationalPrograms/MDSAPPilot/UCM505689.pdf.
[7] IMDRF MDSAP Working Group. MDSAP AS P0012.002 –MDSAP witnessed audit procedure[EB/OL]. 2016-08-16. https://www.fda.gov/downloads/MedicalDevices/InternationalPrograms/MDSAPPilot/UCM379866.pdf.
[8] IMDRF MDSAP Working Group. MDSAP AS F0012.1.001 –MDSAP witnessed audit fl owchart[EB/OL]. https://www.fda.gov/downloads/MedicalDevices/InternationalPrograms/MDSAPPilot/UCM379867.pdf.
[9] IMDRF MDSAP Working Group. MDSAP AS F0012.4.002 –witnessed audit assessment and performance checklist[EB/OL]. https://www.fda.gov/downloads/MedicalDevices/InternationalPrograms/MDSAPPilot/UCM379870.xlsx.
[10] IMDRF MDSAP Working Group. MDSAP AS F0012.3.003 –witnessed assessment audit report[EB/OL]. 2016-08-15. https://www.fda.gov/downloads/MedicalDevices/InternationalPrograms/MDSAPPilot/UCM379869.docx.

