I 型胶原水凝胶的物质通透性评价
【作 者】段晓杰,刘珊,马跃,孙雪莲,王金恒,邵安良,徐丽明
1 中国食品药品检定研究院,北京市,102629
2 关节动力安达(天津)生物科技有限公司,天津市,300308
3 北京三药科技开发公司,北京市,100176
0 引言
水凝胶(Hydrogel)是以水为分散介质的凝胶,在具有网状交联结构的水溶性高分子中引入一部分疏水基团和亲水残基,亲水残基与水分子结合,将水分子连接在网状内部,而疏水残基遇水膨胀,形成交联聚合物。因此,水凝胶性质柔软,能保持一定的形状,能吸收大量的水。天然的亲水性高分子包括多糖类(淀粉、纤维素、海藻酸、透明质酸,壳聚糖等)和多肽类(胶原、聚L-赖氨酸、聚L-谷胺酸等)。合成的亲水高分子包括醇、丙烯酸及其衍生物类(聚丙烯酸、聚甲基丙烯酸、聚丙烯酰胺、聚N-聚代丙烯酰胺等)[1]。鉴于水凝胶的这一特性,近年来被逐渐应用于组织工程和再生医疗领域[2]。近年来蚕丝蛋白及丝蛋白丝胶的研究较多,单独或者复合其他物质(例如藻酸盐、壳聚糖及胶原)制备成水凝胶,用于细胞、药物缓释的载体或者用于组织工程支架材料等再生医疗[3-6]。
有研究显示一种新型水凝胶生物材料,在软骨修复手术中将其注入骨骼小洞,能帮助刺激病人骨髓产生干细胞,长出新的软骨[7]。有研究用陶瓷和水凝胶研发出一种混合支架材料,用于软骨和骨的同时再生[8]。也有研究制备壳聚糖温敏性水凝胶用于组织工程支架材料[9];或者从猪的半月板制备细胞外基质衍化的水凝胶用于人的半月板修复和再生[10]。
水凝胶的一个很重要的性能,应具有良好的可渗透性,以促进及保持细胞活力、运输营养及废物、释放药物等。其中物质传递性能是指细胞、营养、废物以及生物活性物质进入水凝胶或在水凝胶中扩散的能力。《组织工程医疗器械产品水凝胶表征指南》行业标准[1]中要求,对水凝胶物质传递性能的评估宜在某一尺度范围(如小分子、蛋白质与细胞)进行;宜同时考虑水凝胶的主动运输(例如液体流动)与被动运输(例如扩散)行为;检测宜在能代表产品最终使用情况(例如样品的几何形状、研究时限、生物成分)的条件下进行。然而,目前还没有具体的方法用于评价水凝胶的营养、废物等物质传递性能。
本研究建立了用于评价水凝胶的营养、废物等物质传递性能的方法,能够科学合理地评价水凝胶的物质传递性能,为该类产品的生物性能评价提供技术支持。同时,用所建立的方法科学地评价了用于软骨再生的胶原水凝胶产品的营养、废物等物质传递性能。
1 材料与方法
1.1 材料
1.1.1仪器设备
所用仪器设备包括:恒温摇床(HZQ-X100,豪诚实验仪器制造有限公司);酶标仪(M5,Molecular Devices);低温高速离心机(3k15,Sigma);96孔板震荡器(MX-M,dragon lab);高精度天平(0.000 1 g,FA1104N,菁华电子公司)。
1.1.2主要试剂耗材
涉及主要试剂耗材为:PBS(AB10115027,HyClone);BSA-FITC(20161214,北京索莱宝科技有限公司);Transwell双室装置(3402,costar);黑色酶标板(3603,costar);外用冻干人纤维蛋白粘合剂(简称纤维蛋白胶”,201411SO99,上海莱士血液制品股份有限公司)。
1.1.3试验材料
本研究的样品名为I型胶原蛋白植入基质(CaReS-1S),为乳白色圆柱形凝胶态固体,无肉眼可见的杂物和变色,双层无菌包装,由关节动力安达(天津)生物科技有限公司提供。
I型胶原蛋白植入基质是由组分A(I型胶原蛋白溶液)和组分B(凝胶中性溶液)成比例混合而成。I型胶原蛋白溶液是来自无特定病原CD大鼠鼠尾肌腱的I型胶原蛋白,用酸溶解得到的胶原蛋白溶液。酸性I型胶原蛋白溶液被凝胶中性溶液中和,可以诱导自然纤维重组形成的凝胶态I型胶原蛋白植入基质,泡罩包装,最后以钴60辐照灭菌。
1.2 方法
1.2.1试验方案设计
试验方案设计参考《组织工程医疗器械产品 水凝胶表征指南》行业标准(YY/T 1435ü2016)。为考察胶原水凝胶产品的营养物质及废物的传递能力,本研究选择了双室装置(细胞培养用Transwell)作为实验模型。
根据本研究样品的预期临床使用目的,拟选择模拟关节滑液的微环境研究水凝胶样品的物质传递性能。关节滑液是血浆漏出液,由滑膜表层的B细胞所产生的透明质酸酶蛋白复合体和血浆的漏出液混合而成[11],而血浆中含量最多的蛋白是血清白蛋白,占血浆总蛋白的40%~60%[12]。正常的关节滑液呈粘稠状,其中还含有一些分子量较大的脂类、糖类分子和黏蛋白[13-14]。关节滑液的功能为提供营养、润滑关节面、增加关节活动。另一方面,细胞代谢等途径可能产生胶原蛋白、糖胺多糖、小分子物质(氨类、二氧化碳)等[15]。鉴于此,本研究将选择荧光素标示的牛血清白蛋白(BSA-FITC),组合在磷酸盐缓冲液(PBS)中作为营养与废物的指示物,通过检测该物质透过水凝胶的浓度,用以评价水凝胶的物质传递能力。
实验条件①扩散介质:基础扩散介质为PBS,pH值为7.2。加入易检测浓度的BSA-FITC荧光指示物作为扩散液。②实验温度:35~37 ℃。③静止放置。1.2.2 荧光检测方法学考察
通过预实验确定BSA-FITC合适的检量线最高浓度(荧光度值在易读范围),作为工作液浓度,建立BSA-FITC荧光标准曲线。如:将BSA-FITC配置成工作液浓度为100、50、25、12.5、6.25、3.125、1.563、0.781 μg·mL-1,考察标准曲线的线性、回收率、重复性,灵敏度和最低检测限。
1.2.3实验过程
利用培养小室作为扩散室,把胶原水凝胶放置在小室内,在水凝胶与小室之间用纤维蛋白胶密封,防止扩散介质从边缝渗入下层。在小室内加入含有BSA-FITC荧光标记物的扩散介质(100 μL的PBS, 含100 μg/mL的BSA-FITC),在小室的下层接受室内加入足够的不含BSA-FITC的基础扩散介质(PBS)。在静态条件下,及35~37 ℃放置1 h、3 h、5 h、24 h、28 h后(根据预实验结果,5 h之内渗透较快,5 h之后渗透变得缓慢,24 h已达到100%的渗透率)收集接受室内的扩散介质,用荧光酶标仪检测荧光值,制作标准曲线,将试验样品的检测荧光值代入标准曲线方程,计算BSA-FITC透过量。每组设定3个平行样。
1.2.4结果计算
水凝胶的营养物质透过率(Transparent Rate)表示为:BSA-FITC的透过百分比(TR, %),
TR = (下层扩散介质BSA-FITC浓度h体积/BSA-FITC加入浓度h体积) h100%
计算下层扩散介质中荧光物质浓度,以及所占加入总量的比例,从而评价样品营养与废物的传递能力。
2 结果与分析
2.1 方法学考察结果
2.1.1线性关系考察
BSA-FITC检量线的线性及其定量下限考察结果见表1。三次重复试验的结果显示,在100 μg·mL-1~0.781 μg·mL-1的浓度范围内,其R2均大于0.99,其定量下限 (Lower Limit of Quantity, LLOQ)为3.125 μg·mL-1。
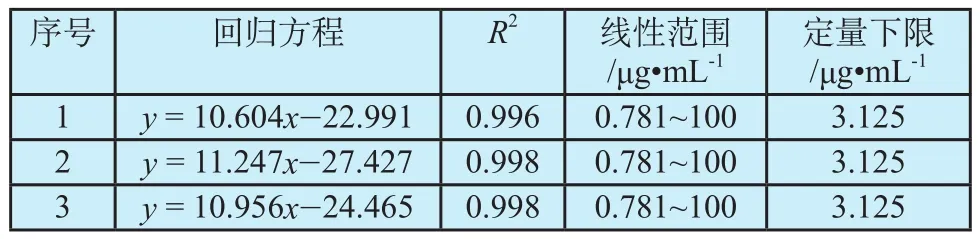
表1 BSA-FITC检量线的线性和定量下限Tab.1 The linearity and LLQQ of BSA-FITC
2.1.2精密度考察
分别配制50、12.5、3.125 μg·mL-1,三个质量浓度(理论值)的标准品工作液各3份,每份做3个复孔,分别进行测定。按随行标准曲线法求得实测浓度(实测值),计算组间精密度。结果如表2所示,高、中、低三个质量浓度平行样本间相对标准偏差(Relative Standard Deviation, RSD)分别为4.57%、2.47%、2.24%。
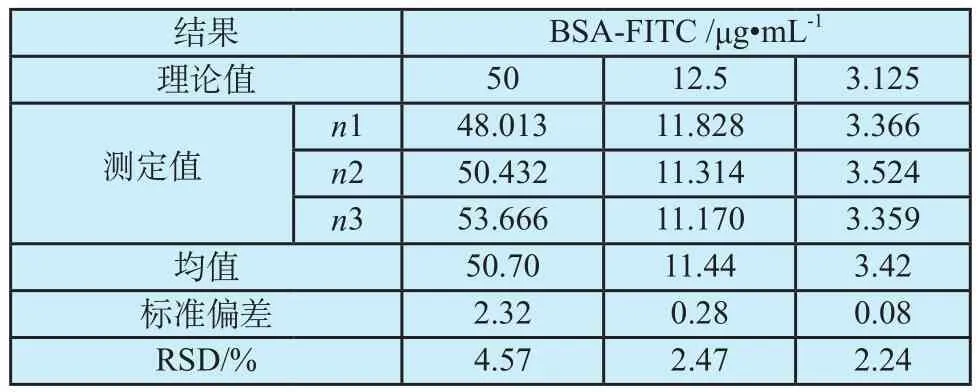
表2 精密度考察结果Tab.2 Results of accuracy evaluation
2.1.3检测回收率考察
平行制备浓度为100、50、25、12.5、6.25、3.125 μg·mL-1BSA-FITC标准品溶液3份,每份3个复孔,计算回收率,如表3所示,回收率均在80%~120%范围内。
2.2 水凝胶的营养物质透过率
2.2.1扩散介质回收及BSA-FITC检测
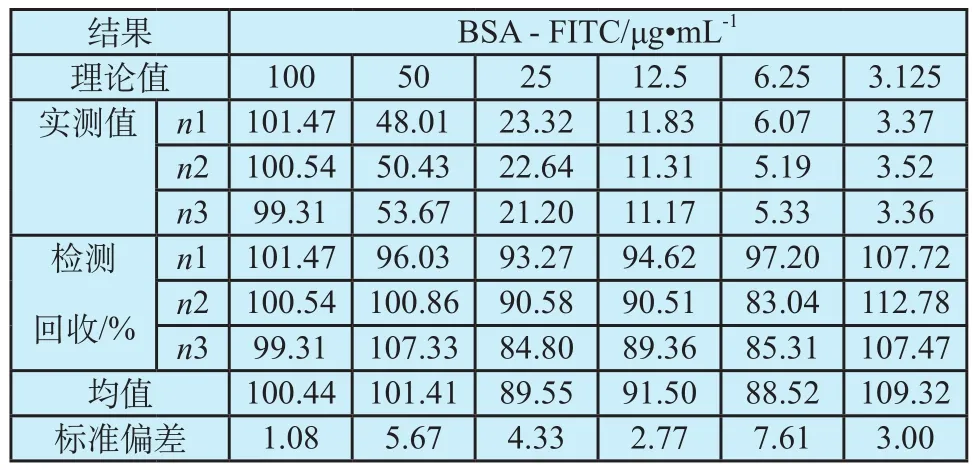
表3 检测回收率考察结果Tab. 3 Results of detection recovery rate evaluation
在设定的时间点回收下层接受室的扩散介质,并用移液枪标定回收扩散介质的体积。同时取置于对照孔中BSA-FITC(50 μg·mL-1)作为标准曲线初始浓度样品,依次倍比稀释6个浓度,以PBS作为背景对照,分别加入到黑色酶标板中,酶标仪设置激发波长为493 nm,发射波长为550 nm,进行检测。
2.2.2水凝胶样品的BSA-FITC透过率
本次试验的检量线(24 h样品检测)见图1。其他时间点的检量线图略。
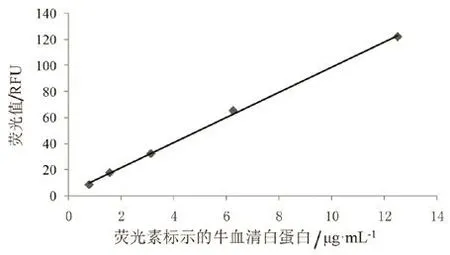
图1 24 h样品的检量线图Fig.1 Standard curve for 24 h sample detection
各时间点样品的检量线方程如下:
1 h样品的检量线方程:y = 9.884x + 2.260, R2= 0.999
3 h样品的检量线方程:y = 8.210x-4.531, R2= 0.996
5 h样品的检量线方程:y= 7.192x + 0.469, R2= 0.999
24 h样品的检量线方程:y = 9.636x + 2.360, R2= 0.998
28 h样品的检量线方程:y = 10.270x-0.606, R2= 0.999
本次实验所用的水凝胶样品为I型胶原蛋白植入基质”,其BSA-FITC透过率检测和计算结果见表4。
在实验中,考虑到荧光的自然衰减,同时设置对照组BSA-FITC(与试验组加入的BSA-FITC量相同,置于Transwell孔中),作为标准曲线初始浓度的样品。由表4 的结果可以看到,在最初的5 h前水凝胶样品的BSA-FITC透过较快,呈现时间依存性,5 h时渗透率达到了约50%。5 h之后的渗透速率减缓。预实验的结果提示24 h的时候水凝胶样品BSA-FITC已经达到了100%的渗透,然而,本次正式实验在24 h渗透率并未达到100%,因此,延长实验时间至28 h,观察到了水凝胶样品BSA-FITC达到了100%的渗透。其中,在所有试验样品组及所有时间点,Transwell中水凝胶样品的上层最初加入的BSA-FITC/PBS均已全部渗透进水凝胶样品中,或者透过了水凝胶样品,说明I型胶原蛋白植入基质水凝胶样品具有很好的吸水性和物质传递性。

表4 水凝胶样品的BSA-FITC透过率Tab. 4 BSA-FITC transparent rate of hydrogel sample
3 小结与讨论
I型胶原蛋白植入基质是一种水凝胶物质,预期用于植入到关节软骨缺损部位,治疗局灶性膝关节软骨缺损。为评价I型胶原蛋白水凝胶物质的物质通透性,本研究建立了以BSA-FITC为指示物,组合PBS作为通透介质的体外物质通透性评价实验方法。该方法在100 μg·mL-1~0.781 μg·mL-1的浓度范围内,其R2大于0.99,其定量下限(LLOQ)为3.125 μg·mL-1;RSD<5%;回收率在80%~120%范围内。利用该方法,结合Transwell的使用,检测I型胶原蛋白植入基质水凝胶样品,结果显示在37 ℃静置状态下28 h后样品的BSA-FITC通透率为100%,显示了较好的物质通透性。
[1] 中国食品药品监督管理总局. YY/T 1435ü2016 组织工程医疗器械产品 水凝胶表征指南[S].
[2]Hacker M C, Nawaz H A. Multi-functional macromers for hydrogel design in biomedical engineering and regenerative medicine[J]. Int J Mol Sci, 2015, 16(11): 27677-27706.
[3]Wang Z, Zhang Y, Zhang J, et al. Exploring natural silk protein sericin for regenerative medicine: an injectable, photoluminescent,cell-adhesive 3D hydrogel[J]. Sci Rep, 2014, 4: 7064.
[4]Zhang Y, Liu J, Huang L, et al. Design and performance of a sericin-alginate interpenetrating network hydrogel for cell and drug delivery[J]. Sci Rep, 2015, 5: 12374.
[5]Wang Z, Wang J, Jin Y, et al. A neuroprotective sericin hydrogel as an effective neuronal cell carrier for the repair of ischemic stroke[J]. ACS Appl Mater Interfaces, 2015, 7(44): 24629-24640.
[6] Khampieng T, Aramwit P, Supaphol P, et al. Silk sericin loaded alginate nanoparticles: Preparation and anti-inflammatory eきcacy[J]. Int J Biol Macromol, 2015, 636-643.
[7] 新型水凝胶生物材料可修复膝盖软骨[N]. 科技日报,2013-01-16.
[8]Seol Y J, Park J Y, Jeong W, et al. Development of hybrid scaあolds using ceramic and hydrogel for articular cartilage tissue regeneration[J]. J Biomed Mater Res A, 2015, 103(4):1404-1413.
[9] Zang S, Dong G, Peng B, et al. A comparison of physicochemical properties of sterilized chitosan hydrogel and its applicability in a canine model of periodontal regeneration[J]. Carbohydr Polym,2014, 113: 240-248.
[10] Wu J, Ding Q, Dutta A, et al. An injectable extracellular matrix derived hydrogel for meniscus repair and regeneration[J]. Acta Biomater, 2015, 16: 49-59.
[11] 黄淦堂. 关节液的检验及临床意义[J]. 国外医学外科学分册,1989, 2: 68-71.
[12] Quinlan G J, Martin G S, Evans T W. Albumin: biochemical properties and therapeutic potential[J]. Hepatology, 2005, 41(6):1211-1219.
[13] Michela S, Sabrina B. Optimization of Cellular analysis of Synovial Fluids by optical microscopy and automated count using the Sysmex XN Body Fluid Mode[J]. Clin Chim Acta, 2016, 462:41-48.
[14] Hermansen P, Freemont T. Synovial fl uid analysis in the diagnosis of joint disease[J]. Diagnostic Histopathol, 2017, 4: 1-10.
[15] 沈强, 臧鸿声, 贾连顺, 等. 软骨细胞植入胶原蛋白重建类软骨组织的体外培养研究[J]. 中华外科杂志, 1994, 32(4): 252-254.

