6-OHDA定向毁损双侧间脑A11核团对SD大鼠行为学的影响
程 静 章正祥★ 陈 强 邵敏峰 周会霞 唐毅华 侯 群
不安腿综合征(RLS)是一种常见的神经系统疾病,其主要表现为休息或安静时下肢感觉不适,夜间尤其剧烈,需要或强迫性活动下肢以缓解症状[1]。睡眠期间周期性腿部运动(PLMS)是RLS中最重要的客观发现[2]。既往研究发现当间脑多巴胺神经元受损时能够导致RLS感觉症状的发生。目前国内外尚无理想的大鼠RLS动物模型。而本研究目的在于通过观察6-羚基多巴胺(6-OHDA)毁损SD大鼠双侧间脑 A11核团对大鼠行为学的影响,并评价使用该方法建立 RLS动物模型的可行性。
1 材料和方法
1.1 材料 SPF级SD雄性大鼠21只,体重150g,购自上海西普尔-必凯实验动物有限公司,许可证号SCXK(沪)2013-0016。6-OHDA H116(美国Sigma-Aldrich公司),L-抗坏血酸A5960(美国Sigma-Aldrich公司),小鼠抗大鼠TH单克隆抗体T1299(美国Sigma-Aldrich公司,山羊抗小鼠 IgG/HRP 聚合物PV-6002(北京中杉金桥生物技术有限公司)。脑立体定位仪ALC-H(上海奥尔科特生物科技有限公司),微量注射泵ALC-IP 600(上海奥尔科特生物科技有限公司)。10μl微量进样器(针头锥形,针尖外径0.5mm,针长51mm,上海高鸽工贸有限公司),高清摄像机HC-V210M(日本松下电器产业株式会社),冰冻切片机HM 550(德国美康仪器设备有限公司),显微成像系统DS-U2(日本尼康公司)等。
1.2 下丘脑毁损手术 21只SD雄性大鼠经过20d适应性饲养后,根据体重将所有动物完全随机分成三组,分别为空白组3只,假手术组9只,毁损组9只。用1%的戊巴比妥(6ml/kg)麻醉后,开始进行间脑A11毁损手术。调整微量进样器距针尖8.0mm段与定位仪平面垂直,并用75%酒精消毒,固定于脑立体定位仪上。头部消毒后,切开头皮和筋膜,钝性剥离骨膜,暴露前囟和人字点,通过调整门齿杆到耳杆下(4.5±1.0)mm来达到颅平位(前囟与人字点水平高度相差0.1mm以下),对两侧A11进行定位钻孔(前囟尾侧3.0mm,腹侧8.0mm,矢状缝旁开0.5mm)[3]。微量注射器以2mm/min的速度进针,进至目标深度后停留5min,再以1μl/min的速度缓慢给药,毁损组注射4μl 0.2%6-OHDA(含0.1%维生素C),假手术组注射4μl 0.1%维生素C生理盐水,停留10min,接着以2mm/min的速度退针,最后用碘伏消毒并缝合伤口。空白组不进行任何处理。
1.3 行为学观察及评价 术后第8天将大鼠放入测试笼中,从9:00~9:30am开始用高清摄像机录制6h视频。统计3h站立、爬笼、入睡次数及总时间[4]。(1)站立:用双后肢站立,双前肢无任何支撑,但并不代表身体和箱底垂直,身体完全伸展和不完全伸展均为站立,爬笼后双肢均抬离桶壁后重新记作站立。站立时间:开始站立至任一前肢接触箱体的时间。(2)爬笼:保持直立的姿势靠在箱壁上,包括单个前肢和双前肢接触箱壁,直立后单肢或双肢触及桶壁后重新记作爬笼。爬笼时间:开始爬笼至双前肢均离开箱壁的时间。(3)睡眠:闭目并且俯卧着,全身(包括头部、鼻毛等)保持不动≥30s。睡眠时间:开始入睡至清醒的时间。1.4 取材 各组大鼠在视频录制结束后予1%戊巴比妥钠(5ml/kg)麻醉,取腹主动脉血5ml,离心取血清2ml于-20℃储存备用,将动物仰卧位固定,开胸用灌流针行左心室穿刺,至升主动脉,剪开右心耳,先快速灌注生理盐水200~300ml,至右心耳流出澄清液体,然后灌注4%多聚甲醛磷酸缓冲液200~300ml,先快后慢灌注,至上肢、颈部僵直,即固定完成,灌注后取大鼠脑组织,在4℃的4%多聚甲醛磷酸缓冲液中再固定12~24h,然后用4℃30%蔗糖-PBS液脱水72h,擦干表面液体,铝箔纸包裹,于液氮中速冻10~15s左右,存于-80℃冰箱。
1.5 免疫组化 根据《大鼠脑立体定位图谱》(第6版)对下丘脑A11进行定位。在-20℃的恒温箱中连续切片,厚度为30μm,每只大鼠取26~28张进行染色,染色方法为漂片染色法。所有A11切片在同一物镜(×4)下用显微成像系统进行照片采集。剔除只含黑质、A13等部位的切片,最终每只大鼠取12张切片,人工计数A11部位酪氨酸羟化酶(TH)多巴胺神经元的数目,并分左右进行统计。A11多巴胺能神经元呈三角形或多极状,有较长的突起[5]。
1.6 统计学方法 采用SPSS 22.0统计软件。正态计量资料以(x±s)表示,非正态计量资料以中位数(四分位间距)表示。正态性检验采用Shapiro-Wilk检验法;若数据符合正态分布,方差齐,≥3组采用单因素方差分析,若方差不齐,采用Games-Howell检验,组间比较采用SNK法;两组采用独立样本t检验。方差不齐者,≥3组采用非参数检验的Kruskal-Wallis法,其中两两比较采用所有成对比较法;两组组间比较采用非参数检验的Mann-Whitney U检验,精确方法。各组资料均以α=0.05为显著性水平。
2 结果
2.1 间脑A11 TH免疫组化结果 TH是多巴胺(DA)合成的限速酶,是神经系统多巴胺能神经元的蛋白标志,注射6-OHDA会导致多巴胺能神经元的死亡。TH表达于胞浆内,呈棕黄色,A11多巴胺神经元的胞体和突起均有表达,模型组双侧A11经过6-OHDA注射后,TH表达明显减少。A11从下丘脑背侧区(DA)的后端延伸至导水管周围灰质的最前端,其嘴侧主要位于乳头体丘脑束(mt)的内侧,是TH阳性细胞分布最为密集的区域,越靠近尾侧,TH表达越少。人工计数法统计A11部位TH阳性表达的神经元数量,每个样本统计12张,见表1。毁损组左侧A11 TH阳性细胞总共有(114±23)个,明显低于假手术组左侧(150±22)个和正常组左侧(169±14)个,差异均有统计学意义(P<0.05)。毁损组右侧A11 TH阳性细胞共有(102±20)个,明显低于假手术组右侧(147±22)个和空白组右侧(155±21)个,差异均有统计学意义(P<0.05)。假手术组左侧TH阳性表达数与正常组左侧相比差异无统计学意义(P>0.05)。假手术组右侧A11 TH阳性表达数与空白组右侧相比差异无统计学意义(P>0.05)。单侧A11多巴胺神经元数量=12张切片同侧A11多巴胺神经元数量之和,毁损率=1-单侧A11多巴胺神经元数量/空白组同侧A11多巴胺神经元数量的均值,统计得到毁损组与假手术组毁损率见表2。毁损组左侧毁损率有(32.28%±13.87)%,明显高于假手术组左侧(11.07%±13.04)%,差异有统计学意义(P<0.01),毁损组右侧毁损率有(33.76%±12.92)%,明显高于假手术组右侧(4.89%±14.09)%,差异有统计学意义(P<0.01)。见图 1~3。
表1 间脑A11双侧毁损TH阳性细胞表达比较[个,(±s)]
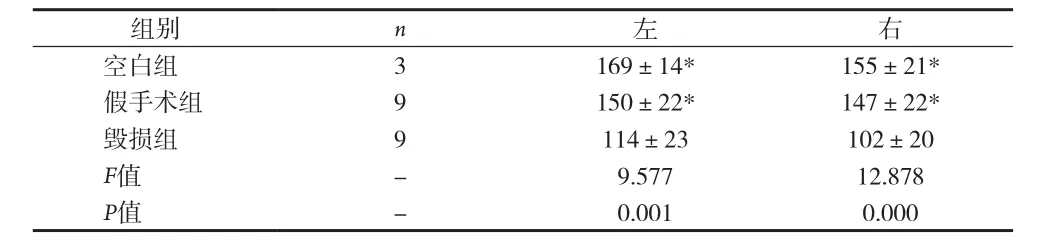
表1 间脑A11双侧毁损TH阳性细胞表达比较[个,(±s)]
注:与毁损组比较,*P<0.05
组别 n 左 右空白组 3 169±14* 155±21*假手术组 9 150±22* 147±22*毁损组 9 114±23 102±20 F值 - 9.577 12.878 P值 - 0.001 0.000
表2 间脑A11双侧毁损TH毁损率比较[%,(±s)]
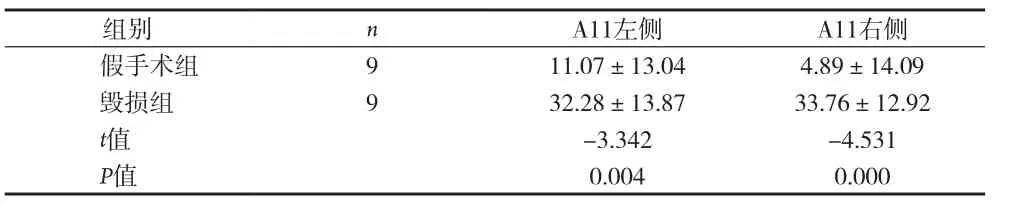
表2 间脑A11双侧毁损TH毁损率比较[%,(±s)]
组别 n A11左侧 A11右侧假手术组 9 11.07±13.04 4.89±14.09毁损组 9 32.28±13.87 33.76±12.92 t值 -3.342 -4.531 P值 0.004 0.000
2.3 行为表现观察结果 术后第8天,将大鼠放入桶中,用高清摄像机录制6h视频。记录下3h的爬笼、站立及睡眠出现的次数及每次持续的时间,并统计前3h爬笼、站立、睡眠次数及总时间。分析后发现3h内各个行为次数及总时间均无明显差异。见表3。
表3 间脑A11双侧毁损行为学变化组间比较[(±s,M(Q)]
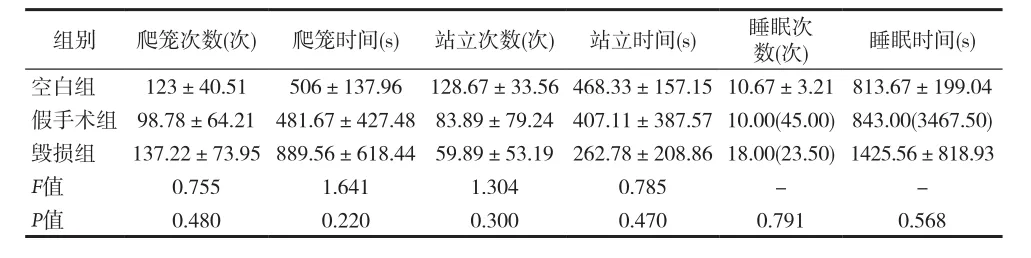
表3 间脑A11双侧毁损行为学变化组间比较[(±s,M(Q)]
组别 爬笼次数(次) 爬笼时间(s) 站立次数(次) 站立时间(s) 睡眠次数(次) 睡眠时间(s)空白组 123±40.51 506±137.96 128.67±33.56 468.33±157.15 10.67±3.21 813.67±199.04组 98.78±64.21 481.67±427.48 83.89±79.24 407.11±387.57 10.00(45.00)843.00(3467.50) 137.22±73.95 889.56±618.44 59.89±53.19 262.78±208.86 18.00(23.50)1425.56±818.93 0.755 1.641 1.304 0.785 - -0.480 0.220 0.300 0.470 0.791 0.568
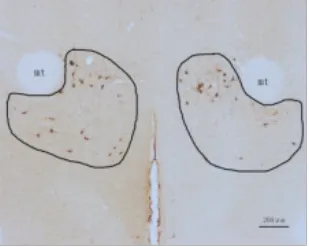
图1-1 正常组A11(物镜×4)

图1-2 正常组A11左侧(物镜×10)
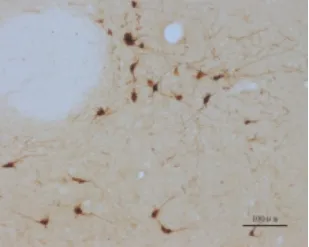
图1-3 正常组A11右侧(物镜×10)
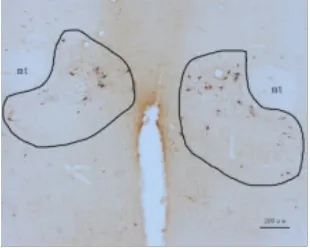
图2-1 假手术组A11(物镜×4)

图2-2 假手术组A11左侧(物镜×10)

图2-3 假手术组A11右侧(物镜×10)

图3-1 毁损组A11(物镜×4)
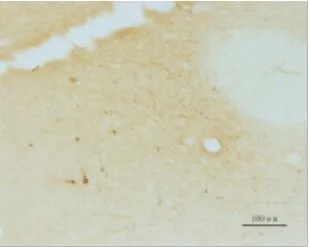
图3-2 毁损组A11左侧(物镜×10)
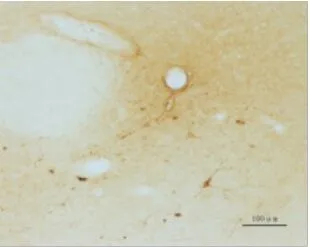
图3-3 毁损组A11右侧(物镜×10)
3 讨论
长期临床观察研究显示RLS患者无帕金森样症状,但在长期应用多巴胺能药物治疗期间,帕金森患者RLS的累积发病率出现下降[6],说明RLS的发生与多巴胺有关。间脑A11核团是脊髓多巴胺唯一来源,因此推测RLS的发生与间脑A11的受累与多巴胺的减少密切相关。
本研究在Ondo等[4]研究的基础上,增加样本量,对大鼠双侧间脑A11核团进行立体定向毁损,并进一步细化行为学评价标准,采用统计站立、爬笼、睡眠次数和时间评价其行为学,免疫组化结果显示A11毁损组TH毁损率明显高于假手术组,说明间脑A11毁损成功。行为学结果显示模型组总的爬笼次数、爬笼时间有增多,但并无显著的统计学差异。
以往6-OHDA毁损间脑A11相关研究显示,对A11毁损模型尚未形成统一的行为学评价标准,难以客观评价大鼠的感觉异常。本实验结果可能由于行为学评估标准中某些指标并不能反映大鼠的感觉异常,行为学评价标准有待进一步改善和细化,例如将爬笼行为细分为单肢爬笼和双肢爬笼,站立行为细分为身体完全伸展并垂直于箱底的站立(直立)和身体不完全伸展的站立。在观察大鼠行为学过程中发现,大鼠睡眠中可出现身体摆动,而RLS常可表现睡眠中周期性肢体动作,观察指标中加入不动行为(即在睡眠中≥2s四肢及全身保持完全不动的次数及时间),可评估这一临床表现。另外,在行为观测过程中将大鼠放入透明玻璃箱中,利用镜面反射拍摄箱底,则能观察大鼠在睡眠过程中的肢体活动,更能反映PLMS患者在休息时腿部的异常感觉。为了完善本研究,建议今后的实验还可使用仪器监测24h运动活性、肌电图、脑电图评价生理指标,更加客观地评价大鼠的感觉异常。因此,6-OHDA定向毁损SD大鼠双侧间脑A11,是否能作为RLS动物模型还需要进一步实验。
[1] 林晓东, 赵丽. 不安腿综合征研究进展. 河北医药, 2011, 33(2):263-265.
[2] Ferri R, Koo BB, Picchietti DL, et al. Periodic leg movements during sleep: phenotype, neurophysiology, and clinical significance.Sleep medicine, 2017, 31: 29-38.
[3] G Paxinos, C Watson. The Rat Brain in Stereotaxic Coordinates,6th edition. San Diego: Academic Press, 2007, 3(2): 6.
[4] Ondo WG, He Y, Rajasekaran S, et al. Clinical correlates of 6-hydroxydopamine injections into A11 dopaminergic neurons in rats: a possible model for restless legs syndrome. Movement disorders: official journal of the Movement Disorder Society, 2000,15(1): 154-158.
[5] Qu S, Ondo WG, Zhang X, et al. Projections of diencephalic dopamine neurons into the spinal cord in mice. Experimental Brain Research, 2006, 168(1): 152-156.
[6] Marchesi E, Negrotti A, Angelini M, et al. A prospective study of the cumulative incidence and course of restless legs syndrome in de novo patients with Parkinson's disease during chronic dopaminergic therapy. Journal of neurology, 2016, 263(3): 441-447.

