基于肿瘤全域的常规MRI参数直方图分析对弥漫大B淋巴瘤与胶质母细胞瘤的鉴别
韩 亮,苗延巍,董俊伊,李晓欣,刘杨颖秋,田诗云,王微微,郭 妍,宋清伟,刘爱连
(1.大连医科大学附属第一医院,辽宁 大连 116011;2.通用电气药业,辽宁 沈阳 110000)
颅内弥漫大B淋巴瘤(Large B cell lymphoma,LYM)和胶质母细胞瘤(Glioblastoma,GBM)两种恶性肿瘤严重威胁着人类的健康,两者在治疗方案上具有明显不同,LYM主要以放疗和化疗为主,而GBM则以手术切除为主,术后辅以放化疗,因此为避免不必要的损失与伤害,术前做出准确的影像学诊断对病人临床治疗及改善预后有重要的价值。
一般而言,在MRI上,LYM与GBM表现典型时,依据病变发生部位、形态、信号、强化方式等影像学表现,可以较好的在术前区别二者。但是,当GBM表现不典型时,两者的鉴别比较困难,仅仅基于影像的视觉分析难以达到满意的结果。
直方图分析是一种基于像素分布的图像分析方法,属于纹理分析的一种,通过多种参数反映图像像素灰度值变化规律及其分布模式,如偏度、峰度等,通过提取出这些图像特征的参数,从多方面反映肿瘤的异质性[1],能够分析获得更多肉眼无法观察的信息,从而更加敏感地反映机体组织的细微变化,获得对临床疾病诊断、治疗有用的定量信息,其在肿瘤诊断及预后中有很大的优势。Murayama等[2]研究表明MR动态磁敏感和动态对比增强直方图分析鉴别LYM与GBM有一定价值。但是,目前基于常规MRI序列的直方图分析鉴别这两种病变的相关报道较少。 因此,本研究基于 MRI T1WI、T2WI、T1WI增强图像,采用直方图分析LYM与GBM,通过对两种肿瘤纹理的分析来提高二者的鉴别。
1 材料与方法
1.1 研究对象
在大连医科大学附属第一医院医学影像存储与传输系统(Picture archiving and communication systems,PACS)上选择2010年1月—2017年3月进行术前MRI扫描,并经手术后病理证实的LYM及GBM患者共36例,术后组织学诊断依据WHO 2007版标准。LYM 16例,其中男9例,女7例,年龄41~83 岁,平均(57.9±10.1)岁。 GBM 20 例,其中男 10例,女 10 例,年龄 30~81 岁,平均(57.8±11.8)岁。
1.2 数据采集
本研究采用美国GE Signa HDxt 1.5T MRI扫描仪,患者取仰卧位,采用标准头线圈。扫描序列如下:快速自旋回波序列(FSE)T1WI轴位、快速自旋回波序列 (FSE)T2WI轴位、T2液体衰减反转恢复序列(T2FLAIR),最后行T1WI增强扫描,依次采用三维结构像扫描(3D BRAVO)及FSE T1WI轴位,增强扫描采用钆喷替酸葡甲胺(Gd-DTPA),经肘静脉注射,剂量为 0.1 mmol/kg 体质量,注射流速 3.0 mL/s。具体扫描参数见表1。

表1 MR扫描序列及参数
1.3 图像处理
将 T1WI、T2WI、T1WI增强图像的 DICOM 格式数据拷贝至个人电脑,导入Omni-Kinetics软件得到相应的信号强度图进行后处理。由两名放射科医师在不知道病理及分组的情况下分别在T1WI、T2WI、T1WI增强图像的每层图像上沿肿瘤的边缘手动描绘感兴趣区(Region of interest,ROI),包括全部肿瘤实质部分,不避开囊变、坏死、出血区域,保证3个信号图像的ROI范围一致(图1)。将所有层面的ROI累加为一个3D ROI,软件将分别自动计算出相应强度直方图。记录肿瘤全域的直方图参数,包括最小值、最大值、平均值、标准偏差、方差、平均偏差、相对偏差、偏度、峰度、均匀性、能量值、熵值、第10百分位数、第25百分位数、第50百分位数、第75百分位数、第90百分位数。

图1 图1a为肿瘤T2WI原始图,图1b为利用Omni-Kinetics软件在T2WI图像上描绘出肿瘤的ROI,图1c为在T2WI图像上各层面叠加计算出的肿瘤的3D ROI图像(红色)。Figure1.Figure 1a is the originalT2WImap ofthe tumor.Figure 1b is a ROI of the tumor that uses Omni-Kinetics software to depict on a T2WI map.Figure 1c is the 3D ROI image of tumor(red area)that is calculated to superimpose at all levels in the T2WI map.
应用社会科学统计软件包 (Statistics package for social science,SPSS)22.0 版进行数据分析。 测量者间的一致性评估采用组内相关系数 (Intra-class correlation coefficients,ICC)。当数据符合正态分布且方差齐性时,以“均数±标准差”表示,应用两独立样本t检验,不符合正态分布者以“中位数±四分位间距”表示,采用Mann-Whitney U检验。对于有统计学意义的直方图参数,利用受试者操作特性曲线(Receiver operating characteristic curve,ROC)来确定各直方图参数对于鉴别诊断LYM与GBM的效能。选取3种信号中曲线下面积 (Area under the curve,AUC)最大的参数,应用Logistic回归分析模型将这些参数融合为联合变量(Joint variable,JV),并利用ROC曲线来确定对二者的诊断能力。所有统计学分析均以P<0.05为差异有统计学意义。
2 结果
2.1 T1WI、T2WI、T1WI增强直方图参数比较
LYM与GBM的病例及直方图见图2,3,二者T1WI增强、T1WI、T2WI直方图参数比较结果见表2~4。
两名测量者间LYM与GBM的各参数的ICC值均大于0.8。根据文献,ICC值大于0.7具有可信性[3-4]。故两名测量者间具有较好的一致性。与GBM相比,T1WI增强信号强度直方图参数中LYM最小值(P=0.014)、均匀性(P=0.037)高于 GBM,LYM 峰度值(P=0.039)低于 GBM。LYM 偏度值为负值,GBM偏度值为正值,且具有显著差异性(P=0.001)。T1WI信号强度直方图参数中LYM标准偏差 (P=0.003)、方差(P=0.003)均低于 GBM,LYM 均匀性(P=0.007)高于 GBM(P=0.007)。 T2WI信号强度直方图参数中的 LYM 标准偏差(P=0.042)、方差(P=0.042)均低于GBM,LYM 均匀性(P=0.007)高于GBM。LYM 3 种信号直方图曲线体素均分布较集中,曲线形态较为高尖,而GBM 3种信号直方图曲线体素均分布较为分散,曲线形态较为平缓。

表2 LYM与GBM T1WI增强信号直方图参数

表3 LYM与GBM T1WI信号直方图参数
2.2 直方图参数的ROC曲线分析
利用ROC曲线诊断结果,T1WI增强信号中以偏度0.007 8为阈值时AUC最大,对二者诊断能力最佳 (AUC=0.819),敏感性及特异性分别为 65%、87.5%。 T1WI信号中以标准偏差 78.02、方差 6 087.64为阈值时鉴别LYM与GBM的AUC最大,诊断能力最佳 (AUC=0.787、0.787), 敏感性及特异性分别为75%、81.2%。 T2WI信号中以标准偏差 452.68、方差204 937为阈值时鉴别二者的AUC最大,诊断能力最佳 (AUC=0.70、0.70), 敏感性及特异性分别为55%、81.2%。应用Logistic回归分析模型将AUC最大的3个参数 (T1WI增强偏度值、T1WI标准偏差、T2WI标准偏差)融合为JV。JV以0.55为阈值时鉴别二者的 AUC最大(AUC=0.881),敏感性及特异性分别为 80%、87.5%(图4,表5)。

表4 LYM与GBM T2WI信号直方图参数
3 讨论
LYM和GBM在影像表现上各有特点,但部分GBM表现不典型,T2WI信号表现为较均匀的等或稍高信号,坏死囊变少或无,肿瘤实质信号较均匀,与LYM影像表现类似,容易造成误诊,此时应用一些新方法去鉴别二者是很有必要的。既往研究报道磁共振弥散加权成像、磁共振灌注成像、磁共振动态磁敏感对比增强成像对LYM与高级别GBM有一定的鉴别价值[2,5-7],但扫描过程中存在运动伪影及磁敏感伪影,有一定的局限性[8-9]。而基于像素分布的直方图分析是一种分析参数映射的新技术,通过计算整个组织内部信号值,并分别以MR信号值以及相同信号范围内像素值为X轴和Y轴,可用来测量ROI的平均信号值、像素数及像素数信号变化范围,提供定量的肿瘤异质性信息[10-11]。此外,以前的研究大多使用局部画ROI的方法,将ROI放在肿瘤有代表性的部分,这样会存在主观倾向的抽样偏差[12-13]。本研究的测量区域包括了肿瘤全域,不避开坏死囊变区、出血灶以及肿瘤内血管结构,这将提供更多的肿瘤异质性的信息,可以潜在地消除数据处理过程中的采样偏倚[14-16]。
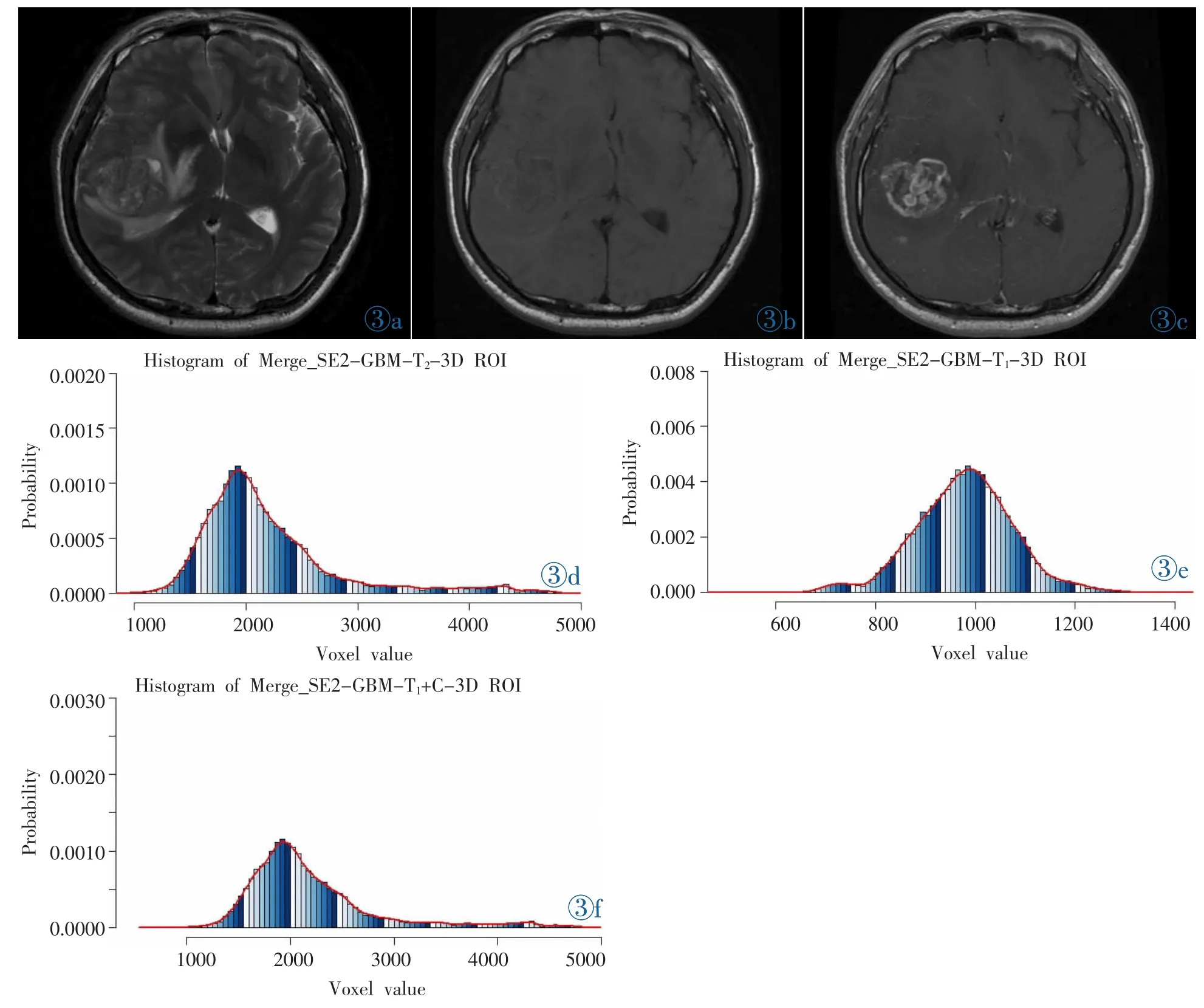
图3 男,48岁,右侧颞叶 GBM(WHO Ⅳ级)。 图3a~3c:分别为T2WI、T1WI、T1WI增强图像,病灶在T1WI上表现为稍低信号,在T2WI上为等高混杂信号,增强扫描病灶明显强化,强化不均匀。图3d~3f:分别为 T2WI、T1WI、T1WI增强信号的直方图,直方图体素对比LYM直方图分布更为分散,T1WI直方图标准差、方差分别为91.49、8 369.85。 T2WI直方图标准差、方差分别为 597.25、356 706。T1WI增强直方图数值主要分布在右侧,体素分布分散,直方图曲线相对LYM曲线表现平缓,偏度值及峰度值分别为1.04、3.61。Figure 3.A 48-year-old male with GBM in the right temporal lobe.Figure 3a~3c are T2WI,T1WI and enhanced T1WI images respectively.The lesion is of low signal intensity on T1WI,mixed equal and high signal intensity on T2WI.The lesion shows intense but inhomogeneous enhancement following contrast administration.Figure 3d~3f are histograms of T2WI,T1WI and enhanced T1WI imaging respectively.The voxel of the histogram of glioblastoma is distributed more disperse than the LYM histogram.The standard deviation and variance of T2WI signal are 597.25 and 356 706.The standard deviation and variance of T1WI signal are 91.49 and 8 369.85.The histogram of T1WI enhancement is distributed on the right,and voxel distribution is dispersed.The histogram curve of GBM is gentler than the LYM curve.The skewness and kurtosis are 1.04 and 3.61,respectively.

表5 T1WI、T2WI、T1WI增强信号强度直方图参数对LYM与GBM鉴别诊断的效能

图4 联合变量-ROC曲线示JV值、T1WI增强信号直方图偏度值、T1WI和 T2WI标准偏差 AUC 分别为 0.881、0.819、0.787、0.70。Figure 4.The joint variable-ROC curve shows that the AUC of JV value,skewness of contrasted T1WI signal histogram,standard deviation of T1WI and T2WI signal are 0.881,0.819,0.787,0.70,respectively.
目前应用直方图鉴别LYM与GBM的研究较少,Kunimatsu等[17]探讨了GBM与原发性中枢神经系统LYM之间基于T1WI增强磁共振图像的纹理特征的差异,研究得出熵、中位数、灰度游程矩阵、非均匀性和运行率有助于鉴别诊断两种肿瘤。Murayama等[2]利用基于动态磁化率对比与动态增强磁共振成像的直方图分析鉴别LYM与高级别GBM,血管微环境的直方图分析可用于中枢神经系统淋巴瘤(CNSL)和高级别GBM之间的定量鉴别分析。
本研究发现,基于常规T1WI增强的两种肿瘤实质强化部分的峰度值和偏度值存在显著差异。偏度和峰度是描述直方图曲线分布的参数,可以较好的反应肿瘤的异质性[12,16,18]。偏度是指图像直方分布的不对称程度,负值说明左偏,分布不对称趋向于较小值,更多的体素集中在低值区;而向右偏移表明分布不对称趋向于较大值。负偏度绝对值越大,分布形态越偏离正态分布。本研究中,LYM偏度值偏向于负值,而GBM偏度值偏向于正值,LYM偏度的绝对值略大于GBM,笔者认为LYM的强化程度低于GBM的强化程度,所以LYM的体素值分布于低值区。峰度反映的是图像灰度分布在接近均值时的大致状态,用以判断图像的灰度分布是否非常集中于平均灰度附近,峰态越小,表示越集中,反之表示越分散。本研究中GBM峰度高于LYM,曲线体素分布分散,表明其灰度分布不均匀,而LYM峰态低,体素分布集中,灰度分布相对均匀,强化相对均匀。由于GBM的强化机制是肿瘤本身新生血管多,且肿瘤间质内的血管内皮细胞和血管平滑肌细胞明显增生,血管灌注量增加,所以强化明显,相对应其偏度值高,而且GBM生长速度快,内部容易发生囊变、坏死、出血等,增强扫描多不均匀,所以其峰度相对高。而LYM是乏血供肿瘤,肿瘤细胞的浸润导致血管内皮受损,继而破坏了血-脑脊液屏障,增强扫描时对比剂由血管内渗透到组织的细胞外间隙,导致病变组织明显、均匀强化[19],所以其偏度、峰度值相对低。偏度值与肿瘤的恶性程度和预后评估有一定的关联性。Meyer等[20]做了利用常规MRI序列直方图参数预测原发性CNSL的组织病理学特征的研究,结果发现T1WI直方图参数中偏度值与Ki-67显著相关,而Ki-67是一种用于临床评价多种肿瘤增殖潜能的标志物[21],关于LYM,Ki-67的表达与总生存率之间有很强的关联性[22],说明偏度值与肿瘤预后相关。GBM的最小值低于LYM,且存在显著差异,这可能与GBM分化程度不一,强化程度不同,从低级别至高级别都有分布有关,所以强化最弱的区域弱于LYM。而T1WI增强信号中以偏度0.007 8为阈值时AUC最大,诊断能力最佳,其敏感性及特异性分别为65%、87.5%。
标准差、方差是用于评价数据离散程度的参数[23]。本研究中T1WI、T2WI信号的标准偏差与方差存在显著差异,GBM的标准偏差、方差均高于LYM,随着标准差的增大,大部分数据偏离平均值,表示病变不均匀。由于GBM的成分复杂、不均匀,而LYM细胞大小较一致、胞质和水分少、核大及染色质颗粒粗、网状纤维结构丰富[24],所以其内钙化、出血及囊变十分少见,故实质部分较均匀,因此GBM标准差及方差高。均匀性反映的是肿瘤ROI内的异质性程度,数值越大,表明ROI内灰阶强度值分布越均匀,或者说数值范围越小,异质性程度越小,本研究结果表明T1WI、T2WI、T1WI增强3种信号强度的直方图中LYM的均匀性均大于高级别GBM,说明LYM的灰阶数值范围小,而GBM的范围相对大,GBM的异质性相对于LYM更明显,提示瘤内存在更多的出血、囊变或坏死,这与LYM和GBM的病理以及生物学特性相符合。目前,孙振国等[25]用纹理分析鉴别原发性脑LYM与高级别GBM,其熵值、异质性参数结合常规MRI平扫和增强表现,对鉴别原发性脑LYM与高级别GBM具有一定的临床应用价值。本研究为鉴别两种肿瘤提供了更多的参数。利用联合T1WI增强偏度值、T1WI标准偏差、T2WI标准偏差得到的JV,鉴别两种肿瘤的ROC曲线的AUC均大于任何单一T1WI、T2WI、T1WI增强直方图参数,诊断效能较好,AUC为0.881,敏感性及特异性分别为80%、87.5%,表明联合应用3种信号的直方图参数有更佳的诊断效能。
本研究存在一定的局限性,首先由于中枢神经系统LYM相对少见,本研究样本量相对较少。第二,本研究没有包括病灶的水肿区域,GBM不论级别均属浸润性生长的肿瘤,GBM细胞与白质纤维高度的亲和性在肿瘤生物学行为上表现为肿瘤沿白质纤维的扩散[26],故在瘤周水肿及水肿外区域组织结构的改变不仅是水肿,同时存在肿瘤细胞的浸润[27],虽然GBM属浸润性生长肿瘤,但以浸润血管为主,对血脑屏障造成破坏为其主要改变,其对周围白质纤维以推移改变为主,浸润较少,周围水肿为不同程度的血管源性水肿[28],瘤周水肿可能对两种肿瘤的鉴别有一定价值,以后可以进一步深入研究。第三,本研究属于回顾性研究,术后组织学诊断依据2007年WHO标准,而2016年WHO已经发布了新的中枢神经系统分类简述[29],增加了分子学分型,在今后的研究中需要更多分子学特征来进行进一步研究。
基于肿瘤全域ROI T1WI、T2WI及T1WI增强信号强度直方图可以为LYM与GBM之间的鉴别提供更多信息,T1WI增强信号中偏度、均匀性以及T1WI、T2WI信号中标准偏差、方差具有良好的诊断价值,联合应用T1WI增强、T1WI、T2WI直方图参数可提高对二者的鉴别诊断能力。

