星油藤根腐病的症状和病原鉴定
魏玉倩 唐 婕 普晓兰 伍建榕 童亚丽 杨植芳
(1. 西南林业大学国家林业局西南地区生物多样性保育重点实验室,云南 昆明 650224;2. 西南林业大学林学院,云南省高校森林灾害预警控制重点实验室,云南 昆明 650224;3. 云南云投生态环境科技股份有限公司,云南 昆明 650217;4. 西双版纳印奇生物资源开发有限公司,云南 西双版纳 666100)
星油藤(Plukenetiavolubilis)也称印奇果,南美油藤,大戟科多年生藤本植物,原产南美洲安第斯山脉地区热带雨林[1]。2006年从秘鲁引入,交中国科学院西双版纳热带植物园试种。2008年试种成功,并在西双版纳、红河、临沧等地推广种植。截至2015年末,印奇果公司已在西双版纳普文镇建成了80 hm2印奇美藤果良种繁育及试验基地。境内印其美藤果推广种植650余hm2,境外老挝、越南、泰国已完成合作推广种植印其果种植4 000余hm2。2015年初,种植人员在星油藤种植产区发现多年生星油藤植株大量死亡,症状起初表现为植株上部分叶片由绿变黄,悬挂在树枝上,经仔细观察发现,星油藤根基部及根部腐烂。后期,植株整株干枯死亡。大田种植中根腐病发生严重,常出现星油藤根茎腐烂和植株死亡,发生面积广,造成损失较为严重,病死株率达到50%~70%,个别种植园甚至达80%。但无论是原产地还是其他种植产区,关于星油藤根腐病的病原菌的研究均较少。为明确星油藤根腐病的致病菌种类,采用组织分离法、单孢分离法对病原菌进行分离,依据形态学特征和柯赫氏法则、分子生物学鉴定方法对星油藤根腐病的病原进行系统研究,为星油藤根腐病的有效防治提供参考。
1 材料与方法
1.1 材料来源与试剂
1) 样本采集及病原菌获得。2016年3月—2017年3月分别在西双版纳星油藤种植基地,4次采集星油藤根腐病发病植株,保湿培养带回实验室,取病根部病健交界部分进行分离纯化。
2) 培养基及试剂。供试培养基为马铃薯琼脂固体培养基 (PDA):马铃薯200 g,葡萄糖20 g,琼脂15~20 g,蒸馏水1 000 mL,pH自然。真菌DNA抽提试剂盒HP Fungal DNA Kiter (50)。真菌通用引物:ITS1:5′ TCCGTAGGTGAACCTGCGG 3′;ITS4:5′ TCCGTAGGTGAACCTGCGG 3′。2 × Taq Master Mix (近岸蛋白质科技有限公司)。
1.2 实验方法
1.2.1菌株分离纯化保存
1) 病原菌的分离培养。病原菌分离主要参照方中达的方法[2],实验前制备PDA培养基并将所需的材料置于高压灭菌锅中进行高压灭菌,在无菌操作台上切取根部病健交界处5 mm × 5 mm的组织,先置于70%乙醇中表面消毒10~15 s,然后在0.1%升汞中深层消毒1~6 min,再用无菌水中漂洗2~3次,最后置于PDA培养皿中,每个培养皿放4块,设置3个重复,25 ℃黑暗培养,待菌块病原长出菌丝后挑至PDA中纯培养,观察记录菌落形态及颜色和病原菌的形态特征[3]。
2) 病原菌保存。将纯化得到的菌株培养至PDA斜面培养基中,置于4 ℃冰箱中保存。
1.2.2致病菌的致病性测定
将星油藤根腐病分离纯化后的病原菌转至PDA平板上,25 ℃培养箱中培养5 d后,挑取新鲜菌丝置于PDA培养基中,置于摇床内培养7 d,待菌扩繁后浇于健康植株上。同时设喷浇清水为空白对照,每个处理重复30次。接种后放置于温室大棚内培养,观察植株生长情况并记录。待植株发病后再次按上述方法进行分离培养,观察病原菌形态特征[4]。
1.2.3菌株分子鉴定
用75%乙醇杀菌消毒挑针并于火焰上灼烧,挑取黄豆大小的菌丝置于离心管中,切记挑到培养基,用镊子夹取放于液氮中,用搅棍棒搅碎。采用真菌DNA抽提试剂盒提取病菌DNA,转录区扩增采用通用真菌通用引物ITS1、ITS4,PCR扩增体系为2 × Taq Master Mix 25 μL,ddH2O 20 μL,ITS1 1.5 μL,ITS4 1.5 μL,DNA 2 μL。PCR反应条件:94 ℃ 3 min;94 ℃ 30 s,56 ℃ 40 s,72 ℃ 50 s,72 ℃ 10 min,4 ℃ 保存[5]。把扩增后序列送至硕阳科技有限公司测序,将测序得到的特异性区间序列在NCBI进行比对得到同源性最高的相似菌种,最后分析实验结果。
1.2.4系统发育树构建
将测序结果输入至NCBI中进行序列比对,下载同源性最高的序列,导入MEGA中,基于ITS序列和Neifhbour-Joining分析方法构建系统发育树。
2 结果与分析
2.1 星油藤根腐病症状特点
病原菌主要侵染星油藤根部,受害植株地上部分症状表现为叶片发育受阻,叶形变小,枝叶稀疏,叶变黄、早落,最终导致整株枯死。挖出根部可见病树根及根茎部皮层腐烂,同时皮层与木质部间偶有白色菌丝存在。病原致病性测定后地上部分与地下部分症状与野外调查症状一致,依次出现初期叶片失去光泽,部分叶片变黄,后期叶片脱落,长势衰弱,根部皮层腐烂,并有白色菌丝出现 (图1)。

a为正常植株;b、c为发病植株。
图1星油藤根腐病症状
Fig.1 The symptom ofP.volubilisroot rot
2.2 星油藤根腐病病原菌分离
分离纯化后的病原菌在PDA培养基上25 ℃黑暗培养4 d后的菌落直径4 cm,菌落形态棉絮状,初为白色,后逐渐变为粉红色,气生菌丝生长速度快 (见图2a、b),小型分生孢子多卵圆形,大型分生孢子镰刀状,两端尖,多数3~5个分隔 (见图2c)。
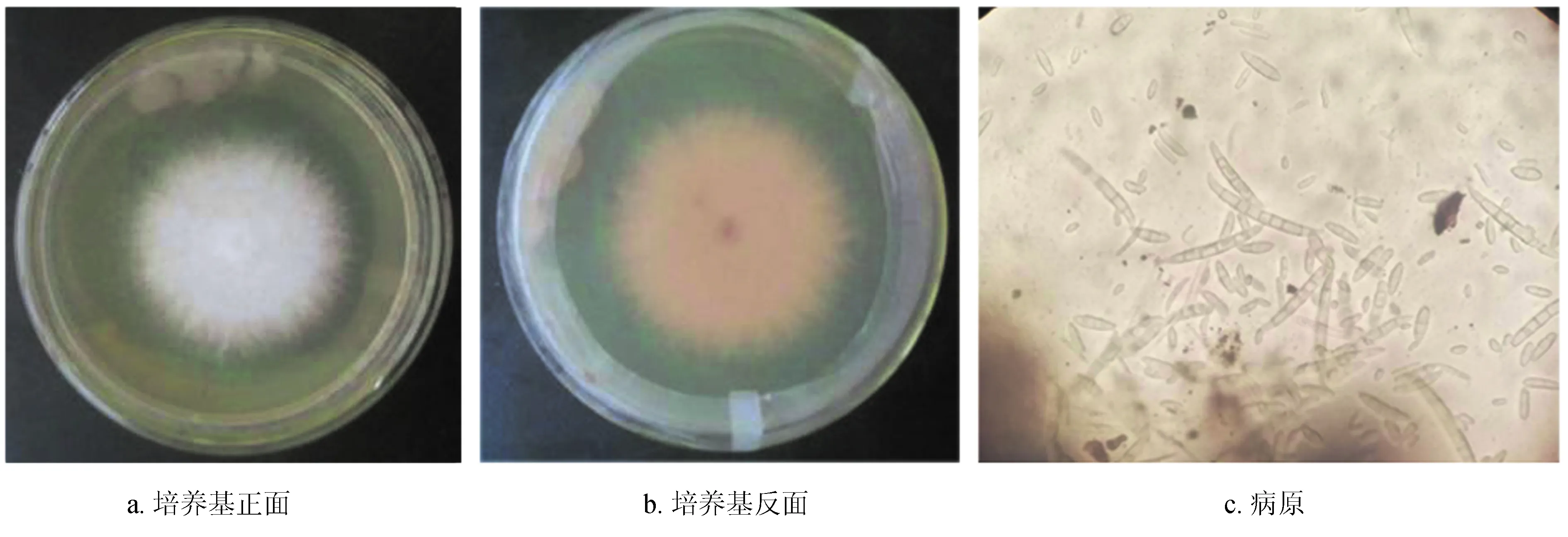
图2尖孢镰刀菌形态学特征
Fig.2 The morphological characteristics ofF.oxysporum
2.3 星油藤根腐病致病菌测定及病原重分离
将分离纯化后病原菌的孢子悬浮液浇于健康植株根部,接菌22 d后发现植株地上部分开始出现症状。2组试验中:第1组30株中有28株显症,病株率达93.33%;第2组30株中有26株显症,病株率达86.66%。显症植物树势变弱,叶片变黄,根部出现根部腐烂,在木质部和皮层间可见白色菌丝;清水对照无发病症状。病株经再次分离培养纯化后,获得相同菌落,通过诱导产孢,经显微镜观察鉴定,人工接种植株上分离得到的病原菌与野外发病植株上分离的病原菌菌落形态、孢子形态大小及分子鉴定均一致。供试病原菌对星油藤根腐病具有普遍致病性,发病的植株根部变色,坏死,同时,设清水对照不表现症状。菌株XYTGF10致病性较弱,发病率达到86.66%,菌株XYTGF9致病性更强,发病率达到92.20%。方差结果表明,菌株XYTGF9和XYTGF10均与对照存在显著差异。
2.4 星油藤根腐病病原菌ITS分子鉴定结果
扩增病原菌ITS-rDNA基因,获得长度为550~650 bp的DNA片段。序列测定并比对结果表明,供试菌株基因组ITS-rDNA序列与NCBI库内的尖孢镰刀菌 [Fusariumoxysporum(GenBank登录号为JN400718.1)] 同源性达到99%。据此确认该病原菌为尖孢镰刀菌,属半知菌类瘤座菌目,同时基于ITS序列和NJ分析方法构建系统发育树,可以看出这2个菌株在该类群中的位置,见图3。菌株XYTGF9与EU246679聚类在一起;XYTGF10与EU246687聚类在一起,进一步证明该病原菌的分类地位。
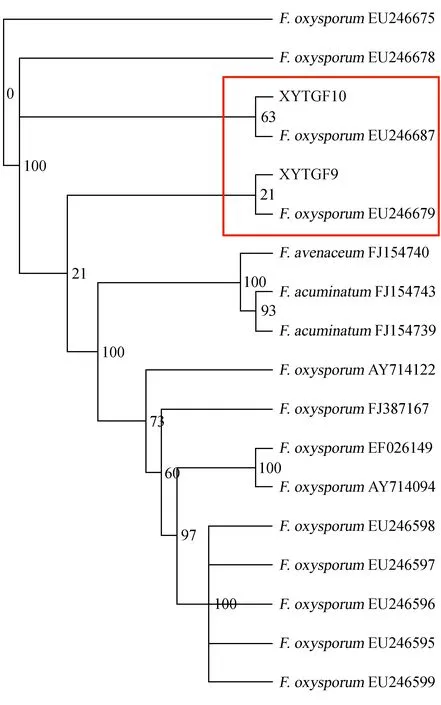
图3 基于ITS序列和NJ分析方法构建的系统发育树Fig.3 The phylogenetic tree based on ITS sequences with NJ
3 结论与讨论
在真菌的分类鉴定中,长期以来一直以形态特征为主要依据,而许多真菌的形态特征复杂难以观察,以及受环境条件的影响而不稳定的原因,给真菌的分类鉴定,尤其是种及种以下的分类鉴定带来一定的难度。近年来,随着分子生物技术的发展,真菌的分类学已从表型分型进入基因分型的新时代,已经为人们从分子水平上对真菌进行分类鉴定提供了有利手段。目前对真菌核糖体DNA (rDNA) 的内转录间各区 (ITS) 进行PCR扩增、测序及序列分析的方法来鉴定真菌病原,由于快速准确,已被广泛应用[6]。国外在真菌rDNA基因间隔区段的序列测定的研究,集中在小核菌 (Sclerotiumsp.)、白粉菌科 (Erysiphaceae)、腐霉菌 (Phythirumsp.) 和蜜环菌 (Armillariasp.) 等[7]。在星油藤根腐病病原鉴定中,在形态学鉴定的基础上,结合分子生物学鉴定的方法,采用rDNA-ITS序列分析的方法将病原真菌鉴定到种水平。查阅相关文献[8],未见有关尖孢镰刀菌引起星油藤根腐病的报道。许锐曾报道尖孢镰刀菌 (Fusariumoxysporum) 可引起香荚兰根腐病[9]。本研究通过对病原菌的分离培养,结合分子鉴定技术,准确测定出病害的病原为尖孢镰刀菌。在致病性鉴定中发现湿度、温度较高的情况下,会加重病害的发生发展。尖孢镰刀菌为典型的土传病害真菌,属土壤习居菌,是一类在土壤和有机质中数量多而活跃的病原真菌[10]。
[参考文献]
[1] 蔡志全, 杨清, 唐寿贤, 等. 木本油料作物星油藤种子营养价值的评价[J]. 营养学报, 2011, 33(2): 193-195.
[2] 方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998.
[3] 李娅, 武自强, 景跃波, 等. 西南桦苗木猝倒病的症状及其病原菌的鉴定[J]. 西部林业科学, 2013, 42(1): 86-90.
[4] 贺运春. 真菌学[M]. 北京: 中国林业出版社, 2008.
[5] 黄金凤, 陈丙义, 李金凤, 等. 草莓上胶孢炭疽菌的分离与鉴定[J]. 西南农业学报, 2012, 25(5): 1714-1719.
[6] 刘淑艳, 李玉. 几种主要分子生物学技术在菌物系统学研究中的应用[J]. 吉林农业大学学报, 2000, 22(3): 47-51.
[7] Paul B. ITS region ofPythiumcanariense, sp. nov. its morphology and its interaction withBotrytiscinerea[J]. Fems Microbiology Letters, 2002, 208(1): 135-141.
[8] 冯茜. 川芎根腐病病原鉴定、生物学特性和同工酶研究[D]. 成都: 四川农业大学, 2008.
[9] 许锐. 不同药剂对香荚兰尖孢镰刀菌根腐病的防治试验[C]// 2002年中国香料香精学术研讨会论文集. 上海: 中国香料香精学术研讨会, 2002.
[10]谢昌平, 李博勋, 文衍堂, 等. 龙血树根腐病病原菌的鉴定[J]. 植物保护, 2015, 41(1): 129-132.

