黄秋葵超微粉多糖提取工艺的 优化及其抗氧化活性测定
于 梅,单凌越,井瑞洁,张 鲲,张雅群,岳凤丽,*
(1.山东农业工程学院食品科学与工程学院,山东济南 250100;2.青岛农业大学食品科学与工程学院,山东青岛 266109)
黄秋葵又名洋辣椒,隶属锦葵科(Malvaceae)秋葵属(Abelmoschusmanihot(L.)Medic)[1],在我国广泛种植,产量丰富,味道鲜美且营养丰富,含有蛋白质、膳食纤维、游离氨基酸、多种维生素和矿物质。研究显示,黄秋葵具有保健功效,可以降血脂、保护肝脏、抗肿瘤、提高免疫力、抗氧化等[2-4]。
但目前对黄秋葵的开发利用仅停留在初加工水平,产品形式有鲜品、干制品、膨化品、罐头制品等且技术含量不高[5],为提高黄秋葵的附加值,开发精深加工产品,对黄秋葵进行多糖物质的提取及抗氧化活性研究意义重大。超微粉碎是一项现代高新技术,可将3 mm以上的物料颗粒瞬间粉碎至10~25 μm,在粉碎过程中不会产生局部过热现象,粉碎速度快,最大限度地保留粉体的生物活性成分,有助于提高活性成分的利用率,可充分实现黄秋葵资源的高效利用[5-7]。在多糖提取的研究中,大多原料是通过粉碎处理,过40~80目筛[8]。而本文将黄秋葵原料,经超微粉碎过300目筛。目前,这种以黄秋葵超微粉进行多糖的提取及抗氧化活性测定的研究未见报道。
本文为提高黄秋葵中多糖的得率及抗氧化活性,采用超声波-微波协同提取黄秋葵超微粉中的多糖,通过响应面分析法优化提取工艺条件,并测定其抗氧化活性,为黄秋葵的进一步开发提供技术依据。
1 材料与方法
1.1 材料与仪器
黄秋葵果实 江西萍乡产棱角种,青岛城阳区大润发超市;1,1-二苯基-2-三硝基苯肼(DPPH)、三羟甲基氨基甲烷(Tris) Sigma公司;二硫苏糖醇(DTT) Solarbio公司;邻二氮菲、三氯乙酸(TCA)、葡萄糖、焦性没食子酸、浓硫酸、苯酚、铁氰化钾、三氯化铁等试剂 国产分析纯。
DHG-9246A型电热恒温鼓风干燥箱 上海精宏实验设备有限公司;DU-800型紫外可见分光光度计 美国贝克曼公司;WF-20型万能粉碎机 江阴耐驰机械科技有限公司;XO-SM200超声波-微波组合系统 南京先欧仪器制造有限公司;WZJ-6J型振动式超细粉碎机 济南倍力粉技术工程有限公司;RE-6000旋转蒸发器 上海亚荣生化仪器厂;FD-1D-80冷冻干燥机 美国西蒙公司;电子分析天平 奥豪斯国际贸易(上海)有限公司。
1.2 实验方法
1.2.1 黄秋葵超微粉的制备 新鲜的黄秋葵果实洗净切块,50 ℃下烘干72 h,用万能粉碎机粉碎过80目筛,得黄秋葵粗粉,然后用振动式超细粉碎机处理粗粉,得300目黄秋葵超微粉,置于干燥器中保存备用。
1.2.2 黄秋葵超微粉多糖的提取 准确称取黄秋葵超微粉1.00 g,按设定好的料液比放入盛有蒸馏水的三角瓶中,置于磁力搅拌器上搅拌均匀,放入超声波-微波组合反应系统中进行处理。处理完的黄秋葵溶液于5000 r/min、4 ℃下离心15 min,取上清液,加水定容至50 mL备用。采用苯酚-硫酸法测定黄秋葵超微粉中多糖的含量[9]。绘制葡萄糖标准曲线为y=0.0098x+0.0095,相关系数R2=0.9996计算多糖得率。
多糖得率(%)=提取的多糖质量/黄秋葵超微粉质量×100
1.2.3 单因素实验
1.2.3.1 料液比对多糖得率的影响 选取微波时间2 min,微波功率800 W,超声波时间15 min,超声波功率700 W的条件,考察不同料液比1∶40、1∶60、1∶80、1∶100、1∶120 (g∶mL)对多糖得率的影响。
1.2.3.2 微波时间对多糖得率的影响 选取超声波时间15 min,微波功率800 W,超声波功率为700 W,料液比1∶100 (g∶mL)的条件,考察不同微波时间0.5、1、2、3、4 min对多糖得率的影响。
1.2.3.3 超声波时间对多糖得率的影响 选取微波时间2 min,微波功率800 W,超声波功率为700 W,料液比1∶100 (g∶mL)的条件,考察不同超声波时间5、10、15、20、25 min对多糖得率的影响。
1.2.3.4 超声波功率对多糖得率的影响 选取微波时间2 min,微波功率800 W,超声波时间为15 min,料液比1∶100 (g∶mL)的条件,考察不同超声波功率100、300、500、700、900 W对多糖得率的影响。
1.2.4 Box-Behnken中心组合实验设计 在单因素实验的基础上,选择3个对多糖得率影响较大的因素,每个因素选取三个水平,以多糖得率为响应值,建立三因素三水平的Box-Behnken中心组合实验,如表1。
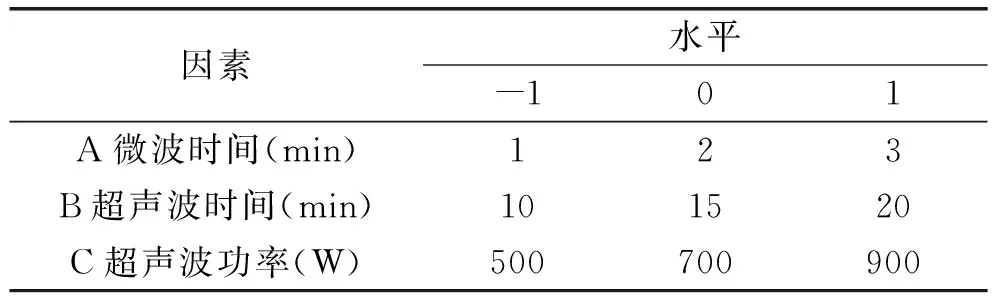
表1 响应曲面设计实验因素水平和编码Table 1 Independent variables and their levels used in the response surface design
1.2.5 体外抗氧化活性实验 在最佳工艺条件下提取的黄秋葵超微粉多糖溶液用四倍体积乙醇醇沉得多糖沉淀,将其在-80 ℃下冷冻干燥得到多糖粉,配制一定浓度的多糖溶液,测定所得多糖的体外抗氧化活性。
1.2.5.1 DPPH自由基清除率的测定 取4支试管分别编号,0号试管只加入浸提试剂,1号试管加入浸提试剂和2.4 mL 0.1 mmoL/L DPPH自由基乙醇溶液,2号试管分别加入2.4 mL 0.1 mmoL/L DPPH自由基乙醇溶液、浸提试剂以及多糖溶液,3号试管加入无水乙醇、浸提试剂以及多糖溶液充分混匀,黑暗处静置30 min,测517 nm处的吸光值[10]。分别记为An(n取0~3)。清除率计算公式:
清除率(%)=[1-(A2-A3)/A1]×100
1.2.5.2 超氧阴离子自由基清除率的测定 取4支试管分别加入5 mL Tris-HCl缓冲液,0、1号试管加入50 μL浸提试剂,2、3号试管加入50 μL待测的多糖溶液,25 ℃下静置20 min,0、3号加入40 μL盐酸,1、2号加 40 μL 25 mmoL/L邻苯三酚,混匀计时,保证每个试管反应3 min后加入50 μL DTT终止反应,316 nm处测定吸光值[11]。吸光值分别记为An(n取0~3)。清除率计算公式:
清除率(%)=[(A1-A2+A3)/A1]×100
1.2.5.3 羟自由基清除率的测定 取5支试管加入PBS(pH=7.4)缓冲溶液,0、1、3号试管加入蒸馏水,3、4号试管加入待测多糖溶液,0、1、2号试管加入浸提试剂,1、2、4号试管加入7.5 mmol/L的邻二氮菲和硫酸亚铁溶液,2、4号管加入1%双氧水,37 ℃静置90 min,536 nm处测定吸光值[12]。吸光值分别记为An(n取0~4)。清除率计算公式:
清除率(%)=[(A4-A3-A2)/A1-A2]×100
1.2.5.4 还原力测定 取0、1号试管,分别加入蒸馏水和待测的多糖溶液,再向0、1号加入PBS(pH=6.6)缓冲液和1%铁氰化钾溶液,充分混匀后于50 ℃下放置20 min,快速冷却后加入10% TCA,混匀,5000 r/min离心10 min,取上清液加1%三氯化铁溶液和蒸馏水,混匀静置5 min,在700 nm处测定吸光值[13]。其中,还原能力的大小与吸光值成正相关。
2 结果与分析
2.1 单因素实验
2.1.1 料液比对多糖得率的影响 由图1可知,多糖得率随料液比的增加呈现先增大后降低的趋势,在料液比为1∶100 (g∶mL)时,多糖得率最大为27.20%。分析原因可能是溶剂体积的增加使得溶液中多糖浓度下降,使得多糖扩散的压力差增大,利于多糖扩散,但是多糖的扩散量是一定的,继续加大溶剂比例,也不会促进多糖扩散[14]。因此选择适宜料液比为1∶100 (g∶mL)左右。
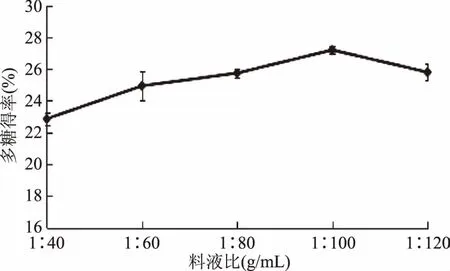
图1 料液比对多糖得率的影响Fig.1 Effect of ratios of material to water on the yield of polysaccharides
2.1.2 微波时间对多糖得率的影响 由图2可知,黄秋葵中多糖的得率随着微波时间的延长呈现先增大后趋势变化不显著,多糖得率在2 min处最高,达到24.96%。这是由于随着处理时间的延长,微波处理会破坏细胞壁,使多糖更加容易溶出,因此得率在2 min以前有上升趋势并在2 min时取得最大值。微波处理时间超过2 min,细胞中多糖几乎全部溶出,得率增加不明显[15]。综合考虑浸提时间、消耗能量以及减少原料浪费等因素,因此选择适宜微波处理时间为2 min左右。
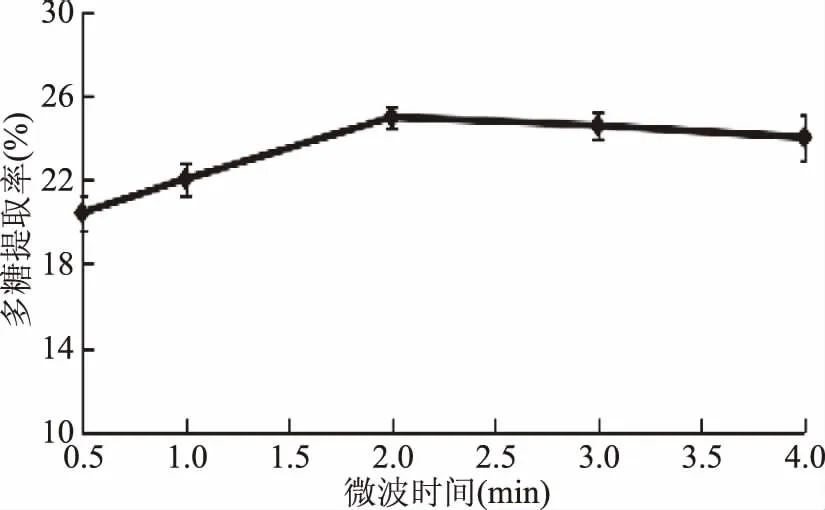
图2 微波时间对多糖得率的影响Fig.2 Effect of microwave time on the yield of polysaccharides
2.1.3 超声波时间对多糖得率的影响 由图3可知,多糖得率随超声波时间的延长呈现先增大后降低的趋势,在超声处理15 min时,多糖得率达到最大为27.6%。由于较短时间内,超声开始对细胞进行破碎,多糖得以释放,随着超声时间的增长,多糖破坏为单糖,同时超声波空化效应作用力减小,使黄秋葵颗粒表面对多糖吸附力增加,影响多糖析出[16]。因此选择适宜超声波时间为15 min左右。
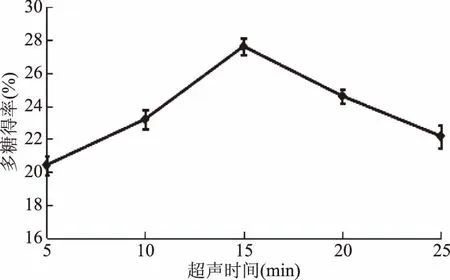
图3 超声波时间对多糖得率的影响Fig.3 Effect of ultrasonic time on the yield of polysaccharides
2.1.4 超声波功率对多糖得率的影响 由图4可知,随着超声波功率的增大呈现先增加后降低的趋势,700 W时多糖得率最大为27.49%。随着超声功率的增加超声的空化作用随之加强,细胞充分破裂多糖加速溶出;当超声波功率过大时,可能会引起局部溶液瞬时升温,使多糖分子链裂解,多糖得率有所降低[16]。因此选择适宜超声波功率为700 W左右。
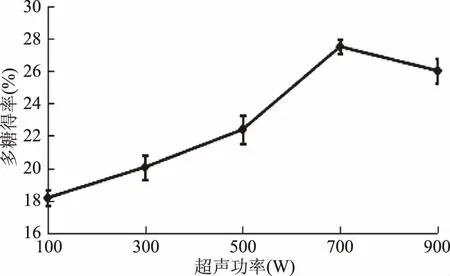
图4 超声波功率对多糖得率的影响Fig.4 Effect of ultrasonic power on the yield of polysaccharides
2.2 BBD实验结果及数据分析
2.2.1 BBD实验设计方案及结果 根据单因素实验结果,由SPSS 18.0软件方差分析得,除料液比对得率影响不显著外(p>0.05),其余各因素对多糖得率存在显著影响(p<0.05),因此选用微波时间、超声波时间、超声波功率三个因素进行响应面处理获得最优条件。由Design-Expert 8.0.5统计分析软件设计三因素三水平实验,通过Box-Behnken实验设计出17个实验方案及结果见表2。

表2 响应面分析实验设计及多糖得率Table 2 RSM design and polysaccharides yield
2.2.2 回归方程拟合及方差分析 采用Design-Expert 8.0.5对实验数据进行回归分析,结果见表3。得到回归方程:
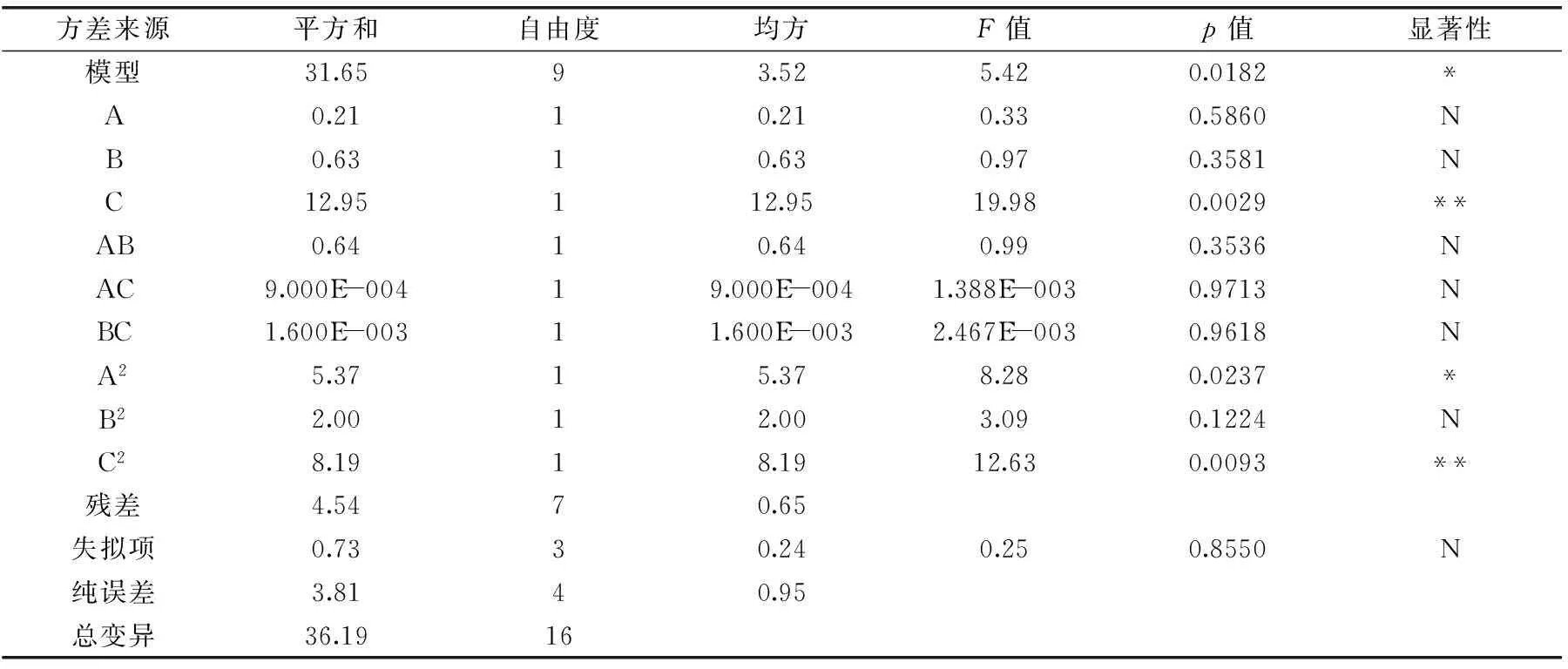
表3 回归模型及方差分析Table 3 Analysis of variance of regression equation
Y=27.47+0.16A-0.28B+1.27C+0.40AB+0.015AC-0.020BC-1.13A2-0.69B2-1.39C2
回归模型的显著水平不高,模型显著(p<0.05),失拟项是用来评估方程可靠性的重要依据,本实验失拟项F值为0.25,p值为0.8550>0.05,说明该模型失拟项不显著,能对相关反应进行预测。信噪比为5.077>4,表明该模型拟合度和可信度都较高。
因此不同提取条件下黄秋葵超微粉中多糖得率的变化可用此模型方程来预测。
2.2.3 响应面图分析 根据回归模型,将任一因素固定在零水平,能够得到反映另外2个因素及其交互作用影响的响应曲面和等高线图,结果如图5。
由图5及表3可知,模型中的C(超声波功率)和C2(超声波功率二次项)对黄秋葵超微粉中多糖得率有极显著影响,A2(微波时间二次项)对黄秋葵超微粉中多糖得率有显著影响,而在微波时间和超声波时间、微波时间和超声波功率以及超声波时间和超声波功率的相互作用下,对黄秋葵超微粉中多糖得率影响不显著。综合各图表数据所得,这3个因素对黄秋葵超微粉中多糖得率的影响大小顺序为超声波功率>超声波时间>微波时间。
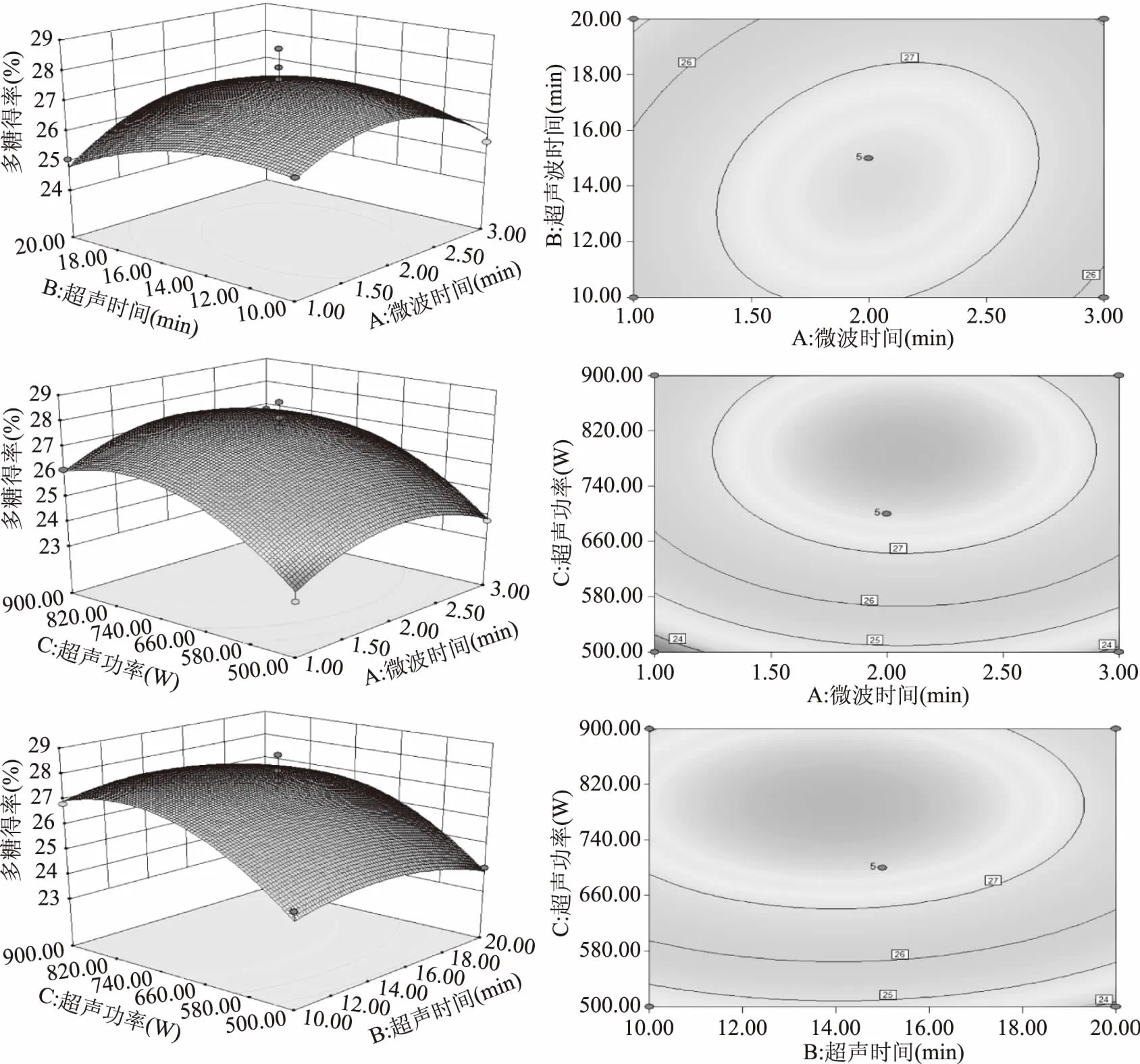
图5 两因素的交互作用对多糖得率的响应面图和等高线图Fig.5 Response surface and contour plots showing the interactive effects of two factors on the yield of polysaccharides
2.2.4 黄秋葵超微粉多糖提取工艺条件的确定与验证 依据回归模型经过Design-Expert 8.0.5软件分析得到黄秋葵超微粉中多糖提取的最佳提取工艺参数为:微波时间2.04 min、超声波时间14.01 min、超声波功率791.70 W。在此条件下,黄秋葵超微粉中多糖得率的预测值为27.7963%。联系现实考虑节能问题对上述条件进行修正,最终的优化条件为微波时间2 min、超声波时间14 min、超声波功率800 W。采用上述优化提取条件重复实验3次,经验证,得到的平均得率为27.68%,与理论预测值27.7963%相比差0.42%,相对误差较小,说明该模型能较好的预测实际得率。
2.3 黄秋葵超微粉中多糖的抗氧化活性分析结果
由Excel 2007作样品浓度关于自由基清除率二次线性方程,当清除率为50%时计算所需样品浓度得IC50,其中y表示自由基清除率,x表示样品浓度。
2.3.1 DPPH自由基清除能力 如图6,黄秋葵超微粉多糖对DPPH自由基的清除率随着多糖浓度的增加而增强。浓度在1~2 mg/mL范围内,清除率增加趋势较快,多糖液浓度为2 mg/mL时,清除率是58.4%,2~5 mg/mL范围内,清除率增加放缓,当多糖液的浓度达到5 mg/mL时,其DPPH自由基清除率达到了92.0%,其IC50值为1.53 mg/mL,根据表4可知,在四个自由基清除体系中,DPPH自由基清除体系中的IC50值最小,说明相比较其它三种自由基,DPPH自由基的清除率在50%时所需多糖溶液浓度最低,因此多糖在DPPH自由基清除体系中的抗氧化能力表现最好。
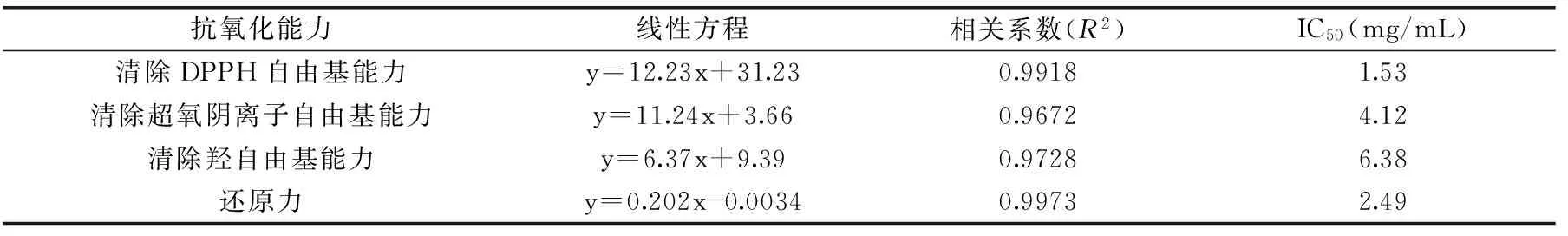
表4 黄秋葵超微粉多糖清除自由基 IC50值Table 4 Scavenging free radical IC50 value of polysaccharides from superfine powder of okra
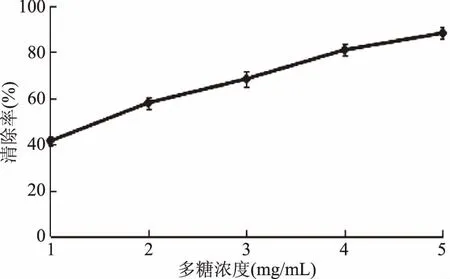
图6 黄秋葵超微粉多糖对DPPH自由基的清除率Fig.6 Scavenging rate of DPPH free radicals of polysaccharides from superfine powder of okra
2.3.2 超氧阴离子自由基清除能力 如图7,随着多糖浓度的增加,对超氧阴离子自由基的清除率随之增加。在1~3 mg/mL范围里,增加较为快速,在3~5 mg/mL范围内,超氧阴离子自由基清除率增加缓慢。当浓度为5 mg/mL,超氧阴离子自由基清除率是44.2%。其IC50值为4.12 mg/mL。
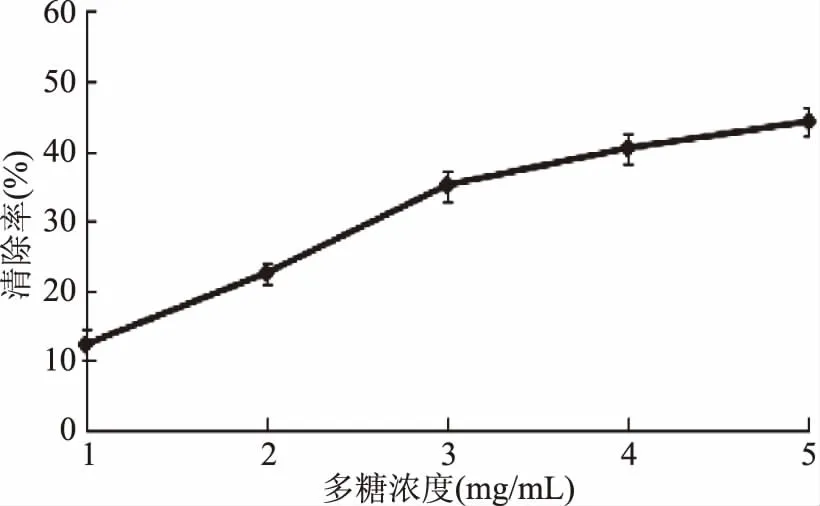
图7 黄秋葵超微粉多糖对超氧阴离子自由基的清除率Fig.7 Scavenging rate of of polysaccharides from superfine powder of okra
2.3.3 羟自由基清除能力 如图8,随着多糖浓度的增加,对羟自由基的清除率随之增加。在1~3 mg/mL范围里,增加较为快速,在3~5 mg/mL范围内,羟自由基清除率增加缓慢。当浓度为5 mg/mL,羟自由基清除率49.2%。其IC50值为6.38 mg/mL。
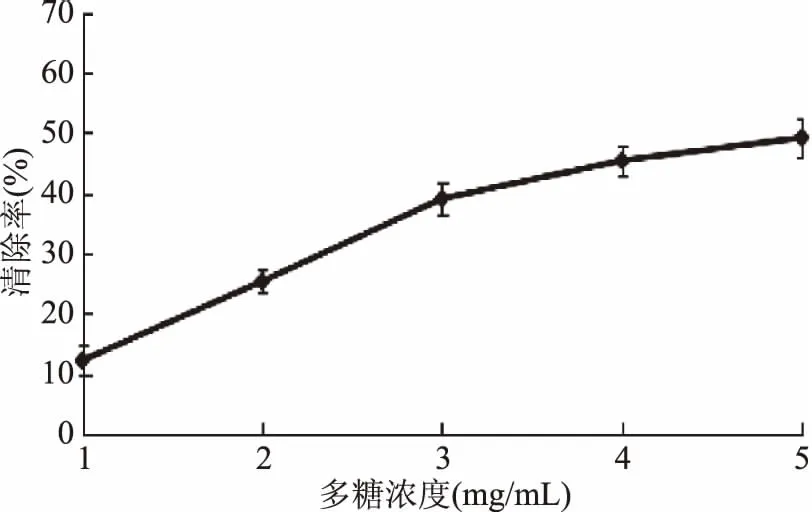
图8 黄秋葵超微粉多糖对羟自由基的清除率Fig.8 Scavenging rate of ·OH of polysaccharides from superfine powder of okra
2.3.4 还原力的测定 由图9可得,黄秋葵超微粉多糖具有较强的还原力,随着多糖浓度的增加其还原力越强。在1~5 mg/mL范围内增长趋势接近于线性增加。在5 mg/mL时,多糖还原力高达0.995。其IC50值为2.49 mg/mL。
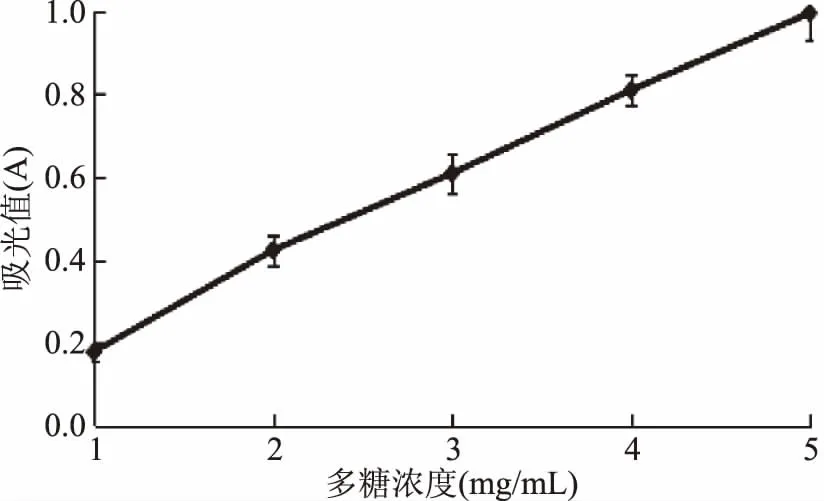
图9 黄秋葵超微粉多糖的还原力测定Fig.9 Determination of reducing force of polysaccharides from superfine powder of okra
3 结论
采用响应面法对黄秋葵超微粉多糖提取条件进行优化,建立了黄秋葵超微粉多糖得率与微波时间、超声波时间、超声波功率这三种因素的二次多项回归模型。由该模型优化的多糖提取条件为料液比1∶100 (g∶mL)、微波时间2 min、超声波时间14 min、超声波功率800 W。经验证,得到的实际测定值为(27.68%±0.42%)。说明该模型能较好的预测实际得率,用响应面法对黄秋葵超微粉中多糖提取条件进行优化准确可行。抗氧化活性实验表明黄秋葵超微粉多糖对DPPH自由基、超氧阴离子自由基、羟自由基均有一定的清除能力并且具有较强的还原能力。多糖在四种体系中的IC50值分别是1.53、4.12、6.38和2.49 mg/mL,说明黄秋葵超微粉多糖具有较好的抗氧化活性。
[1]Sengkhamparn N,Sagis LM,Vries RD,et al. Physicochemical properties of pectins from okra[J]. Food Hydrocolloids,2010,4(1):35-41.
[2]任丹丹,陈谷. 响应面法优化黄秋葵多糖超声提取工艺[J]. 食品科学,2011,32(8):143-146.
[3]程旺开,许月明. 响应面优化黄秋葵叶多糖的提取工艺及其抗氧化活性考察[J]. 中国实验方剂学杂志,2017(4):38-42.
[4]宋思圆,苏平. 黄秋葵花果胶多糖的超声提取工艺优化及其体外抗氧化活性[J]. 食品科学,2017,38(2):283-289.
[5]邹林武,赵谋明. 香菇多糖提取工艺的优化及其抗氧化活性研究[J]. 食品工业科技,2013,34(19):177-182.
[6]岳凤丽,陈庆敏,于克学,等. 微波辅助提取超微毛木耳粉多糖的工艺优化[J]. 食品研究与开发,2014,22(9):13-17.
[7]王晓炜,程光宇. 超微粉碎和普通粉碎对柳松菇多糖的提取及凝胶柱层析分离的研究[J]. 南京师大学报(自然科学版),2006,29(1):66-70.
[8]张圣杰,陈相艳,李文香,等. 超声联合超微粉碎法提取金针菇多糖新探究[J]. 食品工业,2014,35(4):101-104.
[9]邱志敏,芮汉明. 微波辅助提取枸杞多糖的工艺优化及其抗氧化性研究[J]. 食品工业科技,2012,33(7):220-223.
[10]Yang Z,Zhai W. Identification and antioxidant activity of anthocyanins extracted from the seed and cob of purple corn(ZeamaysL.)[J]. Innovative Food Science & Emerging Technologies,2010,11(1):169-176.
[11]朱晓君,安辛欣,顾丽,等. 超声辅助同时提取条斑紫菜多糖及藻胆蛋白工艺的优化[J]. 食品科学,2008,29(5):241-244.
[12]刘航,国旭丹,马雨洁,等. 超声波辅助提取苦荞麦多糖工艺优化及其体外抗氧化研究[J]. 食品科学,2013,34(14):45-50.
[13]Pérez-Jiménez J,Arranz S,TaberneroM,et al. Updated methodology to determine antioxidant capacity in plant foods,oils and beverages:Extraction,measurement and expression of results[J]. Food Research International,2008,41(3):274-285.
[14]曹楠楠,陈香荣,吴艳. 苦豆子多糖的超声波提取工艺优化及理化性质研究[J]. 现代食品科技,2014,30(2):209-214.
[15]王振宇,孙芳,刘荣. 微波辅助提取松仁多糖的工艺研究[J]. 食品工业科技,2006,27(9):133-135.
[16]张君萍,侯喜林,董海艳,等. 响应曲面法优化超声波提取沙葱籽多糖工艺[J]. 食品科学,2011,30(2):99-102.

