响应面优化超声-微波协同提取紫米原花青素工艺
程海涛,申献双
(1.衡水学院化工学院,河北衡水 053000;2.衡水学院美术学院,河北衡水 053000)
原花青素主要是多酚类物质,是由黄烷-3-醇和黄烷-3,4-二酚的配位缩合或聚合而成的低聚或多聚物,可以有效清除人体内产生的活泼自由基[1-4]。原花青素在植物体的组织内广泛存在,从化学组成分析,它是一种聚合体,聚合单体是儿茶素或表儿茶素,聚合单体数目不等[5-7]。聚合后聚合体官能团差别较大,进而引起其活性的差异,其中抗氧化性与聚合度成反比[8]。原花青素在化妆品、医药等领域有广泛的应用,可强化动脉、静脉和毛细血管,有效清淤化肿[9-13],加快毛细血管血液流动速度,减少毛细血管阻力,改善血管渗透性,从而提高组织细胞新陈代谢过程,使组织器官吸收养分和排除废弃物更加自由[14-17]。
超声波是频率高于20 kHz不引起听觉的弹性波。超声波产生的热效应、机械作用、空化效应可以缩短反应时间,提高反应产率,降低反应条件。微波是频率介于300 MHz~300 GHz之间的电磁波,具有穿透力强、选择性好、加热效率高等特点[18]。原花青素提取方法有溶剂法、超声提取法、超临界提取法、酶提取法。单纯利用超声波或者微波提取原青花素已经有相关研究但是得率不是太高[19-21]。超声-微波协同作用对于化学反应、物质提取具有很强的强化作用,优点是提取时间短、温度一般较低、收率高,但是目前对超声-微波协同提取紫米中原花青素的工艺的研究尚未见报道。
本研究以云南墨江紫米为研究对象,利用超声波-微波协同作用强化紫米中原花青素提取工艺,以单因素实验为基础,研究了超声功率、超声时间、微波功率、微波时间、液料比等影响因素对紫米中原花青素得率的影响,采用响应面法优化了超声波-微波协同作用强化紫米中原花青素提取工艺。
1 材料与方法
1.1 材料与仪器
紫米 云南墨江;无水乙醇 分析纯,天津市大茂化学试剂厂;甲醇 分析纯,天津市大茂化学试剂厂;硫酸 分析纯,天津市大茂化学试剂厂;香草醛 分析纯,天津市大茂化学试剂厂;原花青素标准品 纯度99.9%,天津市大茂化学试剂厂。
JYD-650型超声波发生器 上海之信仪器有限公司;WD900G型格兰仕家用微波炉 佛山市顺德区格兰仕微波炉电器有限公司;T6新型紫外-可见分光光度计 北京普析通用仪器有限责任公司;HH-S4型恒温水浴锅 北京市长风仪器仪表公司;FW80型高速万能粉碎机 天津市泰斯特仪器有限公司;TP-A100型电子天平 金坛市国旺实验仪器厂;AR1140型离心机 上海安亭科学仪器厂。
1.2 实验方法
1.2.1 原花青素标准曲线的绘制 准确称取一定质量的原花青素标准品,用甲醇溶解并定容于100 mL容量瓶中,依次配制浓度分别为1、0.9、0.8、0.7、0.6、0.5 mg/mL的原花青素做标准溶液。利用香草醛-盐酸法[22]测定其吸光度,绘制标准曲线,标准曲线方程:y=0.4514x-0.0356,R2=0.9996。
1.2.2 紫米中原花青素提取工艺 紫米用粉碎机粉碎后过60目筛,在40 ℃环境下干燥使其水分含量低于10%,并储存于-20 ℃环境下备用。称取一定质量紫米粉,按一定液料比(即乙醇溶液与紫米粉体积质量比)加入乙醇水溶液,在设定的乙醇体积分数、超声功率、超声时间、微波功率、微波时间下恒温搅拌浸提,首先经过超声波处理,再进行微波处理,抽滤,保存滤液。
1.2.3 紫米中原花青素得率的测定
1.2.3.1 紫米样品中原花青素浓度的测定 首先,利用香草醛—盐酸法[19]测定其吸光度,具体如下:精确量取0.5 mL试样液缓慢放入10 mL的试管中,然后加入2.5 mL的 1%香草醛-甲醇的溶液和2.5 mL的30%浓盐酸-甲醇的溶液,并在30 ℃水浴避光环境中反应20 min,以0.5 mL的甲醇代替样液做为空白对照实验,在500 nm波长处测定其吸光度,记录实验测量的吸光度。再根据测得的原花青素标准曲线方程,确定紫米样品中原花青素浓度。
1.2.3.2 紫米中原花青素得率计算 精密吸取紫米中原花青素提取溶液 1.0 mL,按 1.2.3.1 方法进行操作并测定吸光度[14],每个实验重复三次。按以下公式计算得率:
紫米中原花青素得率Y(%)=[VCn/(1000×W)]×100
式中,V:提取液体积(mL);C:提取液中紫米原花青素浓度(mg/mL);n:提取液稀释倍数;W:紫米粉质量(g)。
1.2.4 单因素实验设计 以乙醇体积分数、液料比、超声功率、超声时间、微波功率、微波时间为影响因素,考察其对紫米原花青素得率的影响。乙醇体积分数变化范围30%、40%、50%、60%、70%,液料比变化范围10、15、20、25、30 mL/g,超声波功率变化范围300、350、400、450、500 W,超声时间变化范围20、30、35、40、45 min,微波功率变化范围250、300、350、400、450 W,微波时间变化范围1、2、3、4、5 min。
1.2.5 响应面实验设计 在单因素实验的基础上,选取得率为响应值Y,液料比(X1),超声时间(X2),微波功率(X3),微波时间(X4)的变化因素,根据 Box-Benhnken 的实验设计原理,通过SAS软件对实验数据进行回归分析,确定最佳工艺。根据单因素实验结果,设计4因素3水平的响应面优化实验如下表1所示。

表1 响应面因素和水平Table 1 The factor and level of the response surface
1.3 对照实验
超声提取:乙醇体积分数50%,液料比22 mL/g,超声功率400 W,超声时间33 min工艺条件下做三次平行实验。
微波提取:在乙醇体积分数50%,液料比22 mL/g,微波功率350 W,微波时间3.3 min工艺条件下做三次平行实验。
超声-微波协同提取:在超声-微波协同最优工艺条件下做三次平行实验。
1.4 数据统计分析
响应面实验设计与数据处理采用SAS 9.2软件处理数据;单因素实验数据图表处理采用EXCEL 2003软件处理。
2 结果与分析
2.1 超声波-微波协同提取紫米原花青素工艺单因素实验
2.1.1 乙醇体积分数对得率的影响 由图1可以看出,得率随乙醇体积分数增加逐步增大,体积分数为50%时得率达到6.94%,超过50%后得率开始降低,降低趋势平缓。原因可能是原花青素为极性化合物,易溶于极性溶剂,乙醇的加入提高了溶液的极性,有利于原花青素的提取,但是有机溶剂渗透性差,需要水作为传质剂,因此乙醇溶度不宜过高,太高会导致传质性降低,不利于原花青素的提取。因此,选择适宜乙醇体积分数为50%。

图1 乙醇体积分数对得率的影响Fig.1 Effects of ethanol volume fraction on the extraction
2.1.2 液料比对得率的影响 由图2可以看出得率随液料比的增大,呈现上升趋势,液料比为20时得率为6.96%,液料比继续增大,得率不再增加反而开始降低,降低趋势较大。液料比越大,紫米中原花青素与乙醇溶液的浓度差越大,越容易析出,但是液料比太大,单位体积提取液受到的超声波的热效应、机械作用、空化效应与微波的穿透力、选择性、加热效率都会降低,不利于原花青素的提取。因此,在响应面优化实验过程中对液料比进行进一步优化,优化范围为10~30 (mL/g)。

图2 液料比对得率的影响Fig.2 Effects of liquid-solid on the yield
2.1.3 超声功率对得率的影响 由图3可知,在超声波功率逐步增大趋势下,得率呈上升趋势,超声功率400 W时得率为6.95%,超声功率继续增大,得率不再有明显上升趋势,趋于平缓,超声波与介质相互作用时,超声波功率起决定性作用。一般情况下随超声波功率增加,空化作用变得强烈,得率增加,但是功率太大会造成原花青素的降解,从而得率降低。考虑实验条件等综合因素,超声波-微波协同提取紫米原花青素最佳工艺中超声功率400 W为最佳工艺条件。

图3 超声功率对得率的影响Fig.3 Effects of ultrasound power on the yield
2.1.4 超声时间对得率的影响 由图4可以看出,随超声时间的增加,得率逐步增大,时间达到30 min得率最大为6.95%,时间再增加,得率开始缓慢下降,降低趋势较大。因为超声时间太长,有效成分降解或被超声波破坏,同时杂质可随有效成分一起被提取出来,而且超声时间越长,杂质含量越高,得率降低越快。因此,在响应面优化实验过程中对超声时间进行进一步优化,优化范围为20~40 min。

图4 超声时间对得率的影响Fig.4 Effects of ultrasound time on the yield
2.1.5 微波功率对得率的影响 由图5可知,微波功率增大的情况下得率逐步增大,微波功率为350 W时得率为6.93%,微波功率继续增大,得率开始缓慢下降,且降低趋势较大。因为微波功率越大产生的热效应越高,提高原花青素分子动能,得率会增大,但是微波功率过大产生过多热效应将使原花青素降解加速,因此得率降低。在响应面优化实验过程中对微波功率进行进一步优化,优化范围为300~400 W。

图5 微波功率对得率的影响Fig.5 Effects of microwave power on the yield
2.1.6 微波时间对得率的影响 由图6可以看出,得率随微波时间的增加而增大,微波时间为3 min时得率为6.96%,时间再增加得率变小,降低趋势较大。因为微波时间的增加造成热量的积累,开始有利于原花青素分子的析出,但是温度过高,造成分子结构的破坏,造成得率下降。因此,在响应面优化实验过程中对微波时间进行进一步优化,优化范围为1~5 min。

图6 微波时间对得率的影响Fig.6 Effects of microwave time on the yield
2.2 响应面优化超声波-微波协同提取紫米原花青素工艺
2.2.1 响应面实验
2.2.2 响应面优化工艺回归方程建立 通过单因素实验结果可以看出影响因素中乙醇体积分数、超声功率为50%、400 W时得率最大,再增加得率变化不再明显,同时考虑实际实验条件,确定最优条件下乙醇体积分数、超声功率为50%、400 W。
选取得率为响应值Y,液料比(X1),超声时间(X2),微波功率(X3),微波时间(X4)为自变因素,根据Box-Benhnken 的实验设计原理,设计四因素三水平的响应面实验(见表2),实验结果见表3。通过拟合回归处理数据得到拟合函数模型:

表2 响应面实验方案及实验结果Table 2 The response surface experiment scheme and experimental results

表3 回归分析结果Table 3 The regression analysis results
Y=7.063333+0.108333X1+0.119167X2+0.061667X3+0.0775X4-0.38625X12-0.1075X1X2-0.01X1X3-0.0825X1X4-0.4125X22-0.1625X2X3-0.0675X2X4-0.42375X32+0.0375X3X4-0.26X42
由回归结果看出,函数模型R2=99.73%,说明模型计算值和实验值拟合度高,模型确定的方程预测超声波-微波协同提取紫米原花青素得率最大值是可信的。由回归方程的方差分析结果可以看出液料比(X1),超声时间(X2),微波功率(X3),微波时间(X4)四个影响因素影响程度X2>X1>X4>X3,影响因素之间的交互影响 X1X3不显著,其余项影响极显著。
2.2.3 各因素交互作用分析 由图7可知,响应面坡度比较陡峭,说明X1液料比和X2超声时间对紫米中原花青素的得率的影响较大。在X1液料比9~27 mL/g、X2超声时间18~36 min的范围内存在极值,两因素对得率的交互作用显著。

图7 X1和X2交互作用影响得率的响应面图Fig.7 Response surface graphs showing the interactive effects of X1 and X2 on the extraction
原因在于液料比越大得率越高,而在一定液料比下超声时间越长,得率会降低,因此X1液料比和X2超声时间对紫米中原花青素的得率交互影响作用显著。
由图8可知,X1液料比和X4微波时间对紫米中原花青素的得率的影响较大。在X1液料比9~27 mL/g、X4微波时间0.9~4.5 min的范围内存在极值,两因素对得率的交互作用显著。原因在于液料比越大微波时间越长,得率越高,一定液料比下微波时间越长得率会下降,因此X1液料比和X4微波时间对紫米中原花青素的得率交互影响作用显著。

图8 X1和X4交互作用影响得率的响应面图Fig.8 Response surface graphs showing the interactive effects of X1 and X4 on the extraction
由图9可知,X2超声时间和X3微波功率对紫米中原花青素的得率的影响较大。在X2超声时间18~36 min、X3微波功率270~360W的范围内存在极值,两因素对得率的交互作用显著。原因在于微波功率越大得率越高,一定微波功率下超声时间越长得率会降低。
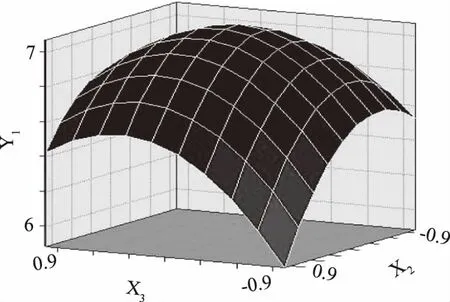
图9 X2和X3交互作用影响得率的响应面图Fig.9 Response surface graphs showing the interactive effects of X2 and X3 on the extraction
由图10可知,X2超声时间和X4微波时间对紫米中原花青素的得率的影响较大。在X2超声时间18~36 min、X4微波时间0.9~4.5 min的范围内存在极值,两因素对得率的交互作用显著。原因在于微波时间、超声时间越长越有利于原花青素提取,但是过长微波时间、超声时间造成原花青素的结构变化,会导致得率降低。
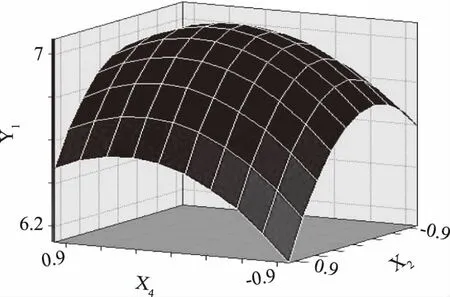
图10 X2和X4交互作用影响得率的响应面图Fig.10 Response surface graphs showing the interactive effects of X2 and X4 on the extraction
2.2.4 响应面优化工艺实际验证实验 对经过响应面优化得到的数学回归方程进行求极大值,得到X1为22 mL/g,X2为33 min,X3为350 W,X4为3.3 min,得率预测最大值为7.09%。根据响应面优化结果和综合因素影响得到超声波-微波协同提取紫米原花青素最佳工艺是:乙醇体积分数50%,液料比22 mL/g,超声功率400 W,超声时间33 min,微波功率350 W,微波时间3.3 min。在最优条件下进行3次实验,实验结果表明得率为7.09%±0.01%,与数学模型求极值得到数值相差很小,同时证明得到的数学回归拟合模型可信度很高。

图11 X3和X4交互作用影响得率的响应面图Fig.11 Response surface graphs showing the interactive effects of X3 and X4on the extraction
2.2.5 对照实验结果 采用超声波与微波单独提取紫米中的原花青素,得率远低于超声波-微波协同提取的得率,如图12所示。

图12 微波、超声波、超声波微波协同处理得率Fig.12 The yield of ultrasonic wave、microwave and ultrasonic microwave processing together
3 结论
本实验利用超声波-微波协同提取了紫米中原花青素,在单因素实验的基础上,通过响应面Box-Benhnken实验设计与响应面分析对超声波-微波提取紫米中原花青素工艺进行优化,得到了最佳工艺:乙醇体积分数50%,液料比22 mL/g,超声功率400W,超声时间33 min,微波功率350W,微波时间3.3 min,得率7.09%。实验证明超声波-微波协同提取紫米中原花青素的工艺是可行的。对比实验证明,超声波-微波协同提取紫米中原花青素与单纯利用超声波与微波提取紫米中原花青素相比,得率分别提高2.72%、4.72%。
[1]容晨曦,张秀玲,李铁柱,等.响应面实验优化微波法提取刺玫籽原花青素的工艺[J]. 食品科学,2016,37(18):41-46.
[2]吴涛,黄云霞,张民. 紫米原花青素的体内降血糖作用研究[J]. 现代食品科技,2016,32(8):42-47.
[3]Zhang Lianfu,Liu Zelong.Optimization and comparison of ultrasound/microwave assisted extraction(UMAE)and ultra-sonicassistedextraction(UAE)oflycopenefromtoma-toes[J]. Ultrasonics Sonochemistry,2008,15(5):731-737.
[4]Xiao L X,Zhi-Gui H E,Zhu Y,et al. Optimization of Proanthocyanidin Extraction from Grape Seed[J].Food Science,2011,32(20):89-94.
[5]Kidd P M.Bioavailability and activity of phytosome complexes from botanical polyphenols:the silymarin curcumin green tea and grape seedextracts[J].Alternative Medicine Review,2009,14(3):223-226.
[6]Nassiri-Asl M,Hosseinzadeh H.Review of the pharm acological effects of vitis vinifera grape and its bioactive compounds[J].Phytotherapy Research,2009,23(9):1192-1197.
[7]李彦,李鑫,刘景玲,等.鸡血藤原花青素的纯化及活性评价[J]. 食品科学,2016,37(17):45-51.
[8]孙芸,徐宝才,谷文英,等.葡萄籽原花青素的聚合度与抗氧化活性关系[J]. 食品与发酵工业,2006(10):41-46.
[9]Kidd P M.Bioavailability and activity of phytosome complexes from botanical polyphenols:the silymarin curcumin green tea and grape seedextracts[J].Alternative Medicine Review,2009,14(3):223-226.
[10]Nassiri-Asl M,Hosseinzadeh H.Review of the pharm acological effects of vitis vinifera grape and its bioactive compounds[J].Phytotherapy Research,2009,23(9):1192-1197.
[11]陈月英,王彦平,孙瑞琳,等.葡萄皮渣原花青素酶法提取工艺优化及抗氧化性研究[J]. 北方园艺,2016(16):129-132.
[12]张佳婵,王昌涛,孙宝国,等.沙棘籽粕原花青素制备、体外抗氧化及细胞活力评价[J]. 食品工业科技,2016,37(23):103-108.
[13]刘晓娜,康健,赵俊岭. 响应面超声波提取黑糯玉米原花青素的工艺研究[J]. 食品工业,2016,37(5):128-131.
[14]王芳,廖亮,黄瑜,等.双水相法提取油菜籽粕中原花青素[J]. 食品工业科技,2016,37(24):303-308.
[15]李春阳,许时婴,王璋. 香草醛-盐酸法测定紫米、梗中原花青素含量的研究[J]. 食品科学,2004,25(2):157-161.
[17]韦琴,梅辉,乐薇,等.板栗壳原花青素的含量测定及其纯化工艺研究[J]. 粮食与油脂,2016,29(9):81-85.
[18]曾里,夏之宁. 超声波和微波对中药提取的促进和影响[J]. 化学研究与应用,2002(3):245-249.
[19]刘琼,王仁才,吴小燕,等. 响应面法优化超声波提取鸡蛋枣原花青素工艺[J]. 食品工业科技,2017,38(16):182-188.
[20]]陈月英,王彦平,孙瑞琳,等. 葡萄皮渣原花青素微波辅助提取工艺的优化及其抗氧化活性研究[J]. 北方园艺,2016(11):123-126.
[21]张兵兵,杨华峰,陈明舜,等. 微波、酶法双辅助提取葡萄籽原花青素及其抑菌性研究[J].现代食品科技,2017,33(8):146-154.
[22]戚向阳,黄红霞,巴文广.苹果中原花青素提取工艺的研究[J].食品工业科技,2003,24(3):63-65.

