植物乳杆菌KLDS 1.0318对小鼠免疫调节作用初步研究
蒙月月,sathi Chowdhury,shuvan kumar sarker,霍贵成
(东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
免疫是机体识别自我物质和排除异己物质的复杂的生物学反应,是在长期进化中所形成的一种保护性生理功能[1]。很多疾病和一些常见传染病在发病机理以及防治等方面都与机体的免疫机能息息相关[2]。研究表明,益生乳酸菌可刺激肠道局部免疫反应,提高机体抗体水平或巨噬细胞的活性,从而增强机体的免疫功能。但具体调节机制尚不清楚,并且这种调节作用具有菌株特异性[3]。随着人们对益生菌的关注,越来越多的研究证明益生菌作为一类食品级的微生物菌群,在防癌、抗肿瘤及增强免疫功能等方面发挥重要作用[4-5]。
我国是最早利用乳酸菌发酵食品的国家之一[6],拥有丰富的传统发酵食品,蕴藏着大量的乳酸菌资源。其与双歧杆菌属的不同物种,及其它一些微生物物种作为益生菌广泛应用[7],存在于机体肠道中并在食品中广泛应用的乳杆菌种主要有:卷曲乳杆菌(Lactobacilluscrispatus)、格氏乳杆菌(Lactobacillusgassed)、植物乳杆菌(Lactobacillusplantarum)[8]。
植物乳杆菌主要存在于奶油、肉类及蔬菜发酵制品中[9],由于大部分菌株从植物中分离得到,因此得名植物乳杆菌。其菌落形状独特,有杆状和链状[10]。植物乳杆菌能发酵大部分糖类物质如果糖、核糖和葡萄糖酸等[11],而且大部分反应特性呈阴性如接触酶、VP反应等。相比于其他乳酸菌,植物乳杆菌活菌数较高,产酸性能好,能够维持稳定pH[12]。植物乳杆菌KLDS 1.0318是本实验室保藏的一株益生菌,研究表明,它对于离体小鼠的免疫细胞活性具有良好的促进作用[13]。为了进一步研究其对体内免疫调节作用的影响,本实验选用健康的BALB/c小鼠为实验动物,通过评价植物乳杆菌KLDS 1.0318对小鼠免疫脏器指数和免疫细胞的调节作用,为其进一步深入开发研究提供理论基础。
1 材料与方法
1.1 材料与仪器
植物乳杆菌KLDS 1.0318 东北农业大学乳品科学教育部重点实验室分离纯化并保藏;BALB/c小鼠,雌性,清洁级,6~8周龄,初始体重18~20 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK2012-0001;Man-Rogosa-Sharp(MRS)液体培养基;RPMI-1640培养液 美国Hyclone公司;胎牛血清 Vitrocell公司;刀豆蛋白(ConA)、台盼蓝染色液、中性红染色液、红细胞裂解液、Hank’s液 Solarbio公司;CellCountingKit-8(CCK-8试剂盒) 日本同仁化学研究所;蛋白胨、酵母粉、牛肉膏、葡萄糖等均为生化分析纯。
DHP-9272型电热恒温培养箱 上海一恒科技有限公司;LDZF-50KB-II立式压力蒸汽灭菌器 上海申安医疗器械厂;HF90型CO2培养箱 香港力康发展有限公司;Model 680型酶标仪 美国Beckman公司;PL2002型及AL104型电子天平 梅特勒-托利多仪器(上海)有限公司;20~200、100~1000 μL可调定量移液枪 德国Eppendorf公司;96孔培养板 美国NEST公司;AE-30倒置生物显微镜 麦克奥迪实业集团有限公司;VD-1320型洁净工作台 北京东联哈尔仪器制造有限公司;LD4-2型低速离心机 北京医用离心机厂。
1.2 实验方法
1.2.1 MRS液体培养基的配制 具体配制方法参照文献[14]。
1.2.2 乳酸菌的制备及剂量选择 将实验菌株以2%的接种量接种至MRS培养基中,37 ℃培养至生长稳定期(16 h),将菌液在4 ℃条件下5000 r/min离心10 min后,用无菌0.01 mol/L、pH7.4 PBS重悬菌沉淀,重复两次,弃去上清液,再用PBS调整活菌数为1×109CFU/mL的菌液,每组每天灌胃活菌液1次,灌胃周期为20 d。高剂量组:1×109CFU/只(该剂量为人体推荐剂量的10倍);中剂量组:1×108CFU/只;低剂量组:1×107CFU/只。
1.2.3 动物分组及饲养方式 40只BALB/c小鼠,雌性,在动物房中适应性饲养3 d后待体重均达(20±2) g,将小鼠随机分为4组,每组10只,分别为正常对照组、乳杆菌高剂量组、乳杆菌中剂量组、乳杆菌低剂量组。每组每天于上午10:00进行灌胃1次,灌胃周期为20 d,鼠房保持饲养环境温度(23±2) ℃,每天人工灯光照明12 h,所有小鼠饲喂基础日粮,自由饮水。最后一次灌胃后第二天,摘除眼球采血处死小鼠。
1.2.4 免疫指标测定方法
1.2.4.1 免疫器官指数的测定 灌胃结束后,断颈椎处死小鼠,迅速取出脾脏和胸腺,将周围组织剥离干净,用滤纸吸净组织表面血液使用电子天平进行称重。按下式计算免疫器官指数(immune organs index,IOI)[15]:
1.2.4.2 脾淋巴细胞增殖活性的测定 (a)小鼠脾细胞悬液制备:以颈椎脱臼法处死小鼠,用75%乙醇浸泡小鼠3~5 min,沿腹腔中线剪开小鼠胸腔,取出脾脏置于培养皿中,剪去脂肪和筋膜组织,用RPMI1640培养液漂洗,用注射器芯轻轻挤压,用200目尼龙网过滤到玻璃离心管中,用无菌PBS 1500 r/min离心5 min洗涤细胞2次,加入红细胞裂解液到洗过的细胞中,静置2 min,以除去血红细胞,再用RPMI1640培养液离心洗涤细胞2次。将上述收集到的脾脏细胞置于玻璃培养瓶中,在37 ℃、5% CO2培养箱中静止培养24 h,以除去贴壁细胞,收集未贴壁的细胞悬液即获得脾脏淋巴细胞。计数接种培养,台盼蓝染色计数,活细胞数应大于95%,最后以完全RPMI-1640培养基调节脾细胞数为1×106个/mL备用[16]。
(b)ConA诱导的脾细胞增殖实验:在96孔培养液板上加200 μL/孔脾细胞悬液,同时加20 μL/孔ConA(终浓度为5 μg/mL),细胞在37 ℃、5% CO2培养箱中培养48 h[17],加入20 μL/孔CCK-8溶液,继续培养4 h,振荡混匀;然后在酶标仪上450 nm处测定各孔吸光值。
1.2.4.3 NK细胞活性实验 (a)效应细胞制备:按照1.2.4.2(a)的方法制备脾细胞,用含10%胎牛血清RPMI-1640完全培养液调整细胞浓度为1×106个/mL备用。(b)靶细胞的制备:以YAC-1细胞作为靶细胞,将已传代的靶细胞用含10%胎牛血清RPMI-1640完全培养液调整细胞浓度为1×104个/mL备用。(c)NK细胞活性检测:将脾细胞(效应细胞)和靶细胞各100 μL/孔接种于96孔板,作为反应对照孔(C),效应细胞孔(B)加效应细胞和RPMI-1640完全培养液各100 μL,靶细胞自然释放孔(A)加靶细胞和RPMI-1640完全培养液各100 μL,以加入无血清的RPMI-1640培养液200 μL作为对照孔(调零孔)。细胞在37 ℃、5% CO2培养箱中培养20 h,加入15 μL/孔CCK-8溶液,继续培养4 h,振荡混匀;之后用酶标仪在450 nm处测定各孔吸光值[18-19]。按下列方式计算NK细胞活性:NK细胞活性(%)=(A+B-C)/A×100
1.2.4.4 腹腔巨噬细胞吞噬能力的测定
(a)腹腔巨噬细胞的制备:小鼠眼球放血,颈椎脱白处死后,置于75%乙醇溶液中浸泡3~5 min以消毒皮肤,暴露出腹膜壁,酒精擦洗腹部后,用无菌注射器抽10 mLHank’s液,注入腹腔中,敲打轻柔2 min,使腹腔巨噬细胞尽可能多地悬浮在液体中;另取一支注射器抽出腹腔悬液,收集于无菌离心管中,1000 r/min离心5 min,弃上清液;用RPMI-1640完全培养液吹打细胞使其成为单细胞悬液,血球计数板计数,确保活细胞比例不小于95%,调整细胞浓度为1×106个/mL用于实验[20]。
(b)巨噬细胞吞噬中性红能力测定:将巨噬细胞接种于96孔板(100 μL/孔),细胞在37 ℃、5% CO2培养箱中培养3 h,弃去上清液,贴壁细胞即为巨噬细胞。在每孔重新加入含10%血清的RPMI-1640培养液100 μL。细胞在37 ℃、5% CO2培养箱中培养24 h,弃去上清液,加入0.072%中性红溶液100 μL/孔,继续培养30 min,弃去中性红溶液,用PBS清洗3次以除去未被吞噬的中性红,之后加入200 μL/孔细胞裂解液(冰醋酸∶无水乙醇=1∶1,v/v),继续培养2 h,振荡混匀,用酶标仪在540 nm处测定吸光值[21]。
1.2.4.5 腹腔巨噬细胞能量代谢水平的测定 按照1.2.4.4(b)的方法接种巨噬细胞,细胞在37 ℃、5% CO2培养箱中培养24 h后,加入20 μL/孔CCK-8溶液,继续培养2 h,振荡混匀;然后在酶标仪上450 nm处测定各孔吸光值。结果以OD值表示腹腔巨噬细胞能量代谢水平[22]。
1.3 统计分析
所有实验均进行3次重复实验,采用Excel 2010软件处理实验数据及制图,并用统计软件包SPSS 22对实验结果进行显著性分析。实验数据以均数±标准差(X±S)表示,p<0.05认为差异有显著性意义。
2 结果与分析
2.1 对小鼠免疫器官指数的影响
小鼠的脾脏和胸腺重量增加,脏器指数变大,可以间接判断乳杆菌对机体免疫功能的影响。因而脾脏及胸腺指数可以作为反映机体免疫力情况的重要指标之一。分别给小鼠灌胃低、中、高剂量的乳酸菌,在第21 d摘取小鼠脾脏和胸腺,称重,计算免疫器官指数,结果见表1。由表中数据可以看出:低剂量组和中剂量组的脾脏指数与正常对照组相比无显著差异(p>0.05),而高剂量组比对照组提高了11.0%,差异显著(p<0.05)。乳酸菌三个剂量组的胸腺指数与正常对照组相比均差异显著(p<0.05),其中高剂量组提高了42.2%。实验结果表明,高剂量的植物乳杆菌KLDS 1.0318能够提高小鼠的脾脏及胸腺指数。
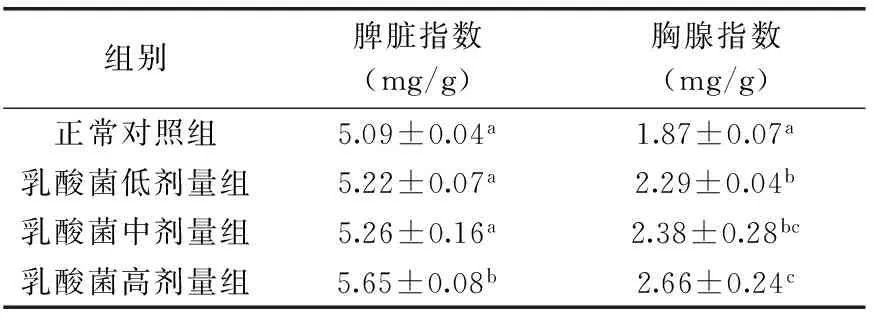
表1 植物乳杆菌KLDS 1.0318对小鼠脾脏指数和胸腺指数的影响Table 1 The effect of Lactobacillus plantarumKLDS 1.0318 on spleen and thymus index in mice
2.2 小鼠脾淋巴细胞增殖的影响
脾淋巴细胞中含有机体的免疫活性细胞:T、B淋巴细胞,它们是免疫系统结构和功能的核心,既负责介导机体的细胞免疫应答,又能够调节机体其他免疫细胞的功能[23]。其增殖的高低可以反映出机体的细胞免疫水平。
本实验以健康小鼠为研究对象,评估植物乳杆菌KLDS 1.0318对小鼠脾淋巴细胞增殖作用的影响,结果如图1所示。由图中数据可以看出:与正常对照组相比,中剂量组和高剂量组能够促进脾淋巴细胞增殖,差异显著(p<0.05),吸光值分别增加了38.4%和76.2%。而低剂量组与正常对照组的吸光值无显著差异(p>0.05)。分析结果表明,植物乳杆菌KLDS 1.0318可以提高小鼠脾淋巴细胞转化能力,具有体内免疫活性。

图1 植物乳杆菌KLDS 1.0318对小鼠脾淋巴细胞增殖的影响Fig.1 Effects of Lactobacillus plantarum KLDS 1.0318 on proliferation of spleen lymphocytes in mice注:相同字母表示组间没有显著性差异,不同字母之间表示组间存在显著差异(p<0.05),图2~图4同。
2.3 对小鼠NK细胞活性的影响
NK细胞是淋巴细胞细胞毒性的主要代表细胞群,在抗肿瘤和抗病毒免疫过程中起重要作用。植物乳杆菌KLDS 1.0318各剂量组对小鼠NK细胞活性的影响如图2所示,图中数据表明:与正常对照组小鼠相比,乳酸菌各剂量组均能不同程度提高小鼠的NK细胞活性,且差异显著(p<0.05)。实验结果表明,植物乳杆菌KLDS 1.0318可以提高正常小鼠NK细胞活性,具有体内免疫活性。

图2 植物乳杆菌KLDS 1.0318对小鼠NK细胞活性的影响Fig.2 Effects of Lactobacillus plantarum KLDS 1.0318 on NK cell activity in mice
2.4 对小鼠腹腔巨噬细胞吞噬能力的影响
巨噬细胞是机体发挥非特异性免疫反应的主要免疫细胞,参与机体免疫系统的第一道防线,因此,小鼠腹腔巨噬细胞的吞噬能力是衡量机体非特异性免疫功能的重要指标之一。本实验采用中性红吞噬实验检测了植物乳杆菌KLDS 1.0318对健康小鼠巨噬细胞吞噬作用的影响,结果如图3所示。由图中数据可以看出:与正常对照组小鼠相比,中、高剂量的植物乳杆菌均能明显提高巨噬细胞吞噬中性红能力,差异显著(p<0.05),低剂量组与对照组的吞噬能力差异不显著(p>0.05),分析结果表明,植物乳杆菌KLDS 1.0318具有体内免疫活性,能够增强巨噬细胞吞噬功能,并呈现有剂量依赖关系。

图3 植物乳杆菌KLDS 1.0318对小鼠腹腔巨噬细胞吞噬能力的影响Fig.3 Effects of Lactobacillus plantarum KLDS 1.0318 on uptake by mice peritoneal macrophages
2.5 对小鼠腹腔巨噬细胞能量代谢水平的影响
植物乳杆菌KLDS 1.0318的不同剂量对小鼠腹腔巨噬细胞能量代谢水平的影响如图4所示。由图中数据可以看出:乳酸菌各剂量组小鼠腹腔巨噬细胞能量代谢水平均有不同程度的提高,低剂量组与正常对照组比较差异不显著(p>0.05),中、高剂量组的光密度值与正常对照组相比分别提高了44.8%和66.0%,差异显著(p<0.05)。分析结果表明,植物乳杆菌KLDS 1.0318具有体内免疫活性,能够增强巨噬细胞能量代谢水平,并呈现有剂量依赖关系。

图4 植物乳杆菌KLDS 1.0318对小鼠腹腔巨噬细胞吞噬能力的影响Fig.4 Effects of Lactobacillus plantarum KLDS 1.0318 on energy metabolism of peritoneal macrophages in mice
3 结论与讨论
脾脏和胸腺均是机体主要的免疫器官,其中脾脏是机体最大的外周淋巴器官,是B淋巴细胞的主要定居地,参与机体体液免疫。而胸腺属于中枢免疫器官,是T淋巴细胞分化和成熟的场所,主要参与细胞免疫。脾脏和胸腺指数是衡量机体免疫功能的初级指标。免疫增强剂可使脾脏和胸腺质量增加,因此,脾脏和胸腺可以作为衡量机体免疫功能的基础指标之一[24],胸腺和脾脏指数能有效的反映免疫器官的发育和免疫细胞的功能状况,从而间接反映机体的免疫水平。托娅[25]通过研究表明,乳杆菌Lb.caseiZhang活菌中、高剂量组能够明显增加小鼠脾脏指数,从而具有提高小鼠机体免疫机能的功效。谢俊华[26]通过体内实验研究,发现植物乳杆菌NCU116能显著提高免疫低下小鼠的脾脏指数和胸腺指数,同时有效地增加小鼠免疫细胞的数量,提高细胞因子的分泌水平及相应的mRNA表达水平。本研究中,植物乳杆菌KLDS 1.0318低剂量组和中剂量组的脾脏指数与正常对照组相比无显著差异(p>0.05),但高剂量组能够明显提高小鼠脾脏指数。乳酸菌各剂量组的胸腺指数与正常对照组相比均差异显著(p<0.05)。表明了植物乳杆菌KLDS 1.0318具有提高小鼠机体免疫机能的功效。
淋巴细胞增殖实验是检测T细胞免疫功能的方法,其增殖率可直接反映细胞免疫功能状态。T淋巴细胞的激活、分化和增殖在免疫应答过程中起着重要的作用。刘东方[27]利用鼠李糖乳杆菌LV108和短双歧杆菌XJH301菌悬液及发酵乳对小鼠进行灌胃四周,通过MTT法测定脾淋巴细胞增殖反应,结果表明上述两株菌菌悬液及发酵乳均能够促进脾淋巴细胞增殖,显示出明显的免疫刺激作用。NK细胞也属于淋巴细胞,主要存在于外周血和脾中,不依赖抗体也不需要抗原刺激和致敏就能杀伤靶细胞[22]。干酪乳杆菌被发现能够活化T细胞,促使细胞毒性T细胞(Tc)的产生,增强自然杀伤(NK)细胞的活性,同时能够调节巨噬细胞-集落形成细胞的增殖过程[28]。本实验采用CCK-8法,它是用于测定细胞增殖或细胞毒性实验中活细胞数目的一种高灵敏度,无放射性的比色检测法。结果表明,植物乳杆菌KLDS 1.0318的中、高剂量能够协同ConA刺激小鼠脾淋巴细胞增殖,同时能够提高小鼠NK细胞的免疫活性,显示出一定的免疫促进作用,且与剂量呈正相关。
巨噬细胞是机体重要的免疫调节和效应细胞,在机体许多的生理和病理反应过程中发挥着重要的作用。巨噬细胞能够吞噬和消除多种病原微生物,并通过胞内溶酶体等消化清除多种致病物质,此外,巨噬细胞还具有较强的抗原处理以及递呈能力,并能通过分泌多种细胞因子发挥免疫调节和介导炎症反应,是维持机体内环境稳定的一个重要系统[29]。孙进等[30]分析了植物乳杆菌Lp6对小鼠免疫系统的作用机理,结果表明该菌可以不同程度的增强小鼠腹腔巨噬细胞的吞噬活性。刘佳等[31]研究表明了硒化乳酸菌胞外多糖能够显著提高巨噬细胞吞噬活性,有助于机体增强机体免疫反应。本实验研究结果也证明了植物乳杆菌KLDS 1.0318的中、高剂量能够显著提高小鼠巨噬细胞吞噬中性红能力及其能量代谢水平(p<0.05)。
综上所述,植物乳杆菌KLDS 1.0318能够作用于小鼠免疫器官,提高了小鼠的脾脏和胸腺指数,同时能够增强免疫细胞活性,促进脾淋巴细胞增殖,增强小鼠NK细胞对YAC-1靶细胞的杀伤活性,提高小鼠巨噬细胞吞噬中性红能力及其能量代谢水平,说明植物乳杆菌KLDS 1.0318可以通过促进机体的特异性免疫和非特异性免疫功能来增强机体的免疫作用。但其对于相关免疫分子、信号通路以及肠道菌群结构的影响还有待深入研究。
[1]王重庆. 分子免疫学基础[M].第三次印刷. 北京:北京大学出版社,2003.
[2]蔡宝祥. 家畜传染病学[M]. 北京:中国农业出版社,2001.
[3]张丽. 传统发酵牦牛奶中益生乳杆菌筛选及其免疫调节功能研究[D]. 兰州:甘肃农业大学,2011.
[4]Gibson G R,Hutkins R,Sanders M E,et al. Expert consensus document:The International Scientific Association for Probiotics and Prebiotics(ISAPP)consensus statement on the definition and scope of prebiotics[J]. Nature Reviews Gastroenterology & Hepatology,2017.
[5]Patel S,Shukla R,Goyal A. Probiotics in valorization of innate immunity across various animal models[J]. Journal of Functional Foods,2015,14(21):549-561.
[6]骆承庠. 乳与乳制品工艺学[M]. 北京:中国农业出版社,1999.
[7]Boyle R J,Tang M L. The role of probiotics in the management of allergic disease[J]. Clinical & Experimental Allergy Journal of the British Society for Allergy & Clinical Immunology,2006,36(5):568.
[8]Çataloluk O,Gogebakan B. Presence of drug resistance in intestinal lactobacilli of dairy and human origin in Turkey[J]. Fems Microbiology Letters,2004,236(1):7-12.
[9]Vries M C D,Vaughan E E,Kleerebezem M,et al.Lactobacillusplantarum-survival,functional and potential probiotic properties in the human intestinal tract[J]. International Dairy Journal,2006,16(9):1018-1028.
[10]曲冬梅,刘小杰.植物乳杆菌及其在食品工业中的应用[J].中国食品添加剂,2008(c00):219-222.
[11]肖仔君,钟瑞敏,陈惠音,等.植物乳杆菌的研究进展[J].现代食品科技,2004,20(b11):85-86.
[12]谢全喜,张建梅,谷巍. 植物乳杆菌对肉鸡生长性能、免疫功能和抗氧化能力的影响[J]. 中国饲料,2013(14):26-30.
[13]蒙月月,赵莉,霍贵成. 体外评估十株乳杆菌对免疫细胞活性的影响[J/OL]. 食品工业科技,:1-9(2017-09-13). http://kns.cnki.net/kcms/detail/11.1759. TS.20170913. 0946. 030.html.
[14]Bian X,Evivie S E,Muhammad Z,et al. assessment of the antimicrobial potentials of strains isolated from traditional cheese in Sinkiang China against food-borne pathogens[J]. Food & Function,2016,7(2):789-797.
[15]Xu C L,Wang Y Z,Jin M L,et al. Preparation,characterization and immunomodulatory activity of selenium-enriched exopolysaccharide produced by bacterium Enterobacter cloacae,Z0206[J]. Bioresource Technology,2009,100(6):2095-2097.
[16]季宇彬,高世勇,冯小燕,等. 甜菜碱促进小鼠脾淋巴细胞增殖作用的钙通道机制研究[J]. 中国中药杂志,2009,34(15):1959-1963.
[17]Peng S,Yang Y,Li S,et al. Immunomodulatory activities of Lactobacillus rhamnosus,ZDY114 and donkey milk in BALB/c mice[J]. International Dairy Journal,2014,34(2):263-266.
[18]Yuan C F,Wang C D,Bu Y Q,et al. Antioxidative and immunoprotective effects of Pyracantha fortuneana(Maxim.)Li polysaccharides in mice.[J]. Immunology Letters,2010,133(1):14-18.
[19]Joh E H. HY7213 ameliorates cyclophosphamide-induced immunosuppression in mice by activating NK,cytotoxic t cells and macrophages[J]. Immunopharmacol Immunotoxicol,2013,35(3):396-402.
[20]Joh E H,Lee I A,Jung I H,et al. Ginsenoside Rb1 and its metabolite compound K inhibit IRAK-1 activation-the key step of inflammation[J]. Biochemical Pharmacology,2011,82(3):278-286.
[21]Ren D,Li C,Qin Y,et al. Evaluation of immunomodulatory activity of two potential probiotic Lactobacillus strains byinvivotests[J]. Anaerobe,2015,35(Pt B):22-27.
[22]李敬双,刘英姿,唐雨顺,等. 苜蓿多糖对小鼠淋巴细胞增殖和NK细胞活性影响的研究[J]. 中国农学通报,2012,28(32):89-93.
[23]常桂芳. 乳酸菌黏附派伊尔结及免疫调节作用研究[D]. 无锡:江南大学,2009.
[24]陈奇. 中药药理研究方法学[M].北京:人民卫生出版社,2011.
[25]托娅. 益生菌Lactobacillus casei Zhang免疫调节和抗肿瘤作用及机理研究[D]. 呼和浩特:内蒙古农业大学,2008.
[26]谢俊华. 植物乳杆菌NCU116对肠道健康的影响[D]. 南昌:南昌大学,2016.
[27]刘东方. 人源乳酸菌筛选及其对小鼠免疫调节作用的研究[D]. 扬州:扬州大学,2016.
[28]Yan F,Polk D B. Probiotics and immune health.[J]. Current Opinion in Gastroenterology,2011,27(6):496-501.
[29]Gil D,Garcia L F,Rojas M. Modulation of macrophage apoptosis by antimycobacterial therapy:physiological role of apoptosis in the control of Mycobacterium tuberculosis[J]. Toxicology & Applied Pharmacology,2003,190(2):111-119.
[30]孙进,乐国伟,侯丽霞,等. 一株植物乳杆菌内化于小鼠回肠派伊尔结及其免疫调节作用的研究[J]. 免疫学杂志,2008,24(1):49-52.
[31]刘佳,潘道东. 硒化乳酸菌胞外多糖对小鼠腹腔巨噬细胞免疫功能的影响[J]. 营养学报,2013,35(1):35-38.

