抗AGR2单克隆抗体18A4抑制细胞外AGR2诱导的肿瘤细胞活性
于天弘,Siva Bharath MERUGU#,Hema NEGI#,孙宋暄,丁云鹤,武正华*,李大伟,3**
(上海交通大学 1药学院,上海200240;2生物医学工程学院;3细胞工程及抗体药物教育部工程研究中心,上海200240)
前梯度蛋白2(anterior gradient2,AGR2)是蛋白二硫键异构酶(protein disulfide isomerase,PDI)家族的成员,具有促进蝾螈断肢再生[1]、皮肤伤口愈合[2]和在胰腺组织再生的过程中激活表皮生长因子受体信号通路等作用[3]。AGR2也是一种肿瘤相关蛋白,在乳腺癌、胰腺癌、前列腺癌、肺癌、卵巢癌等肿瘤组织中过表达[4-8]。细胞内AGR2在肿瘤中与肿瘤增殖、存活、迁移、黏附、不良预后、耐药等特性息息相关[9-12]。另外,在肿瘤组织中,AGR2可以被分泌至细胞外并能在肿瘤病人的血液和尿液中被检测到[13-14]。细胞外的AGR2是肿瘤微环境中的重要参与者,已知的功能有导致前列腺基质细胞的程序性死亡[15],影响上皮细胞的极性和黏附,引起上皮-间充质转化(epithelial-mesenchymal transition,EMT)[16],与血管内皮生长因子(vascular endothelial growth factor,VEGF)、成纤维细胞生长因子(fibroblast growth factor,FGF)结合,增强 VEGF和 FGF形成二聚体的能力,继而促进血管内皮细胞和成纤维细胞向肿瘤组织迁移,引起血管生成[17]。这些特性都说明AGR2是一个潜在的抗肿瘤靶点。
本课题组通过杂交瘤技术制备了以AGR2为靶点的单克隆抗体,命名为18A4[18]。初步药效实验发现,18A4能够抑制AGR2表达阳性的乳腺癌细胞的生长和迁移[19],通过抑制血管生成的功能减缓了SKOV3卵巢癌细胞的裸鼠移植瘤的生长[17,20]。但18A4的药理活性研究仍然存在拓展的空间。本研究运用两种自身不表达AGR2的黑色素瘤细胞,将AGR2蛋白和18A4同时作用于细胞,观察18A4抗体能否抑制细胞外AGR2引起的肿瘤细胞活性。
1 材 料
1.1 试 剂
单克隆抗体18A4,His标签AGR2蛋白由本实验室构建、表达、纯化[2,18]。人黑色素瘤细胞 A375,小鼠黑色素瘤细胞B16-F10购自美国ATCC中心。DMEM基础培养基(美国Gibco公司);胎牛血清、青霉素-链霉素混合液;MTT、结晶紫(索莱宝生物科技有限公司);细胞周期与细胞凋亡试剂盒(碧云天生物技术研究所);罗丹明标记鬼笔环肽、DAPI(美国Millipore公司);兔抗人p53抗体(美国Proteintech公司);鼠抗β-actin抗体(美国Santa Cruz Biotechnology公司);IRDye 680CW标记的羊抗兔抗体、IRDye 800CW标记的羊抗鼠抗体(美国Odyssey公司);Dylight488,Dylight594标记的羊抗兔抗体(联科生物有限公司)。
1.2 仪 器
FACSCalibur流式细胞仪(美国BD公司);酶标仪(美国Thermo Fisher Scientific公司);激光共聚焦显微镜(德国徕卡公司);Odyssey双色红外激光成像仪(美国Li-Cor有限公司)。
2 方 法
2.1 细胞培养
A375和B16-F10细胞分别在含10%胎牛血清,1%青霉素-链霉素混合液的DMEM培养基,37℃、含5%CO2的培养箱中培养。取对数期生长的细胞进行实验。细胞增殖、细胞周期、细胞迁移、细胞形态观察实验分成空白对照组和AGR2组(50,100 ng/mL);18A4组(20μg/mL)及 AGR2+18A4组(100 ng/mL AGR2+20μg/mL 18A4)。Western blot和免疫荧光实验分成空白对照组和阿霉素组(1μmol/L);阿霉素+AGR2组(1μmol/L阿霉素 +100 ng/mL AGR2)及阿霉素 +AGR2+18A4组(1μmol/L阿霉素 +100 ng/mL AGR2+20μg/mL 18A4)。
2.2 MTT法检测AGR2和18A4抗体对A375和B16-F10细胞增殖的影响
取对数生长期细胞,以每孔5×103个细胞接种于96孔板。37℃、5%CO2培养24 h,加药,每组设8个复孔。培养24 h后每孔加入5 mg/mL MTT 20μL,继续培养4 h。吸去培养基,每孔加入DMSO 150μL,振荡10 min使结晶溶解。酶标仪测定490 nm下的吸收度,计算细胞生长的抑制率:抑制率=(对照组吸收度的平均值-实验组吸收度的平均值)/(对照组吸收度的平均值)×100%。
2.3 克隆形成实验测AGR2和18A4抗体对A375和B16-F10细胞增殖的影响
取对数生长期细胞,以每孔2×103个细胞接种于6孔板。37℃、5%CO2培养24 h,加药。37℃、5%CO2培养10 d。吸去培养基,PBS洗涤后每孔加入0.5%结晶紫500μL,染色30 min。PBS洗涤,拍照,计数。
2.4 流式细胞仪检测AGR2和18A4抗体对A375和B16-F10细胞周期的影响
取对数生长期细胞,以每孔5×105个细胞接种于6孔板。37℃、5%CO2培养24 h,加药。37℃、5%CO2培养24 h。胰酶消化收集所有细胞,70%乙醇固定过夜。PBS洗涤后PI染色,37℃避光水浴30 min,流式细胞仪检测细胞周期。
2.5 划痕实验检测AGR2和18A4抗体对A375和B16-F10细胞迁移的影响
取对数生长期细胞,以每孔1×106个细胞接种于6孔板。37℃、5%CO2培养至细胞长满。换成0.5%胎牛血清的DMEM培养基刺激24 h。用200μL枪头在孔内划痕,PBS洗涤后加药,37℃、5%CO2培养24 h。在0 h和24 h,每个划痕拍照4张,分析两个时间点上划痕宽度的变化。
2.6 鬼笔环肽染色检测AGR2和18A4抗体对A375和B16-F10细胞形态的改变
取对数生长期细胞,以每孔2×105个细胞接种于含细胞爬片的12孔板。37℃、5%CO2培养24 h。加药,继续培养24 h。PBS洗涤后取细胞爬片,4%多聚甲醛固定15 min,PBS洗涤后加罗丹明交联的鬼笔环肽,避光染色45 min。PBS洗涤,DAPI避光染色5 min。抗荧光淬灭剂封片,激光共聚焦显微镜镜检,拍照。
2.7 Western blot检测 AGR2和 18A4抗体对A375和B16-F10细胞中p53表达量的影响
取对数生长期细胞,以每孔1×106个细胞接种于6孔板。37℃、5%CO2培养24 h。加药,继续培养24 h。胰酶消化收集所有细胞,PBS洗涤后加入预冷、含蛋白酶抑制剂的NP40细胞裂解液裂解,每个样品中加入等体积的5×上样缓冲液,混匀,95℃水浴5 min,-20℃储存备用。样品经10%SDS-PAGE分离,将分离的蛋白电转移至硝酸纤维素膜上,恒流300 mA转膜1 h。在5%脱脂奶中室温振荡封闭1 h。加1∶1 000稀释的兔抗人p53抗体,鼠抗β-actin抗体,4℃孵育过夜,TNET溶液洗膜10 min×3次。加1∶5 000稀释的IRDye 680CW标记的羊抗兔抗体或IR Dye 800CW标记的羊抗鼠抗体,室温孵育1 h,TNE-T溶液(10 mmol/L Tris-base,2.5 mmol/L EDTA-2Na,50 mmol/L NaCl,0.1%Tween-20)洗膜 10 min×3次。双色红外激光成像仪扫膜,用Quantity One软件分析蛋白条带的深浅。
2.8 免疫荧光分析AGR2和18A4抗体对A375和B16-F10细胞中p53表达量的影响
取对数生长期细胞,以每孔2×105个细胞接种于含细胞爬片的12孔板。37℃、5%CO2培养24 h。加药,继续培养24 h。PBS洗涤后取细胞爬片,4%多聚甲醛固定15 min,0.1%Triton X-100通透15 min,5%羊血清封闭1 h。加1∶200稀释的兔抗人p53抗体,室温孵育2 h,PBS洗涤。加1∶500稀释的 Dylight488或Dylight594标记的羊抗兔抗体,室温避光孵育1 h,PBS洗涤。DAPI避光染色5 min,抗荧光淬灭剂封片,激光共聚焦显微镜镜检,拍照。
2.9 数据分析
用GraphPad Prism 5软件进行数据统计学分析,对两组样本采用Student′sT-test比较差异显著性。P<0.05表示有显著性差异。
3 结 果
3.1 18A4抗体对胞外AGR2引起的细胞增殖加快的抑制作用
运用MTT实验测定细胞外AGR2和18A4对两种黑色素瘤细胞A375和B16-F10增殖的影响。结果发现,加入50 ng/mL AGR2刺激24 h仅显著加快B16-F10的增殖,而100 ng/mL AGR2能同时显著提高A375和B16-F10细胞的增殖,分别高于对照组生长率(34.74±7.69)%和(29.87±5.02)%。而在加入100 ng/mL AGR2的基础上加入20μg/mL 18A4,与 AGR2组相比,两种细胞的生长率均有显著的降低,分别降低了(43.99±5.93)%和(33.63±6.48)%,如图1所示。
用克隆形成实验再次验证MTT实验的现象。与对照组相比,100 ng/mL AGR2单独作用后,A375和B16-F10细胞形成克隆的数量分别显著增加了(49.00±7.12)%和(36.67±7.77)%。而在100 ng/mL AGR2和20μg/mL 18A4同时作用的条件下,A375和B16-F10细胞形成克隆的数量与AGR2组相比分别减少了(32.00±8.64)%和(27.33±8.50)%,如图1C,1D所示。两项实验均表明18A4抗体能抑制胞外AGR2引起的肿瘤细胞增殖加快。

Figure 1 Monoclonal antibody 18A4 blocked the proliferation enhancement induced by extracellular AGR2 in melanoma cells(¯x±s,n=3)A:MTT assay of AGR2 and mab 18A4 on the proliferation of A375 cells;B:MTT assay of AGR2 andmab 18A4 on the proliferation of B16-F10 cells;C:Colony formation assay of A375 and B16-F10 cells treated with AGR2,18A4 or a combination of them;D:Quantification of colony numbers in histograms*P<0.05,**P<0.01,***P<0.001 vs control group,#P<0.05;###P<0.001 vs AGR2 group
3.2 18A4抗体对胞外AGR2引起的细胞周期改变的抑制作用
细胞增殖与细胞周期调控密切相关,故通过流式细胞仪检测胞外AGR2与18A4抗体对两种黑色素瘤细胞周期的影响。与对照组相比,AGR2组细胞的G1期比例分别减少了(10.02±1.92)%和(7.73±1.70)%,S期比例分别增加了(9.09±1.85)%和(8.01±1.23)%,统计结果表明 AGR2组与对照组存在显著性差异。所以胞外AGR2能引起肿瘤细胞G1/S细胞周期转化。而与AGR2组相比,AGR2+18A4组细胞的G1期比例分别增加了(7.39±1.37)%和(7.60±1.40)%,S期比例分别减少了(6.78±1.12)%和(6.76±0.78)%,统计结果表明AGR2+18A4组与AGR2组存在显著性差异,如图2所示。所以18A4抗体能抑制胞外AGR2引起的G1/S细胞周期转化。

Figure 2 Monoclonal antibody 18A4 hindered the cell cycle transition induced by extracellular AGR2 in melanoma cells(¯x±s,n=3)A:Flow cytometry analysisof AGR2 andmab 18A4 on the cell cycle of A375 cells;B:Flow cytometry analysisof AGR2 andmab 18A4 on the cell cycle of B16-F10 cells;C:Statistical analysis of G1 and S phase distributions in histograms*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs AGR2 group
3.3 18A4抗体对胞外AGR2引起的细胞迁移加快和细胞形态变化的抑制作用
通过细胞划痕实验分析胞外AGR2和18A4抗体对细胞迁移的影响。结果表明,AGR2组细胞的迁移速度分别比对照组细胞提高了(27.88±8.61)%和(49.81±10.64)%,两组间有显著性差异。而AGR2+18A4组细胞的迁移速度分别比AGR2组细胞降低了(21.21±8.36)%和(40.21±10.22)%,两组间有显著性差异,如图 3A~3D所示。
细胞迁移与细胞形态的变化相关,进一步用鬼笔环肽染色法观察AGR2和18A4抗体对两种黑色素瘤细胞形态的影响。研究发现与对照组上皮细胞形态相比,AGR2组的细胞均呈现成纤维细胞的形态,而AGR2+18A4组的细胞仍然维持上皮细胞的形态(图3E,3F),说明胞外AGR2能够改变肿瘤细胞的形态,而18A4抗体能抑制 AGR2的这一作用。
3.4 18A4抗体对胞外AGR2引起的p53表达量变化的抑制作用
选择检测抑癌基因p53的表达量来观察胞外AGR2和18A4抗体对细胞信号的影响。为了更清晰地观察p53表达量的变化,加入1μmol/L阿霉素来增加p53的表达量。Western blot结果显示,阿霉素组A375和B16-F10细胞的p53表达量分别达到对照组表达量的(8.41±1.91)倍和(5.90±0.94)倍,上调明显。与阿霉素组相比,阿霉素+AGR2组细胞的p53表达量又明显降低,分别是阿霉素组p53表达量的(27.33±4.15)%和(25.50±7.39)%,两组间有显著性差异,说明胞外AGR2降低了p53的表达量。而阿霉素+AGR2+18A4组细胞p53表达量与阿霉素+AGR2组相比有明显的回升,分别是阿霉素+AGR2组p53表达量的(3.22±0.57)倍和(3.85±1.09)倍,两组间有显著性差异,说明胞外AGR2对p53表达量的影响被18A4抗体中和,如图4A~4D所示。
为了再次验证Western blot的结果,进一步用免疫荧光染色法检测各组细胞的p53表达量。实验结果与Western blot的结果类似,同时在两种细胞内发现,阿霉素明显提升了荧光强度,即p53表达量。阿霉素+AGR2组细胞的荧光强度与阿霉素组相比明显回落,而阿霉素+AGR2+18A4组细胞的荧光强度又明显回升,如图4E,4F所示。Western blot和免疫荧光的结果均说明胞外AGR2引起肿瘤细胞p53表达量降低的现象能被18A4抗体所抑制。
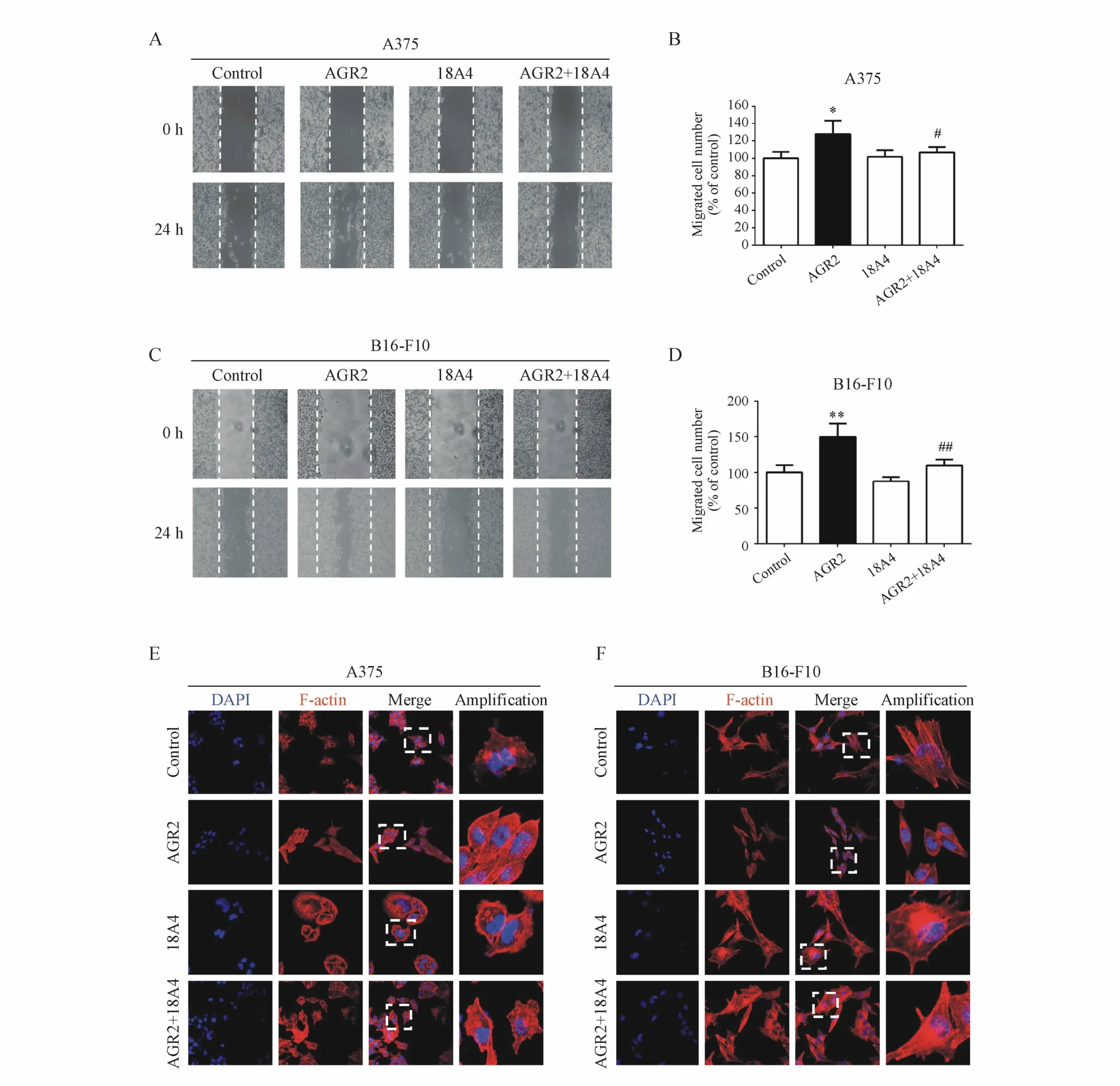
Figure 3 Monoclonal antibody 18A4 decreased themigration acceleration and morphological changes induced by extracellular AGR2 inmelanoma cellsA:Wound healing assay of AGR2 and mab 18A4 on themigration of A375 cells;B:Statistical analysis of A375 cellmigration in histograms;C:Wound healing assay of AGR2 andmab 18A4 on themigration of B16-F10 cells;D:Statistical analysisof A375 cellmigration in histograms;E:Cellmorphology staining of A375 cells with corresponding treatments;F:Cellmorphology staining of B16-F10 cells with corresponding treatments*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs AGR2 group

Figure 4 Monoclonal antibody 18A4 masked the decline of p53 expression level induced by external AGR2A:Western blot analysis of p53 expression in A375 cells with corresponding treatments;B:Western blot analysis of p53 expression in B16-F10 cells with corresponding treatments.β-actin was served as an internal control;C:Statistical analysis of the band intensities on Western blots as compared to β-actin bands in A375 cells;D:Statistical analysisof the band intensities onWestern blotsas compared toβ-actin bands in B16-F10 cells;E:Immunofluorescence assay of p53 expression in A375 cells;F:Immunofluorescence assay of p53 expression in B16-F10 cells*P<0.05 vs control group;#P<0.05 vs AGR2 group
4 讨 论
AGR2在多种肿瘤组织中过表达,细胞内和细胞外AGR2均与肿瘤增殖、转移、耐药等有关,所以AGR2是一个潜在的抗肿瘤靶点。虽然科学家们已经提出了若干种抑制AGR2功能的策略,但是针对AGR2的药物至今尚未出现[21]。故本研究探究了以AGR2为靶点18A4抗体能否抑制细胞外AGR2引起的肿瘤细胞活性。
首先通过MTT实验和克隆形成实验发现了18A4抗体能够抑制细胞外AGR2引起的肿瘤细胞增殖加快,并进一步检测胞外AGR2与18A4对细胞周期的影响。敲降细胞内AGR2能够让乳腺癌和前列腺癌细胞阻滞在 G1期[22-23],但胞外 AGR2能否影响细胞周期还是未知的。本研究中细胞周期检测结果说明胞外AGR2的刺激能够减少G1期细胞,增加S期细胞。更重要的,胞外AGR2对肿瘤细胞周期的调控能被18A4抗体抑制。
AGR2与肿瘤细胞的迁移有着紧密的联系。敲降胞内AGR2可减慢肿瘤细胞的侵袭性,反之,将AGR2转染入肿瘤细胞,细胞的迁移能力明显增强[8,24-25]。同样的,胞外 AGR2促进了上皮细胞的迁移,引起 EMT,加快伤口愈合[2,16]。所以本研究通过划痕实验和细胞形态染色检测18A4能否缓解胞外AGR2导致的肿瘤细胞迁移加快和细胞形态变化。本研究结果证实18A4抗体具有减缓胞外AGR2引起的细胞迁移加快和形态变化。
p53是经典的抑癌基因,超过半数的肿瘤组织中存在p53的突变和缺失[26]。Hrstka等[27]发现胞内AGR2通过双特异性磷酸酶10(DUSP10,dual specificity protein phosphatase 10)的调控降低p53的活性,但胞外AGR2能否影响p53的表达还是未知的。本研究用阿霉素处理肿瘤细胞以增加p53的表达量,通过Western blot和免疫荧光染色说明胞外AGR2的刺激能够降低 p53的表达量,而18A4抗体能够稳定p53的表达量,抑制AGR2对p53表达量的影响。
综上所述,18A4抗体能够抑制胞外AGR2引起的肿瘤细胞活性,包括增殖速度加快、G1/S细胞周期转变、迁移速度加快、细胞形态的改变和p53表达量的降低,这些结果不仅延伸了18A4的药理作用,也说明18A4是一种潜在的抗肿瘤药物。
[1] Kumar A,Godwin JW,Gates PB,et al.Molecular basis for the nerve dependence of limb regeneration in an adult vertebrate[J].Science,2007,318(5851):772-777.
[2] Zhu Q,Mangukiya HB,Mashausi DS,et al.Anterior gradient2 is induced in cutaneous wound and promotes wound healing through its adhesion domain[J].FEBS J,2017,284(17):2856-2869.
[3] Wodziak D,Dong A,Basin MF,et al.Anterior gradient 2(AGR2)induced epidermal growth factor receptor(EGFR)signaling is essential formurine pancreatitis-associated tissue regeneration[J].PLoSOne,2016,11(10):e0164968.
[4] Liu D,Rudland PS,Sibson DR,et al.Human homologue of cement gland protein,a novel metastasis inducer associated with breast carcinomas[J].Cancer Res,2005,65(9):3796-3805.
[5] Ramachandran V,Arumugam T,Wang H,et al.Anterior gradient 2 is expressed and secreted during the development of pancreatic cancer and promotes cancer cell survival[J].Cancer Res,2008,68(19):7811-7818.
[6] Zhang JS,Gong A,Cheville JC,et al.AGR2,an androgen-inducible secretory protein overexpressed in prostate cancer[J].Genes Chromosomes Cancer,2005,43(3):249-259.
[7] Fritzsche FR,Dahl E,Dankof A,et al.Expression of AGR2 in non small cell lung cancer[J].Histol Histopathol,2007,22(7):703-708.
[8] Park K,Chung YJ,So H,etal.AGR2,amucinous ovarian cancer marker,promotes cell proliferation and migration[J].Exp Mol Med,2011,43(2):91-100.
[9] Chevet E,Fessart D,Delom F,et al.Emerging roles for the prooncogenic anterior gradient-2 in cancer development[J].Oncogene,2013,32(20):2499-509.
[10]Brychtova V,Vojtesek B,Hrstka R.Anterior gradient 2:a novel player in tumor cell biology[J].Cancer Lett,2011,304(1):1-7.
[11]Li Z,Zhu Q,Hu L,et al.Anterior gradient2 is a binding stabilizer of hypoxia inducible factor-1alpha that enhances CoCl2-induced doxorubicin resistance in breast cancer cells[J].Cancer Sci,2015,106(8):1041-1049.
[12]Li Z,Zhu Q,Chen H,et al.Binding of anterior gradient2 and estrogen receptor-alpha:dual critical roles in enhancing fulvestrant resistance and IGF-1-induced tumorigenesis of breast cancer[J].Cancer Lett,2016,377(1):32-43.
[13] Bu H,Bormann S,Schafer G,et al.The anterior gradient 2(AGR2)gene is overexpressed in prostate cancer and may be useful as a urine sedimentmarker for prostate cancer detection[J].Prostate,2011,71(6):575-587.
[14]Edgell TA,Barraclough DL,Rajic A,etal.Increased plasma concentrations of anterior gradient2 protein are positively associated with ovarian cancer[J].Clin Sci(Lond),2010,118(12):717-725.
[15]Vitello EA,Quek SI,Kincaid H,et al.Cancer-secreted AGR2 induces programmed cell death in normal cells[J].Oncotarget,2016,7(31):49425-49434.
[16]Fessart D,Domblides C,Avril T,et al.Secretion of protein disulphide isomerase AGR2 confers tumorigenic properties[J].Elife,2016,5:e13887.
[17]Guo H,Zhu Q,Yu X,et al.Tumor-secreted anterior gradient-2 binds to VEGF and FGF2 and enhances their activities by promoting their homodimerization[J].Oncogene,2017,36(36):5098-5109.
[18]Wu ZH,Zhu Q,Gao GW,et al.Preparation,characterization and potential application ofmonoclonal antibody 18A4 against AGR2[J].Chin J Cell Mol Immunol(细胞与分子免疫学杂志),2010,26(1):49-51.
[19]李坤.AGR2单克隆抗体18A4抑制乳腺癌细胞的生长和迁移[D].上海:上海交通大学,2011.
[20]Guo H,Chen H,Zhu Q,et al.A humanized monoclonal antibody targeting secreted anterior gradient2 effectively inhibits the xenograft tumor growth[J].Biochem Biophys ResCommun,2016,475(1):57-63.
[21]Li K.Monoclonal18A4 against AGR2 inhibit human breast adenocarcinoma cell growth and migration[D].Shanghai:Shanghai Jiao Tong University,2011.
[22]Vanderlaag KE,Hudak S,Bald L,et al.Anterior gradient-2 plays a critical role in breast cancer cell growth and survival bymodulating cyclin D1,estrogen receptor-alpha and survivin[J].Breast Cancer Res,2010,12(3):R32.
[23]Hu Z,Gu Y,Han B,et al.Knockdown of AGR2 induces cellular senescence in prostate cancer cells[J].Carcinogenesis,2012,33(6):1178-1186.
[24]Ma SR,Mao L,Deng WW,et al.AGR2 promotes the proliferation,migration and regulates epithelial-mesenchymal transition in salivary adenoid cystic carcinoma[J].Am J Transl Res,2017,9(2):507-519.
[25]Wang Z,Hao Y,Lowe AW.The adenocarcinoma-associated antigen,AGR2,promotes tumor growth,cell migration,and cellular transformation[J].Cancer Res,2008,68(2):492-497.
[26]Hollstein M,Sidransky D,Vogelstein B,et al.p53 mutations in human cancers[J].Science,1991,253(5015):49-53.
[27]Hrstka R,Bouchalova P,Michalova E,et al.AGR2 oncoprotein inhibits p38 MAPK and p53 activation through a DUSP10-mediated regulatory pathway[J].Mol Oncol,2016,10(5):652-662.

