糖肾方对糖尿病肝损伤和肝组织中SIRT1和PGC-1α表达的影响*
杜月光, 陈伟燕, 姜雪尔, 潘 晶, 柴可夫
(浙江中医药大学基础医学院, 浙江 杭州 310053)
糖尿病肝脏病变是近年来引起重视的糖尿病(diabetes mellitus,DM)主要并发症,2型糖尿病的主要致病基础为胰岛素抵抗造成的糖脂代谢紊乱,作为糖脂代谢重要靶器官的肝脏主要表现为非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)病变,包括脂肪变性、非酒精性脂肪性肝炎、肝纤维化和肝硬化等。研究表明,沉默信息调节因子1(silent information regulator 1,SIRT1)和过氧化物酶体增殖物激活受体γ辅激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)与糖脂代谢关系密切,参与体内脂肪酸和葡萄糖的合成、代谢和输出,在糖尿病肝损伤发病过程中起着重要作用[1-2]。糖肾方(Tangshenfang,TS)是主要用于治疗糖尿病肾病的经验方,前期在临床及实验研究中发现该方具有降脂、抗氧化、抗炎和改善血流变等作用[3-4],通过文献查阅显示该方中所含多种中药有效成分对NAFLD有防治作用[5-7],但其对糖尿病肝损伤是否具有减轻作用,机制如何尚不明确?为此,本研究采用高脂高糖饮食结合低剂量链尿佐菌素(streptozotocin,STZ)诱导建立2型糖尿病大鼠模型,观察糖肾方对糖尿病肝损伤的作用及其对肝组织中SIRT1和PGC-1α表达的影响以探讨其防治机制,为本方在临床上防治糖尿病肝损伤提供实验依据。
材 料 和 方 法
1 材料
1.1实验动物及饲料 雄性清洁级SD大鼠48只,体质量在160~200 g之间,购自上海西普尔-必凯实验动物有限公司,合格证号为SCXX(沪):2008-0016。高糖高脂饲料配方为10.0%白砂糖、10.0%熟猪油、0.5%胆固醇、10.0%蛋黄粉及69.5%基础饲料,由浙江医科院制作成型及烘焙而成。
1.2实验药品 糖肾方由黄芪18 g、葛根15 g、灵芝15 g、女贞子15 g、丹参9 g和大黄6 g等药物组成,购自浙江中医药大学基础医学院门诊部,由浙江省中医院药剂室煎制成分别含生药 1×103g/L、2×103g/L和4×103g/L的浓缩液,4 ℃冰箱密封保存。
1.3主要实验试剂及仪器 STZ购自Sigma;抗PGC-1α 抗体和抗SIRT1 抗体购自Abcam;抗β-actin抗体购自Santa Cruz;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素1(interleukin-1,IL-1)ELTSA检测试剂盒购自上海森雄生物有限公司;超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)检测试剂盒购自南京建成生物有限公司。高速冷冻离心机(型号5541R)为Eppendorf产品;日立7020全自动生化分析仪(型号0500790S)为HITACHI产品。
2 方法
2.1动物模型的复制 清洁级雄性SD大鼠适应性喂养1周后,在文献[8]的基础上略作修改复制动物模型: 采用高脂高糖饲料喂养1月后联合1% STZ (30 mg/kg) 尾静脉注射,注射72 h后检测空腹血糖(fas-ting blood glucose,FBG),FBG≥11.2 mmol/L为2型糖尿病大鼠模型构建成功。
2.2分组及给药 将成模大鼠随机分成DM模型(DM)组和糖肾方低剂量(low-dose TS, TSLow)、中剂量(medium-dose TS,TSMed)、高剂量(high-dose TS,TSHi)组,同时设对照(control)组,每组8只。糖肾方低、中、高剂量组分别以糖肾方浓缩剂6.5 g·kg-1·d-1、13 g·kg-1·d-1和26 g·kg-1·d-1灌胃。每日给药1次,连续12周。
2.3标本的采集 给药12周后,各组大鼠末次给药后禁食不禁水24 h,称量体重。采用戊巴比妥钠30 mg/kg腹腔注射麻醉,行腹主动脉采血,4 ℃、4 000 r/min,离心10 min,收集血清,用于检测生化指标、炎症因子和胰岛素含量。处死大鼠,取肝组织,部分固定于10%甲醛缓冲液中,用于病理形态检测;部分快速冷冻于液氮中,然后置于-80 ℃超低温冰箱保存备用,用于相关指标检测。
2.4血清生化指标、炎症因子及胰岛素含量的测定 应用全自动生化分析仪测定FBG、甘油三酯(triglyce-ride, TG)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)等生化指标;血清TNF-α和IL-1含量检测采用ELISA法,空腹胰岛素(fasting insulin,FINS)含量采用放射免疫法,其步骤严格按照试剂说明书进行;由公式FBG×FINS/22.5计算稳态模型评估法胰岛素抵抗指数(homeostatic model assessment for insulin resistance,HOMA-IR)。
2.5肝组织SOD活性和MDA含量的检测 称取肝脏组织10 g,按重量(g)∶体积(mL)=1∶9比例加入0.9% NaCl溶液,冰水浴机械匀浆,匀浆液离心后取上清液,采用考马斯亮蓝法定量蛋白,分别采用羟胺法和TBA法检测SOD活性和MDA含量,具体步骤和计算方法按照说明书进行。
2.6肝组织病理变化的观察 肝脏组织常规固定脱水、透明、包埋、切片,分别行HE染色和Masson染色,光镜下观察肝脏病理形态学改变和纤维化程度。
2.7Western blot检测SIRT1和PGC-1α的蛋白表达 取适量肝组织,提取总蛋白,用考马斯亮蓝法进行蛋白浓度测定。取60 μg总蛋白,加等量样品处理液,100 ℃煮沸5 min,行SDS-PAGE,电泳完毕后将蛋白转移到硝酸纤维素膜上。将膜用含5%脱脂牛奶的TBST 封闭1 h后,分别加入Ⅰ抗(SIRT1稀释度1∶5 000;PGC-1α稀释度 1∶1 000)4℃孵育过夜,洗膜,然后用Ⅱ抗(稀释度1∶5 000)室温孵育1 h,显色,拍片晾干,扫描,采用BandScan 5.0软件进行条带的光密度分析。
3 统计学处理
采用统计软件SPSS 17.0进行数据处理和统计分析。数据以均数±标准差(mean±SD)表示,组间计量资料的比较采用单因素方差分析,对各组均数间两两比较采用Bonferroni 校正的t检验。以P<0.05为差异有统计学意义。
结 果
1 各组大鼠血清生化指标及胰岛素抵抗指数的比较
与对照组比较,DM模型组大鼠FBG、TG、FINS和HOMA-IR明显升高(P<0.01),肝功能指标ALT和AST升高(P<0.05);与DM模型组比较,糖肾方高剂量组FBG水平下降明显(P<0.05),TS各剂量组TG、FINS、HOMA-IR、AST和ALT水平均明显下降(P<0.05),见表1、2。
表1各组大鼠血清FBG、FINS和HOMA-IR水平的变化
Table 1. The serum levels of FBG, FINS and HOMA-IR in each group (Mean±SD.n=8)
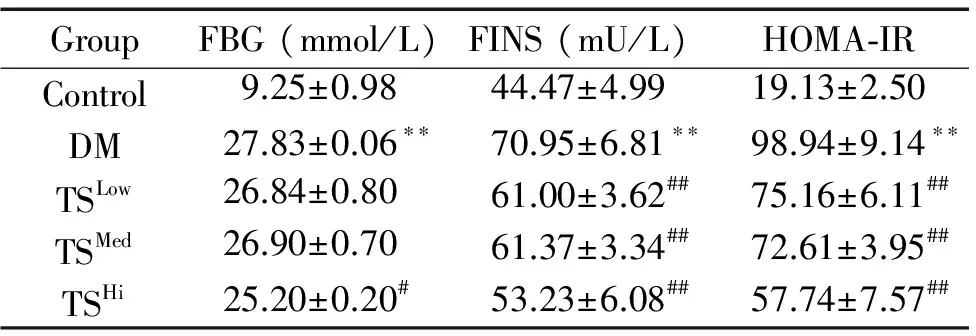
GroupFBG(mmol/L)FINS(mU/L)HOMA⁃IRControl9.25±0.9844.47±4.9919.13±2.50DM27.83±0.06∗∗70.95±6.81∗∗98.94±9.14∗∗TSLow26.84±0.8061.00±3.62##75.16±6.11##TSMed26.90±0.7061.37±3.34##72.61±3.95##TSHi25.20±0.20#53.23±6.08##57.74±7.57##
**P<0.01vscontrol group;#P<0.05,##P<0.01vsDM group.
表2各组大鼠血清中TG、AST和ALT水平的变化
Table 2. The serum levels of TG、AST and ALT (Mean±SD.n=8)
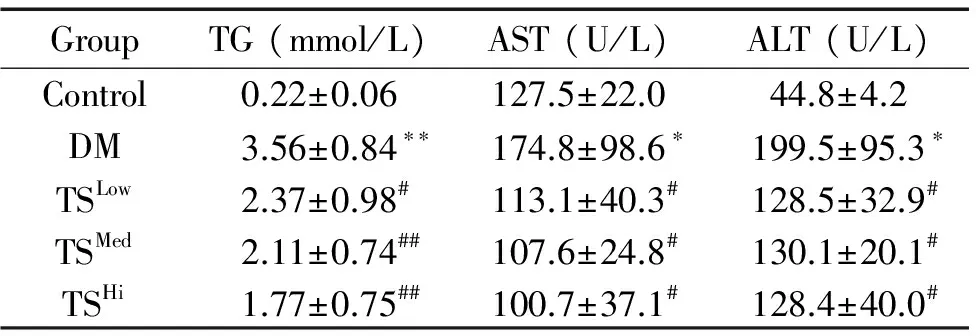
GroupTG(mmol/L)AST(U/L)ALT(U/L)Control0.22±0.06127.5±22.044.8±4.2DM3.56±0.84∗∗174.8±98.6∗199.5±95.3∗TSLow2.37±0.98#113.1±40.3#128.5±32.9#TSMed2.11±0.74##107.6±24.8#130.1±20.1#TSHi1.77±0.75##100.7±37.1#128.4±40.0#
*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsDM group.
2 各组大鼠肝组织病理形态改变
HE染色结果显示,对照组大鼠肝小叶结构清晰,细胞呈多边形,大小形态一致;DM模型组大鼠肝细胞脂肪变明显,可见局灶性坏死及炎细胞浸润。Masson 染色结果显示,对照组肝组织内血管壁、窦周间隙可见少量胶原纤维;DM模型组可见窦周间隙以及门管区、小叶间纤维增生明显。经糖肾方干预后,大部分肝细胞内脂滴明显减少甚至消失,炎细胞浸润明显减少,胶原纤维均减少,其中糖肾方高剂量组减少最明显,见图1、2。
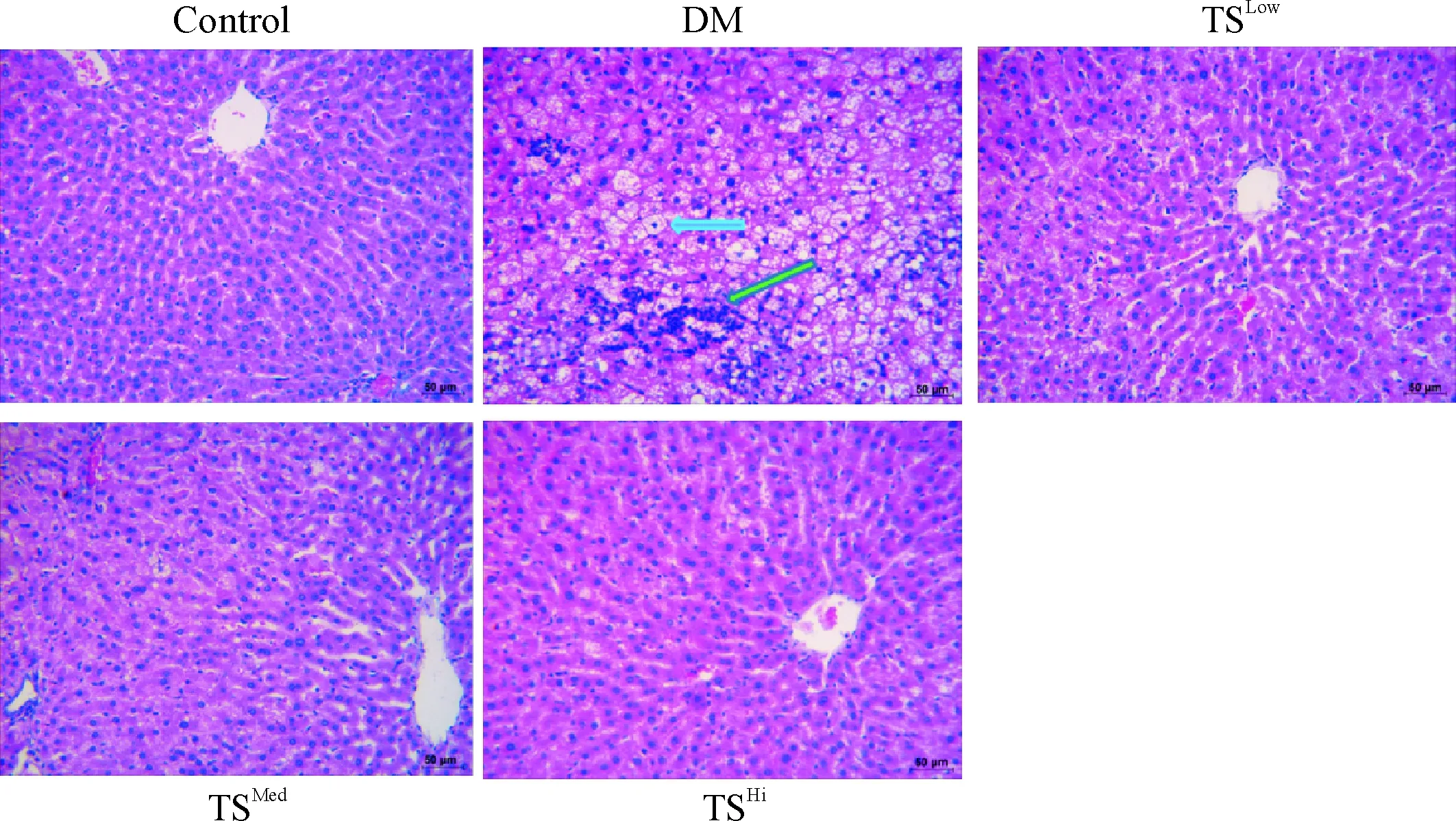
Figure 1. The pathological changes of hepatic tissues (HE staining,×400). The blue arrow indicates the adipose degeneration, and the green arrow indicates the infiltration of inflammatory cells.
图1各组大鼠肝脏组织病理形态的HE染色结果

Figure 2. The pathological changes of hepatic tissues (Masson staining,×400).
图2各组大鼠肝脏组织病理形态的Masson染色结果
3 各组大鼠肝脏组织SOD活性和MDA含量的比较
与对照组比较,DM模型组大鼠肝组织匀浆中SOD活性显著降低,而MDA含量明显升高(P<0.01);与DM模型组比较,给药12周后,糖肾方各治疗组肝组织匀浆中SOD活性均有一定程度的升高,其中高剂量组升高最明显(P<0.05),而MDA含量均明显降低(P<0.01),见表3。
表3大鼠肝组织匀浆SOD活性和MDA含量的变化
Table 3. The changes of the activity of SOD and the content of MDA in the liver tissues (Mean±SD.n=8)
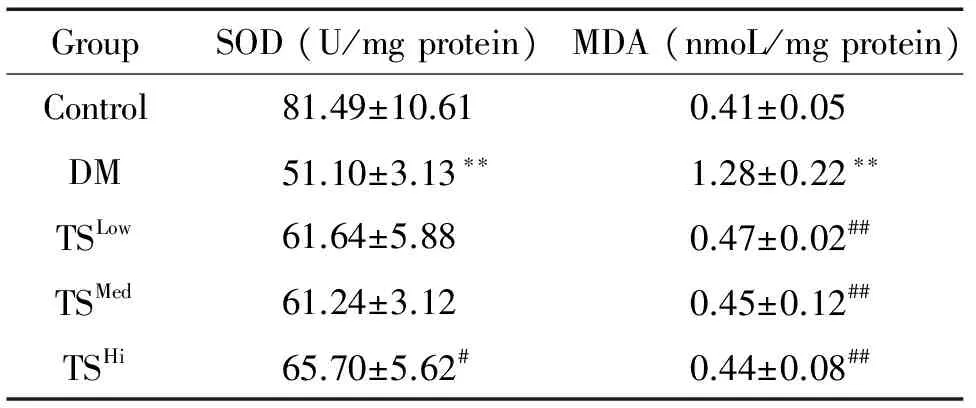
GroupSOD(U/mgprotein)MDA(nmoL/mgprotein)Control81.49±10.610.41±0.05DM51.10±3.13∗∗1.28±0.22∗∗TSLow61.64±5.880.47±0.02##TSMed61.24±3.120.45±0.12##TSHi65.70±5.62#0.44±0.08##
**P<0.01vscontrol group;#P<0.05,##P<0.01vsDM group.
4 各组大鼠血清炎症因子IL-1和TNF-α的变化
与对照组比较,DM模型组血清IL-1和TNF-α升高(P<0.05)。与DM模型组比较,糖肾方各治疗组IL-1降低明显(P<0.01);TNF-α在糖肾方低、中剂量组降低明显(P<0.05),见图3。
5 各组大鼠肝组织SIRT1和PGC-1α蛋白的表达
与对照组比较,DM模型组大鼠肝组织的SIRT1和PGC-1α蛋白表达明显降低(P<0.01);与DM模型组相比,糖肾方各剂量组SIRT1和PGC-1α的蛋白表达均明显升高(P<0.01),见图4。
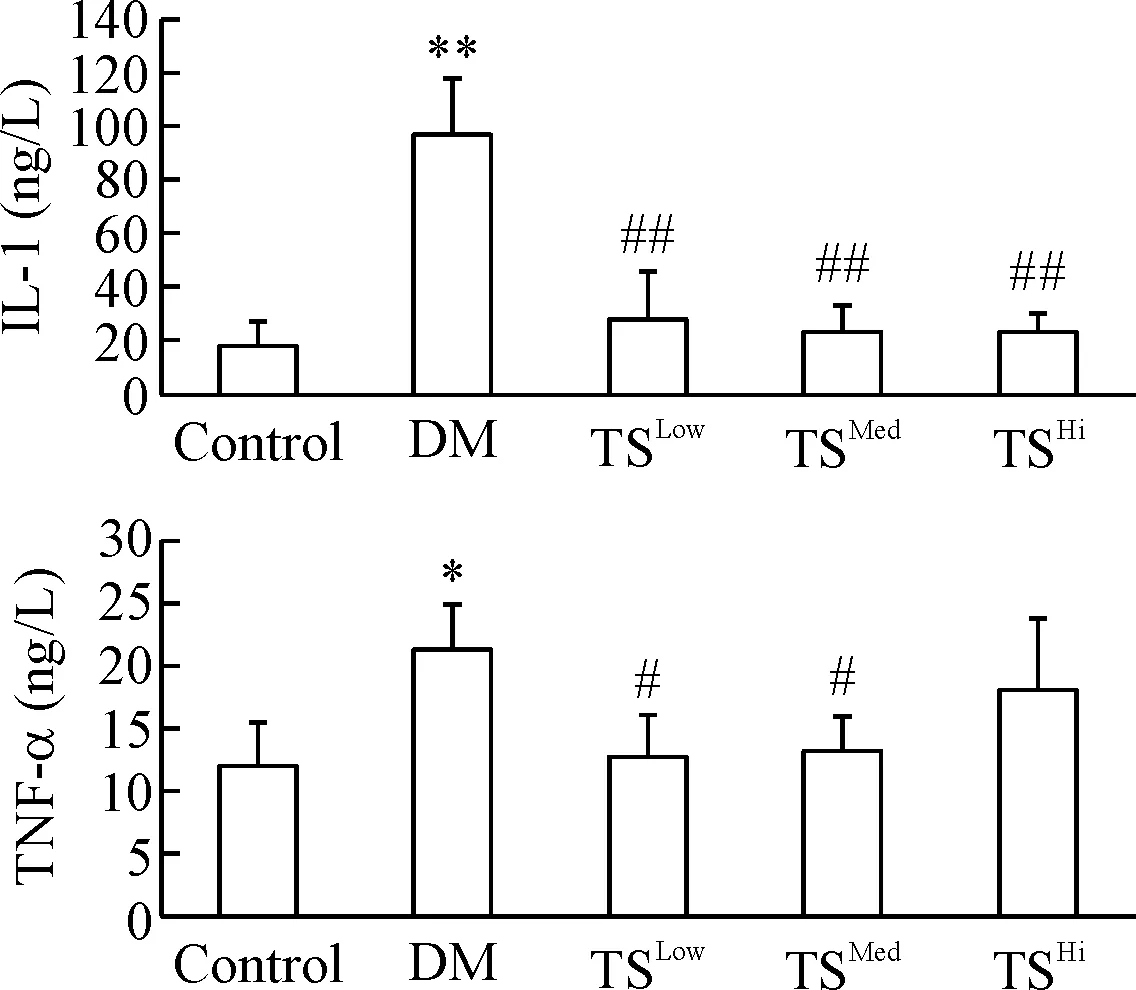
Figure 3. The serum contents of IL-1 and TNF-α in each group. Mean±SD.n=6 .*P<0.05,**P<0.01 control group;#P<0.05,##P<0.01vsDM group.
图3各组大鼠血清炎症因子IL-1和TNF-α的含量
讨 论
近年来全球糖尿病发病率和致死率不断升高,糖尿病性肝损伤已经成为糖尿病患者的主要并发症和死亡原因之一。目前对糖尿病肝损伤的干预主要在降糖的基础上,通过生活方式干预来降低体重,从而降低代谢性疾病的危险因素来实现的。
祖国医学认为糖尿病并发症的基本病机为瘀浊互阻,气阴两虚。消渴日久,治不得法,伤阴耗气,痰瘀互结于肝络可致糖尿病肝病[9]。根据辨证论治,中医药对2型糖尿病及其并发症的防治具有独特的优势和特色。糖肾方是柴可夫教授通过临床实践证实能有效治疗糖尿病肾病的经验方,方中以黄芪、葛根益气生津为主,黄芪善益气扶正、鼓邪外出,葛根性甘、辛凉,能解热生津。灵芝味甘苦、性平,归心、肺、肝、脾经,可养心安神、理气化瘀、滋肝健脾;女贞子滋肾水、补肝阴、清虚热;大黄酒治活血化瘀之力较强,与丹参合用推动血行,消除体内痰浊及瘀血停滞。诸药配伍,药性趋于平和,有共奏益气养阴、活血通络、化瘀祛痰之功。前期动物实验研究结果显示,TS对2型糖尿病大鼠模型具有较好的降糖、降脂、抗炎和改善血流变等功效,对糖尿病肾脏功能有保护作用[3-4]。根据“肝肾同源”中医理论,推测糖肾方对糖尿病肝脏损伤也有一定的减轻作用。现代药理学研究表明,糖肾方中所含多种中药有效成分均具有降低糖尿病患者空腹血糖和餐后血糖,增加胰岛素敏感性,调节肝脏脂质代谢,预防及治疗糖尿病肝损伤的药理作用[5-7]。为此,本研究观察糖肾方对2型糖尿病大鼠的肝脏结构、功能的影响并探讨其保护机制。
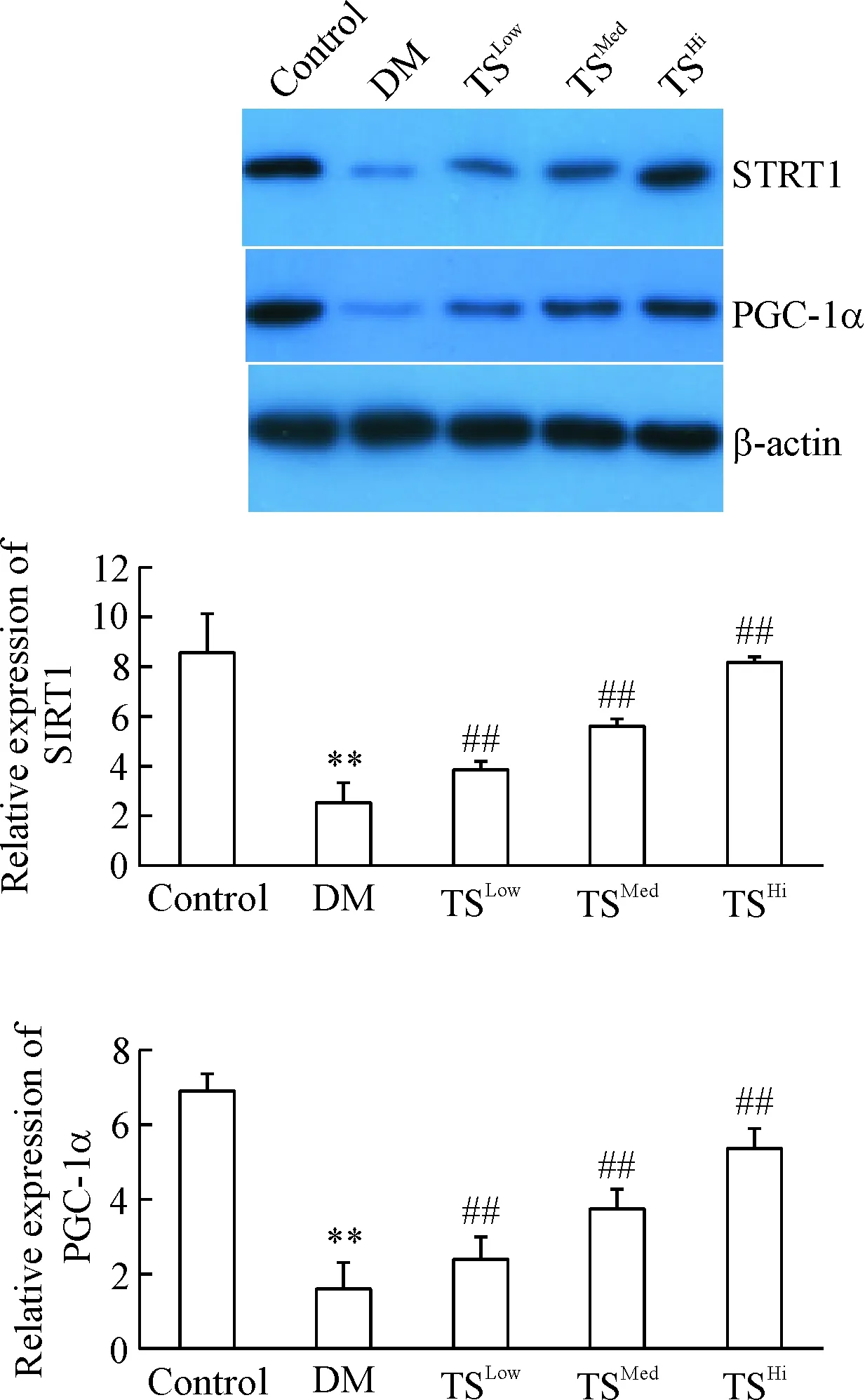
Figure 4. The protein expression of SIRT1 and PGC-1α in each group. Mean±SD.n=6.**P<0.01vscontrol group;##P<0.01vsDM group.
图4各组大鼠肝组织SIRT1和PGC-1α蛋白的表达
糖尿病性肝损伤,表现为肝脏内弥漫的脂肪变性且伴有炎细胞浸润及纤维组织增生,属于非酒精性脂肪性肝病范畴,进一步可引起肝硬化和肝癌。本研究采用高脂高糖饮食结合低剂量STZ诱导建立2型糖尿病大鼠模型,结果显示模型组大鼠血清AST和ALT明显升高,并出现肝细胞明显脂肪变、炎细胞浸润、局灶性坏死、胶原纤维增生等形态学变化,提示存在NAFLD。而糖肾方各治疗组大鼠血清AST和ALT含量明显降低;肝细胞脂肪变性明显改善,炎细胞浸润和局灶性坏死明显减少,胶原纤维减少,提示糖肾方对糖尿病大鼠肝功能有保护作用。
现代研究认为[10],NAFLD的发病机制为二次打击学说:“首次打击”主要是胰岛素抵抗引起脂质在肝脏蓄积,第二次打击是氧化应激及脂质过氧化,不仅可以直接损伤肝细胞,诱导炎症细胞浸润,还能激活肝星形细胞促进胶原纤维合成,导致纤维化甚至肝硬化。本研究结果显示,DM模型组血清FINS和胰岛素抵抗指数升高,肝组织SOD活性降低、MDA升高,血清致炎因子TNF-α和IL-1水平升高,这表明糖尿病大鼠存在胰岛素抵抗、炎症反应以及肝脏氧化应激。糖肾方治疗可降低空腹血糖和甘油三酯、FINS和HOMA-IR,明显降低肝组织匀浆MDA含量,提高SOD活力,降低致炎因子IL-1和TNF-α的分泌,提示糖肾方能有效调节糖脂代谢紊乱,改善胰岛素抵抗和抑制氧化应激以及炎症反应从而起到保护肝脏作用。
SIRT1又称“长寿基因”,是一种依赖烟酰胺腺嘌呤二核苷酸(NAD+)的组蛋白/非组蛋白去乙酰化酶,可使FOXO、PGC-1α、PPAR-γ和NF-κB等核转录因子去乙酰化,从而调节糖异生、糖酵解和脂肪β氧化,改善胰岛素敏感性、线粒体损伤和炎症等作用[11]。研究资料显示限制热量摄入可通过增加SIRT1的表达,改善胰岛素抵抗进而减轻氧化应激达到治疗NAFLD 的效果[12]。新近研究发现,肝内的SIRT1在脂肪代谢尤其脂肪酸氧化中是关键的调节因子,肝特异性SIRT1的减少,导致脂肪酸过氧化,进而引起炎症反应和肝硬化[13]。另外研究显示DM患者机体内SIRT1基因和蛋白表达降低,SIRT1的激动剂白藜芦醇能上调SIRT1表达,在提高胰岛素敏感性、降糖、促进脂质分解和修复线粒体损伤中发挥作用[14]。
PGC-1α是一种核转录共激活因子,能与许多不同的转录因子结合,在不同组织中发挥不同的功能。众多研究表明[2],在糖脂代谢过程中PGC-1α与胰岛素抵抗、肌肉组织中葡萄糖摄取、肝糖原异生和脂肪酸代谢关系密切,并且通过影响线粒体呼吸的关键酶在能量代谢中起重要作用,而这些目前已经被公认是参与NAFLD的发生机制。研究发现[15]糖尿病患者PGC-1α基因表达是减少的,从而导致线粒体基因转录的减少,继而引起氧化磷酸化减低,脂质氧化减少,肝脏脂质堆积,而导致脂肪肝的产生。
体内外实验证明激活SIRT1 能改变PGC-1α的表达。糖尿病模型db/db小鼠口服SIRT1 抑制剂尼克酰胺后, PGC-1α乙酰化显著增加, 而口服SIRT1 激活剂白藜芦醇则能够激活PGC-1α,并激活下游效应因子雌激素相关受体1α-甾醇调节元件结合蛋白1,降低游离脂肪酸以及三酰甘油含量[16]。Feige 等[17]报道SIRT1 对PGC-1α的激活可促进细胞对脂肪的氧化从而增加细胞能量消耗。
本研究结果提示糖肾方可能通过促进SIRT1和PGC-1α蛋白的表达,及SIRT1对PGC-1α的去乙酰化调节,进而调节肝脏糖脂质代谢紊乱,改善胰岛素抵抗、氧化应激和炎症反应,而发挥对肝脏的保护作用。SIRT1和PGC-1α可能是糖肾方发挥药理作用的重要靶点。
[参考文献]
[1] Nassir F, Ibdah JA.Sirtuins and nonalcoholic fatty liver disease[J]. World J Gastroenterol, 2016, 22(46):10084-10092.
[2] 方诗蓉, 傅玉才, 周小辉. PGC-1α与非酒精性脂肪肝病关系的研究进展[J]. 国际消化病杂志, 2009, 29(6):390-392.
[3] 柴可夫, 吴喜喜, 杜月光, 等. 糖肾颗粒对糖尿病大鼠肾脏NF-κB和MCP-1表达的影响[J]. 中华中医药杂志, 2016, 31(8):3290-3293.
[4] 杜月光, 顾晶晶, 柴可夫. 糖肾方对糖尿病肾病大鼠血液流变学及内皮细胞功能的影响[J]. 中国病理生理杂志, 2016, 32(11):2079-2082
[5] 郭建利, 张睦清, 韩 雪, 等. 丹参不同组分防治大鼠非酒精性脂肪肝模型作用机制的研究[J]. 河北中医药学报, 2012, 27(1):8-9.
[6] 韩会民,王树国. 葛根素治疗非胰岛素依赖型糖尿病患者胰岛素抵抗的研究[ J].中国中西医结合急救杂志, 2006, 3(13):117-119.
[7] 赵 岩, 徐 莹, 查 琳, 等. 女贞子提取物降血糖及抗氧化活性的研究[J]. 药物评价研究, 2016, 39(3):382-387.
[8] 李 霜, 王圆圆, 刘丽荣, 等. 黏着斑激酶在2型糖尿病大鼠肾组织中的表达变化及意义[J]. 中国病理生理杂志, 2013, 29(8):1400-1405.
[9] 周 飞, 王 茜, 郑春梅, 等. 益气养阴活血化瘀法治疗糖尿病肝病[J]. 四川中医, 2013, 31(2):45-46.
[10] Day CP. Non-alcoholic fatty liver disease: a massive problem[J]. Clic Med, 2011, 11(2):176-178.
[11] Finkel T, Deng CX, Mostoslavsky R. Recent progress in the biologyand physiology of sirtuins[J]. Nature, 2009, 460(7255):587-591.
[12] 陈璐璐, 邓向群, 李凝旭. 热卡限制对非酒精性脂肪肝病大鼠肝脏SIRT1表达的影响[J]. 中华医学杂志, 2007, 87( 20):1434-1437.
[13] Kim KE, Kim H, Heo RW, et al. Myeloid-specific SIRT1 deletion aggravates hepatic inflammation and steatosis in high-fat diet-fed mice[J]. Korean J Physiol Pharmacol, 2015, 19(5):451-460.
[14] Heebøll S, Thomsen KL, Pedersen SB, et al. Effects of resveratrol in experimental and clinical non-alcoholic fatty liver disease[J]. World J Hepatol, 2014, 6(4):188-198.
[15] Koo S H, Satoh H, Herzig S, et al. PGC-1 promotes insulin resistance in liver through PPAR-alpha-dependent induction of TRB-3[J]. Nat Med, 2004, 10(5):530-534.
[16] Kim MY, Lim JH, Youn HH, et al. Resveratrol prevents renal lipotoxicity and inhibits mesangial cell glucotoxicity in a manner dependent on the AMPK-SIRT1-PGC1α axis indb/dbmice [J]. Diabetologia, 2013, 56(1): 204-217.
[17] Feige JN, Lagouge M, Canto C, et al. Specific SIRT1 activation mimics low energy levels and protects against diet induced metabolic disorders by enhancing fat oxidation [J].Cell Metab, 2008, 8(5): 347-358.

