橙皮苷(C28H34O15)改善自发性糖尿病小鼠肾损伤炎症机制的研究*
窦永会,徐思源,兰 天,荣向路,郭 姣
(广州中医药大学 广州 510006)
糖尿病肾病是糖尿病常见并发症之一。高血糖是糖尿病肾病的高危因素,长期慢性的高血糖状态会引发肾脏发生结构及功能改变[1,2]。大量实验研究与临床观察表明,血流动力学改变和代谢通路功能失调导致人体自身的免疫系统功能下降,并进一步引发慢性炎症。慢性炎症反应通过细胞因子、生长因子以及肾脏固有细胞的共同作用参与糖尿病肾脏病的发生发展过程[2,3]。前期实验研究表明,单核/巨噬细胞在糖尿病肾病炎症反应早期具有重要作用,炎症细胞浸润是糖尿病肾病早期发生与后期进展的重要病理特征[4]。
橙皮苷是从橙皮中提取的一类化合物,在维持患者的渗透压、增强毛细血管的韧性、降低胆固醇及对糖尿病和心脑血管的辅助治疗方面具有很好的疗效[5]。橙皮苷的药理研究表明,其具有良好的抗氧化、抗炎作用[6],能改善高脂血症大鼠血脂代谢紊乱等功效[7]。陈明喆等[8]研究发现橙皮苷能明显降低IgA肾病大鼠24 h尿蛋白,减少尿红细胞计数,具有肾脏保护功能。袁廷东等[9]发现橙皮苷能通过抑制TNF-α和IFN-ɣ的表达对急性肝损伤小鼠起到肝脏保护作用。橙皮苷的相关研究还发现给予高脂血症模型大鼠橙皮苷后,能显著调节模型大鼠的血脂水平及血液黏滞状态,对防治高脂血症具有积极作用[10]。蒲鹏[11]研究发现橙皮苷具有减肥,改善高血糖、高血脂,缓解胰岛素抵抗的药效。
当前,针对于橙皮苷的药效研究多集中在肝脏保护方面,对糖尿病引起的肾损伤研究较少,且机制不明确。本研究通过探讨橙皮苷对db/db自发性糖尿病小鼠模型肾损伤的保护作用的研究,对橙皮苷改善糖尿病肾损伤的药效及机制进行初期研究。

表1 引物序列
1 材料与方法
1.1 材料
1.1.1 药物与试剂
橙皮苷(分子式:C28H34O15,分子量:610.57,质量标准:HPLC≥98%,标准品。美仑生物技术有限公司,5 g,N0908A);葡萄糖测定试剂盒(上海荣盛生物药业有限公司,201604012147);肌酐试剂盒(南京建成生物工程研究所,96 T,20160320);尿蛋白定量试剂盒(南京建成生物工程研究所,100 T/96样,20160812);糖原染色剂(Leagene,4×100 mL,03151217);F4/80一抗(Cell Signaling Technology,ab74382)。
1.1.2 实验动物与给药
SPF级24周龄db/m与db/db雄性小鼠由广东药科大学动物中心繁殖所得,SPF级环境下给予普通饲料,自由饮水喂养(温度22±1℃,湿度55±5%,12 h光暗循环;饲料和水均在消毒后由动物自由摄取)。选取相同周龄雄性db/m小鼠为对照组,禁食12 h后血糖值大于7.0 mmol·L-1的db/db小鼠作为实验动物。根据血糖值和体重将db/db小鼠随机分为模型组与给药组,每组10只,予以普通饲料喂养,橙皮苷(200 mg·kg-1B.W.)灌胃给药,连续14周,对照组与模型组给予相同剂量的溶媒(0.5%CMC-Na)。所有动物实验内容均严格按照国家和广东药科大学动物中心动物使用管理条例进行实验设计和实施。
1.1.3 主要仪器
冷冻离心机(赛洛捷克公司,型号:D3024R);酶标仪(Thermo,型号:1510);石蜡切片机(Thermo,型号:HM340E);冰切机(Thermo,型号:NX50);正置荧光显微镜(OLYMPUS,型号:BX50);荧光-PCR仪(BIORAD,型号:788BR04969)
1.2 实验方法
1.2.1 观察指标与方法
实验动物给药14周后,采用提尾法收集尿液并检测尿液中的尿白蛋白(MAIb)及尿肌酐(Ucr)浓度,以尿白蛋白比尿肌酐求得ACR。禁食12 h,乙醚麻醉,摘眼球取血,低温离心,取上清检测血浆血糖(Glucose)、血肌酐(Scr)浓度;小鼠行脱颈椎处死,摘取肾脏,称重,进行冻存或者福尔马林固定、脱水,以备后期实验检测。
1.2.2 组织H&E及PAS染色
肾脏组织行脱水、包埋并进行石蜡切片,石蜡切片进行H&E及PAS染色。H&E染色条件为:梯度脱蜡-苏木素7 min-盐酸乙醇分化-流水返蓝-伊红染30 s-脱水-透明-封片。PAS染色条件为梯度脱蜡-高碘酸滴染15 min-schiff试剂滴染5 min-流水冲洗5 min-脱水-透明-封片。显微镜下观察并拍照。
1.2.3 组织免疫荧光检测
本实验采用免疫荧光检测小鼠肾脏组织中F4/80蛋白的表达。取肾脏组织冰冻切片,常温中复温30 min后PBS洗涤3次,每次5 min,3%双氧水浸泡并洗涤,洗涤完成后加入F4/80蛋白一抗4℃孵育过夜、常温孵育二抗2 h,DAPI染核,荧光封片剂封片,荧光显微镜下观察蛋白表达情况并拍照。
1.2.4 RT-PCR
本实验采用RT-PCR检测炎症相关基因F4/80、TNF-α以及IL-6在肾脏的表达情况,引物序列见表1。肾脏组织冰上匀浆,用Trizol reagent(TAKARA,日本)试剂盒提取总RNA,逆转录成cDNA,进行RT-PCR实验,按照两步法SYBR Real-time PCR Kit(TAKARA,日本)试剂盒说明书配制反应体系;温度循环参数为预变性98℃ 2 min,98℃ 10 s,60℃ 10 s,68℃ 30 s,39个循环进行PCR扩增反应。每个样本设置3个复孔,取其平均值,每组3个样本进行统计分析。
2 统计学处理
运用SPSS 13.0统计软件分析,实验数据结果采用均数±标准差(mean±SEM)表示,各组间差异采用单因素方差(one-way ANOVA)进行分析,Bonferroni校正的t检验分析两两数据间差异,以P<0.05表示差异具有统计学显著性。免疫荧光结果使用Image J软件分析统计。
3 结果
3.1 橙皮苷对糖尿病模型小鼠的体重及进食量的影响
橙皮苷对糖尿病模型小鼠的体重及进食量无明显作用。如图1中结果所示,实验过程中,空白组与模型组小鼠体重一直具有显著差异,给药2周开始橙皮苷虽能轻微下调db/db小鼠体重但与模型组不具有显著差异。进食量检测结果表明各组间不具有显著差异。
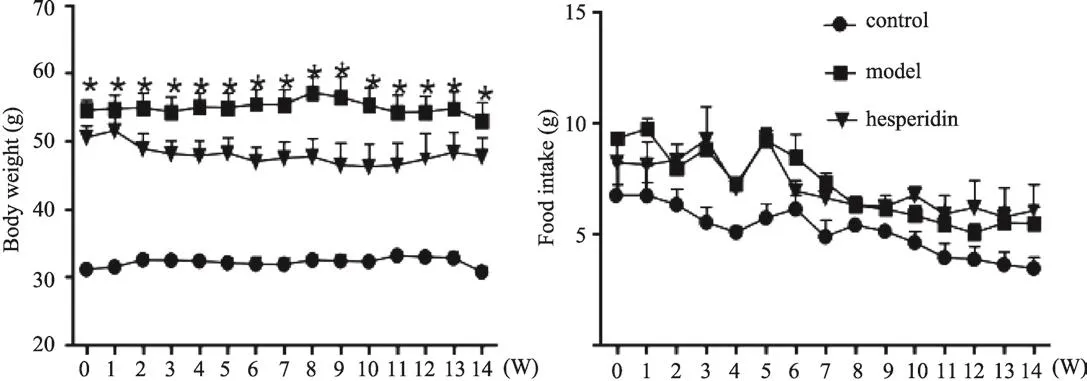
图1 体重与进食量检测结果
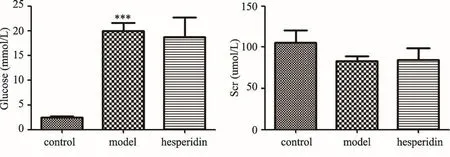
图2 血糖与血肌酐水平检测结果
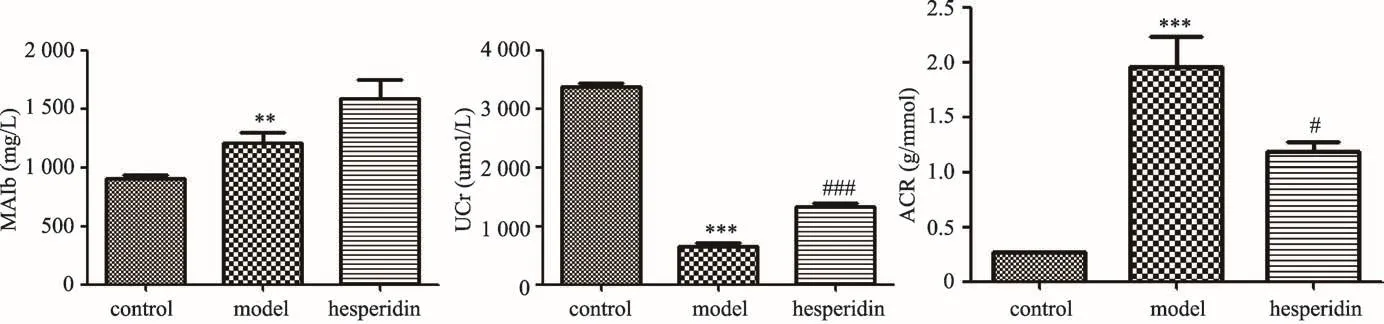
图3 尿液中白蛋白,肌酐和ACR结果
3.2 橙皮苷对糖尿病模型小鼠血浆中血糖和血肌酐的影响
橙皮苷对糖尿病模型小鼠血浆中血糖和血肌酐无明显作用。如图2中结果所示,给药14周后,检测各组小鼠血浆中血糖(Glucose)、血肌酐(Scr)水平,血糖结果表明橙皮苷没有降低db/db糖尿病模型小鼠血糖的作用(P>0.05)。Scr结果表明db/db糖尿病模型小鼠血浆中的肌酐含量仍处于正常水平(P>0.05)。
3.3 橙皮苷对糖尿病模型小鼠尿液中肾损伤相关指标水平的影响
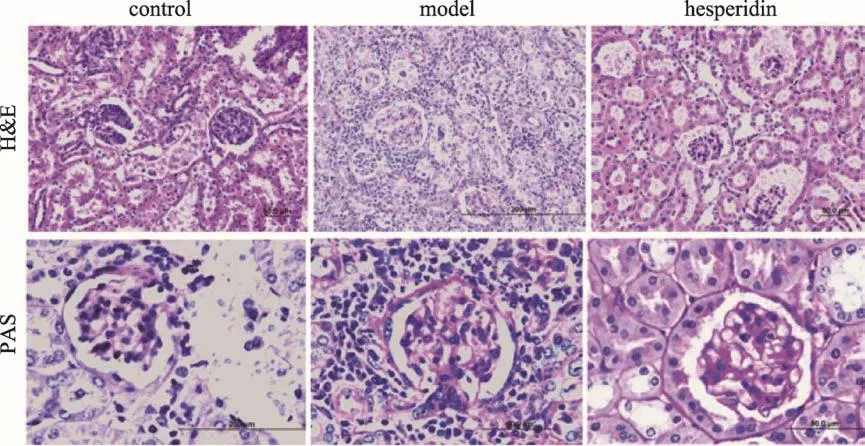
图4 肾脏H&E和PAS染色结果
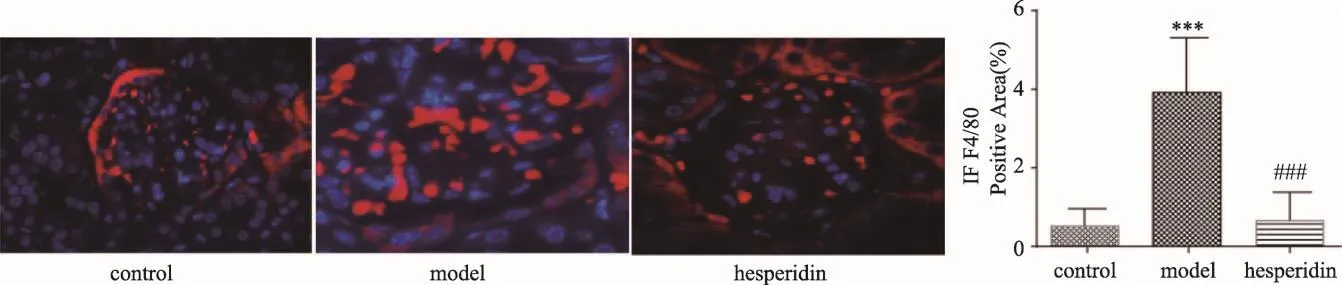
图5 肾脏IF检测结果(100×)
如图3中结果所示,给药14周后,检测各组小鼠尿液中尿白蛋白(MAIb)及尿肌酐(Ucr)含量水平,计算ACR值(尿白蛋白/尿肌酐)。实验结果表明,db/db糖尿病模型小鼠ACR值极显著升高(P<0.001),橙皮苷能显著降低db/db糖尿病模型小鼠ACR值(P<0.05),改善肾小球过滤率。
3.4 橙皮苷对糖尿病模型小鼠早期肾损伤病理的影响
肾脏H&E染色结果显示(40×)(图4),与空白组比较db/db糖尿病模型小鼠肾脏肾小球及肾间质有大量的巨噬细胞浸润、毛细血管袢皱缩甚至出现肾小球凋亡,表明db/db糖尿病模型小鼠出现明显的肾损伤病理改变。橙皮苷给药组小鼠肾小球整体形态完整度高,巨噬细胞浸润状况明显减弱。肾脏PAS染色结果(100×)(图4)模型组系膜细胞弥散性增生,肾小球基底膜增厚明显及系膜基质增宽明显。给药组能够改善db/db糖尿病模型小鼠上述病理改变,改善早期肾脏病变。
3.5 橙皮苷对糖尿病模型小鼠肾脏F4/80表达的影响
免疫荧光(IF)检测肾脏F4/80阳性表达结果IF检测肾脏F4/80阳性表达结果如图5所示。与空白组比较,db/db糖尿病模型小鼠肾小球F4/80阳性表达显著升高(P<0.001),而橙皮苷能显著降低F4/80在db/db糖尿病模型小鼠肾小球的表达(P<0.001),减轻肾小球周围巨噬细胞的浸润。
3.6 橙皮苷对糖尿病模型小鼠肾脏炎症相关基因表达的影响
本实验通过RT-PCR检测肾脏组织中炎症相关基因F4/80,TNF-α,IL-6表达水平,实验结果如图6所示。与正常组相比,db/db糖尿病模型小鼠肾脏F4/80,TNF-α,IL-6表达均明显升高,橙皮苷给药14周能显著性下调db/db糖尿病模型小鼠肾脏F4/80,TNF-α,IL-6表达水平,抑制肾脏炎症反应。
4 讨论
2013年中国糖尿病指南上明确表明,糖尿病肾病的进展主要体现在尿蛋白的增多和肾小球系膜病变的发展[12]。而高血糖引发的机体代谢失常和血流动力学改变是导致肾损伤的主要病理机制。长期的高血糖通过非酶途径产生的晚期糖基化终末产物(AGE)的积聚,过度激活的蛋白激酶C、多元醇通路和氧化应激的加速以及血管活性物质、细胞因子的激活等因素引起肾脏固有细胞的损伤,而且以上各因素间又相互影响,共同参与糖尿病肾病的发生发展过程[13]。
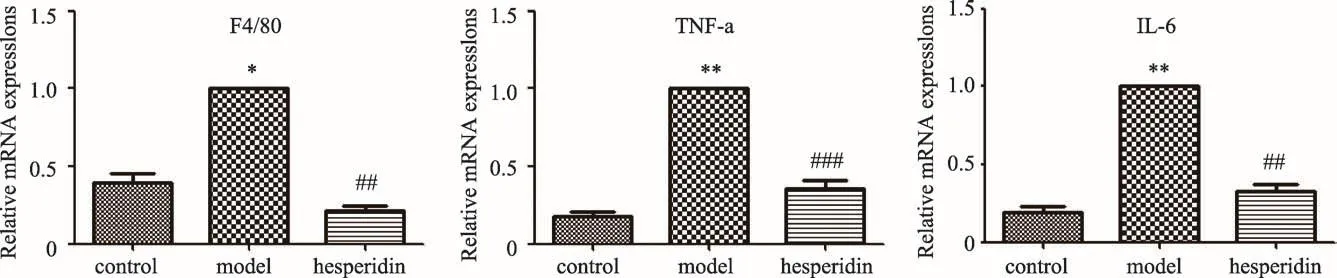
图6 肾脏F4/80,TNF-α,IL-6表达水平
既往研究报道中我们可以发现,在糖尿病的启动、进展以及达到肾衰竭的各个阶段中,都有促炎细胞因子的参与。其中,巨噬细胞的浸润是关键,它导致肾小球系膜基质堆积而引起一系列病理改变[14]。F4/80是巨噬细胞的特异性抗原,是其常见的标记物。参与标记巨噬细胞的成熟和活化过程,在巨噬细胞浸润过程中F4/80蛋白的表达会发生明显变化[15-16]。TNF-α、IL-6是整个病理过程中两个关键性因子,由巨噬细胞、单核细胞以及T细胞产生[17],TNF-α不仅可以直接诱导正常细胞产生IL-6,还可以诱导肾脏固有细胞的损伤、凋亡,与糖尿病肾损伤的进展息息相关[18]。而IL-6与DN肾损伤进展相关的指标如肾小球内皮细胞渗透性异常、系膜细胞扩张、纤连蛋白表达增加、肾小球基底膜厚度等病理变化密切相关[19]。TNF-α、IL-6作为炎症指标中关键的细胞因子,能够促进肾小球内皮细胞分泌基质,造成基质堆积[20-22]。
本研究结果显示,橙皮苷对db/db糖尿病模型小鼠体重、进食量以及血糖无明显调节作用,表明橙皮苷不会影响食欲、体重且没有降血糖作用,与既往文献报道一致[7],证实橙皮苷不通过控制血糖改善肾损伤。尿微量白蛋白的排泄增多是糖尿病肾损伤的标志性指标,与肾小球病变及肾损伤进展密切相关[12]。本研究显示橙皮苷显著改善db/db糖尿病模型小鼠肾小球滤过率,降低尿微量白蛋白排泄,改善肾脏滤过功能。同时,橙皮苷显著改善肾小球系膜增生以及毛细血管袢皱缩至血管极的病理状态,表明橙皮苷能通过抑制肾小球病变改善肾小球滤过率达到治疗肾脏损伤的作用。免疫荧光以及PCR结果显示橙皮苷能抑制db/db糖尿病模型小鼠肾脏巨噬细胞的浸润,下调肾小球F4/80 mRNA表达水平以及蛋白阳性表达量,下调肾脏炎症因子TNF-α、IL-6 mRNA表达水平,抑制肾脏炎症反应。综上所述,橙皮苷能通过抑制db/db糖尿病模型小鼠肾脏炎症反应、改善肾小球病变,改善肾小球滤过率,降低尿微量白蛋白排泄,达到延缓糖尿病早期肾损伤的作用。同时,橙皮苷是否可以进一步通过抗炎改善糖尿病肾病的肾脏纤维化以及大血管病变,还需进一步研究。
1 Pyram R,Kansara A,Banerji MA,et al.Chronic kidney disease and dia⁃betes.Maturitas,2012,71:94-103.
2 Satirapoj B.Review on pathophysiology and treatment of diabetic kid⁃ney disease.J Med Assoc Thai,2010,93(Suppl 6):S228-241.
3 Wu CC,Sytwu HK,Lin YF.Cytokines in diabetic nephropathy.Adv Clin Chem,2012,56:55-74.
4 Tian S,Tang J,Liu H,et al.Propyl gallate plays a nephroprotective role in early stage of diabetic nephropathy associated with suppression of glo⁃merular endothelial cell proliferation and angiogenesis.Exp Diabetes Res,2012:209.
5 殷章红,罗鹏程,王才英.橙皮苷抑制JNK信号通路辅助治疗2型糖尿病大鼠.长春中医药大学学报,2015,31(3):460-462.
6 钱俊臻,王伯初.橙皮苷的药理作用研究进展.天然产物研究与开发,2010,22:176-180.
7 史晶晶,时博.橙皮苷对高脂血症模型大鼠脂代谢紊乱的影响.中医学报,2016,4(31):554-557.
8 陈明喆,何伟.橙皮苷对IgA肾病大鼠肾脏组织中Nephrin蛋白表达的影响研究.现代中西医结合杂志,2016,25(26):2851-2854.
9 袁廷东,陈茂剑,黄文剑,等.橙皮苷对急性肝损伤模型小鼠肿瘤坏死因子-α和干扰素-γ表达的影响.医药导报,2015,34(6):714-717.
10李雄英,陈素红,吕圭源,等.橙皮苷对脂肪乳剂致高脂血症模型大鼠血脂及血液流变学的影响.浙江中医药大学学报,2013,37(3):308-312.
11蒲鹏.橙皮苷改善肥胖小鼠糖脂代谢的机制研究.中国中药杂志,2016,41(17):3290-3295.
12中国2型糖尿病防治指南(2013年版).中国糖尿病杂志,2014,22(8):21-22.
13 Nguyen DCA,Touyz RM.A new look at the renin-angiotensin systemfocusing on the vascular system.Peptides,2011,32(10):2141-2150.
14张冬松,高慧媛,吴立军,等.橙皮苷的药理作用研究进展.中国现代中药,2006,8(7):25-27.
15 Tamura Y,Yano M,Kawao N,et al.Enzamin ameliorates adipose tissue inflammation with impaired adipokine expression and insulin resis⁃tance.J Nutr Sci,2013,2:e37.
16 Tamura Y,Sugimoto M,Murayama T,et al.CCR2 inhibition ameliorates insulin resistance and hepatic stea-tosis in db/db mice.Arterioscler Thromb Vasc Biol,2013,2:e37.
17 Lin J,Glynn RJ,Rifai N,et al.Inflammation and progressive nephropa⁃thy in type 1 diabetes in the diabetes control and complications trial.Di⁃abetes Care,2008,31(12):2338-2343.
18 Dalla Vestra M,Mussap M,Gallina P,et al.Acute-phase markers of in⁃flammation and glomerular structure in patients with type 2 diabetes.J Am Soc Nephrol,2005,16(Suppl 1):S78-82.
19 Sekizuka K,Tomino Y,Sei C,et al.Detection of serum IL-6 in patients with diabetic nephropathy.Nephron,1994,68(2):284-285.
20 Li H,Li X,Duan L,et al.Inhibition of lovastatin on pro-liferation and expression of proinflammatory cytokinesin cultured human glomerular mesangial cells.Chin Med J(Engl),2003,116(9):1366-1369.
21 Zhang H,Ji LZ,Dai ZW.Influence of low-molecular weigh the parinon⁃urine interleukin-6 in patients with pro-life rative glomerulo nephritis.Hunan YiKe Da Xue Xue Bao,2001,26(5):443-444.
22 Ostendorf T,Kunter U,vanRoeyenC,et al.The effects of Platelet-de⁃rived growth factor antagonism in experimental glomerulo nephritis are independent of the transforming growth factor-beta system.J Am Soc Nephrol,2002,13(3):658-667.

