灰树花蛋白β-葡聚糖的抗抑郁效果及生物学机制研究进展与探析*
保红坤,朱科铭,贾 岳,刘天美,李浩然,杜 静
(1.云南大学医学院 昆明 650091;2.云南大学生命科学学院 昆明 650091)
抑郁症已成为现代社会的常见病和多发病,其发病率还在不断升高。世界卫生组织预测到2020年时,抑郁症将成为世界上仅次于心血管病第二大疾病,到2030年时抑郁症将成为高收入国家第一位的疾病负担[1,2]。随着社会经济文化的发展和公众健康意识的提高,我国抑郁症障碍的患病率呈现逐步上升趋势,这类疾病对患者及其家属造成的痛苦,以及对社会造成的损失,是许多其他疾病所无法比拟的。然而,目前我国临床使用的有关抑郁症治疗的西药基本被进口药与合资化药所垄断,而且抑郁症患者服用这类药物后大多表现出起效慢、有效率低、副作用大、停药后易复发等缺陷。中医药因在抑郁症的治疗中具有较好的效果而日益受到关注。因此,从中医药中研发具有起效快、靶点明确、安全等特点的新型抗抑郁药物具有重要的社会价值和理论意义。
灰树花(Grifola frondosa)是一种药用真菌,别名又称舞茸、栗子蘑、贝叶多孔菌、云蕈、千佛菌、莲花菌等(图1)。野生的灰树花呈浅灰色,长在柿树、板栗树、榆树的根部周围。我国就是最早利用真菌治病的国家,真菌具有很高的药用价值。而药用蘑菇在中国作为传统中药用来预防和治疗疾病已经具有较长的历史[3]。1709年,日本贝原益轩的《大和本草》中收载了灰树花,其药理作用最早记载于日本坂然的《菌谱》中,记载其“性甘、平、无毒,可益寿延年”。我国中医学认为灰树花有“扶正固本”之效,在《神农本草经》里有“调和脾胃,安定神志”的记载。此外,灰树花还具有极高的医疗保健功能,其药用潜能包括各种生理效果,从增强免疫系统、降低血糖、到改善脾脏、肝硬化、高血压、胃和神经功能等[4]。灰树花作为中药使用,其药效和猪苓等效,对小便不利、水肿、脚气、肝硬化腹水及糖尿病等具有非常好的治疗效果,因此它是非常宝贵的药用真菌之一。
1 GFPβG研究进展
1.1 简介
GFPβG(别名灰树花D组分)是灰树花中最为有效的活性成分,研究表明它具有较强的抗癌效果,因此,灰树花被誉为“真菌之王,抗癌奇葩”。GFPβG是从优质灰树花的子实体中提取后,经分离、精制得到的糖蛋白,它的多糖和蛋白的比例是8:2,平均分子量是一百万左右,多糖部分是以β-(1→6)结合为主链、β-(1→3)结合为侧链的葡聚糖和以β-(1→3)结合为主链、β-(1→6)结合为侧链的葡聚糖(图2)[5]。GFPβG无论是其化学结构,或是组成成分,亦或是分子量都有别于从香菇、云芝、灵芝等其他菌类中提取的同类物质,其生物活性作用远远超过这些同类物质。此外,大量研究证实GFPβG具有多种生理药效,包括抗肿瘤、免疫调节和抗抑郁等功效[5,6]。
1.2 抗肿瘤作用
GFPβG具有较强的抗肿瘤活性,单用或联合用药都表现出较好的治疗效果。β-葡聚糖免疫活性强弱与它的侧链、空间结构、以及分子量等密切相关,由于GFPβG具有独特的化学组成和结构,尽管它与香菇多糖、灵芝多糖、云芝多糖、茯苓多糖等同样是以多糖为主要成分,但是它的抗肿瘤作用则明显优于这些菌类提取物。最新研究表明GFPβG对乳腺癌具有较好的抑制作用,以及对浸润性膀胱癌患者具有缓解作用[7,8]。Soares等人研究发现GFPβG对人类乳腺癌细胞的生存能力和凋亡有影响,其起效机制是通过激活BAK-1基因来诱导乳腺癌细胞的凋亡[9]。在联合用药上,GFPβG同样表现出较好的抗肿瘤效果。Pyo等人采用GFPβG联合IFN-α处理体外前列腺癌PC-3细胞的研究表明,该联合用药使前列腺癌PC-3细胞的生长速率减少65%[10]。1995年,第一款灰树花提取物产品(舞茸精滴剂)在美国上市,由于其有效性和安全性得到医疗界和患者的充分肯定,1998年,美国FDA打破惯例,批准舞茸精滴剂产品免除一期安全毒理试验,直接进入晚期癌症患者二期临床,并被收载入2003年版《美国医生桌上参考手册》(非处方药和辅助营养品分册),广泛用于肿瘤康复补充替代治疗和亚健康人群的保健。

图1 灰树花
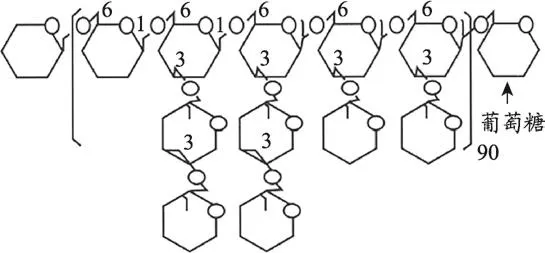
图2 灰树花β-葡聚糖分子结构
1.3 免疫调节作用
先天性免疫系统是抵御病菌入侵的第一道防线,它能够立即识别和处理病菌入侵的感染。虽然现已知不同β-葡聚糖发挥免疫调节的活性具有较长的时间,但其潜在的细胞和分子生物学机制尚不清楚[11]。GFPβG具有关键的β-葡聚糖作为它的天然生物活性成分结构,因此,β-葡聚糖是其发挥免疫调节活性作用的关键[5]。灰树花β-葡聚糖的免疫调节作用主要包括能够促进有丝分裂和激活免疫效应细胞,如淋巴细胞、巨噬细胞、树突状细胞和自然杀伤(NK)细胞,来刺激产生各种细胞因子和趋化因子,如白细胞介素(IL-1β,IL-6,IL-8,IL-12等),肿瘤坏死因子-α(TNF-α)和干扰素-γ(IFN-γ)[12]。越来越多的研究表明,Dectin-1受体与β-葡聚糖结合后能够介导多种细胞免疫调节作用,如吞噬作用、内吞作用和氧化爆发,以及诱导促炎细胞因子、趋化因子的产生(TNF-α,IL-12)和巨噬细胞炎症蛋白-2(MIP-2)[13,14]。现有研究表明GFPβG具有较强的免疫调节和抗肿瘤作用[5]。近年来的研究发现,抑郁症的发生和免疫调节功能相关[15,16],尤其是正常功能胶质细胞的受损会导致抑郁症的发生,并损伤了行使相关功能的神经突触的可塑性和神经的生长[17]。
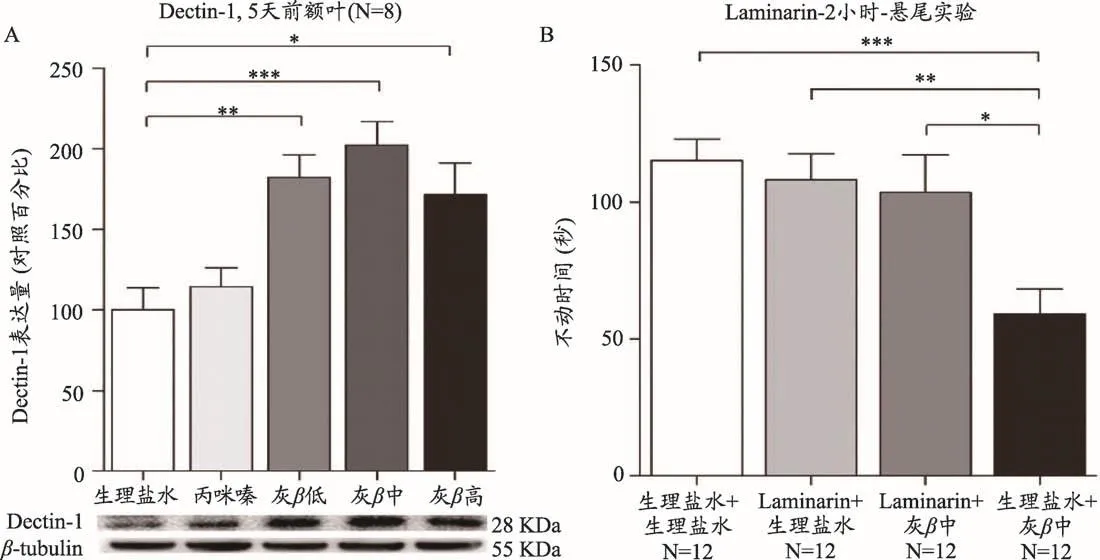
图3 [18]CD-1小鼠腹腔给药GFPβG低剂量(5 mg·kg-1,灰β低)、中剂量(8 mg·kg-1,灰β中)、高剂量(12.5 mg·kg-1,灰β高)、丙咪嗪(15 mg·kg-1)和生理盐水,给药2 h后进行悬尾实验或连续给药5天后对通过免疫印迹对小鼠大脑前额叶组织中Dectin-1表达水平检测。单因素方差分析(post hoc Tukey’s检验,*p<0.05,**p<0.01,***p<0.001)。(A)GFPβG连续注射5天后上调了其特异性受体Dectin-1表达水平。(B)GFPβG的受体Dectin-1的抗抑郁效果被其特异性拮抗剂Laminarin所阻断。
2 抗抑郁效果研究
2.1 具有快速和较强的抗抑郁效果
按低剂量(5 mg·kg-1)、中剂量(8 mg·kg-1)、高剂量(12.5 mg·kg-1)给小鼠腹腔注射GFPβG,生理盐水和丙咪嗪(15 mg·kg-1g)处理组分别作为阴性对照组和阳性对照组,处理60 min后或5天后进行悬尾实验或强迫游泳实验,发现GFPβG(5-12.5 mg·kg-1)具有快速和较强的抗抑郁效果[18]:小鼠行为学实验结果显示,腹腔注射60 min后显著降低了小鼠在悬尾和强迫游泳实验中的不动时间;连续腹腔注射5天后,同样显著降低了小鼠在悬尾和强迫游泳实验中的不动时间,该结果与阳性对照药物丙咪嗪(15 mg·kg-1)结果类似。
2.2 作用于中枢神经系统
最初的研究发现,Dectin-1是在树突状细胞表面上表达的特异性受体,特将它命名为树突状细胞相关的C型植物凝集素。但在后来的研究中发现除树突状细胞外,其作为β-葡聚糖的主要受体广泛分布在小胶质细胞、单核细胞、巨噬细胞、中性粒细胞等[19,20]。Dectin-1通过对真菌的识别参与免疫效应细胞的吞噬及杀伤过程,来诱导机体分泌一些免疫细胞因子及趋化因子,进而参与到机体防御真菌病原体的天然免疫反应过程中。有研究表明,GFPβG是由98%的葡聚糖和2%的蛋白组成[6]。在炎症状态下,葡聚糖能够与其运载体结合透过血脑屏障[20-22]。我们研究发现GFPβG在特异性的剂量范围内(5-12.5 mg·kg-1)与其受体Dectin-1相结合后透过血脑屏障在小鼠中发挥了较强的抗抑郁效果。免疫印迹实验结果表明,GFPβG连续处理5天后,较生理盐水对照组显著增加了Dectin-1受体在小鼠前额叶组织中的表达水平,而丙咪嗪(15 mg·kg-1)连续处理5天后,未检测到小鼠前额叶皮层中Dectin-1受体表达水平的变化[18](图3A)。而后,进一步通过悬尾实验来测定GFPβG的特异性受体Dectin-1抗抑郁效果是否被其特异性拮抗剂Laminarin所阻断,CD-1小鼠在行为学前2 h注射Laminarin,紧接着行为学前1 h再次注射GFPβG,悬尾实验结果表明,Dectin-1特异性拮抗剂Laminarin几乎完全阻断了GFPβG所产生的抗抑郁效果[18](图3B)。该实验结果提示GFPβG通过与Dectin-1受体结合而透过小鼠大脑血脑屏障后作用于中枢神经系统来发挥抗抑郁作用。研究表明β-葡聚糖与大脑中Dectin-1受体相结合能够导致Syk/NF-κB信号通路的活化进而调节神经免疫系统[23]。因此,GFPβG靶向作用其受体Dectin-1可能成为治疗抑郁症的一种新的策略。
2.3 上调前额叶中p-GluA1(S845)磷酸化和GluA1表达水平
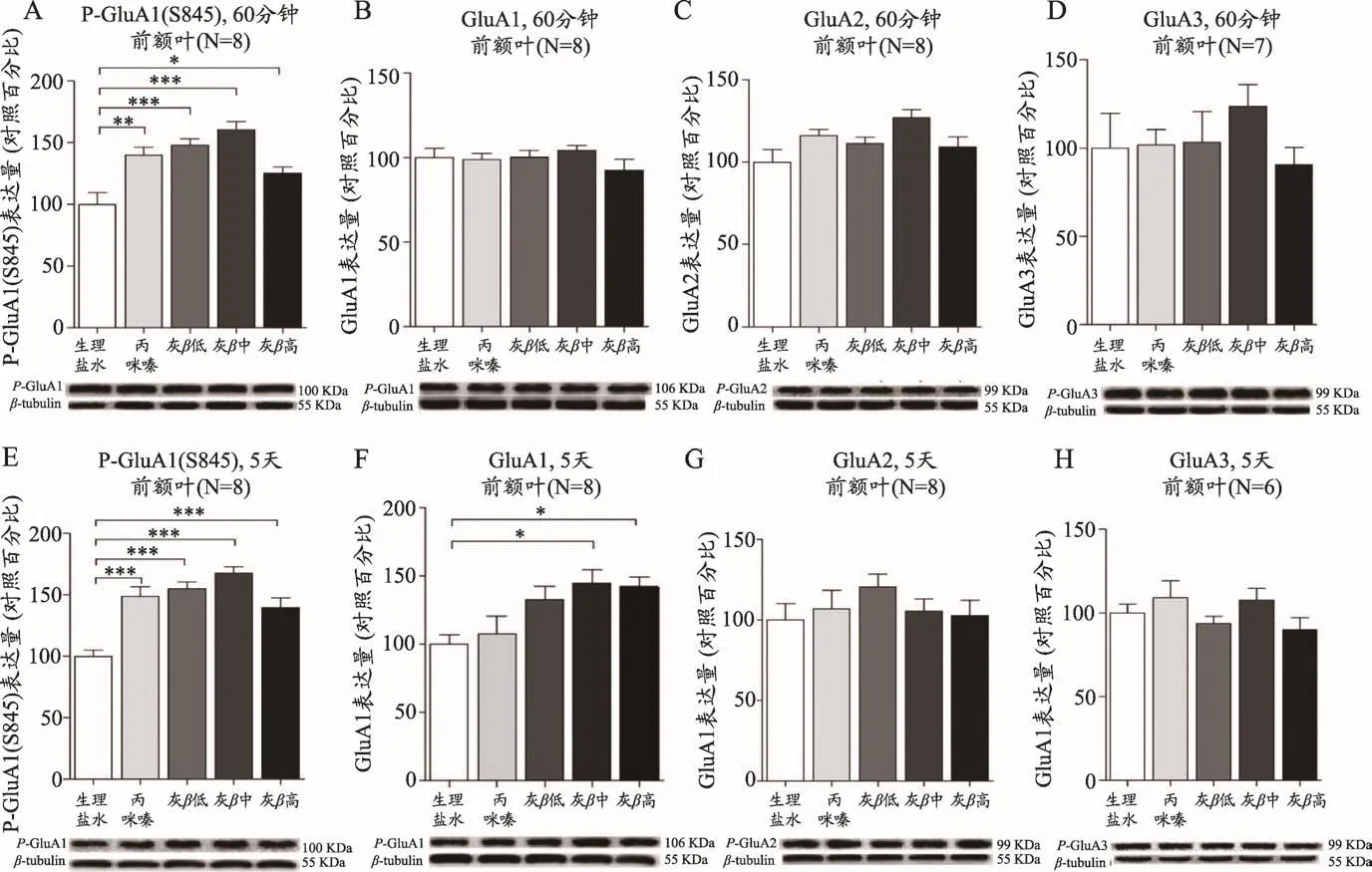
图4 [18]CD-1小鼠腹腔给药GFPβG低剂量(5 mg·kg-1,灰β低)、中剂量(8 mg·kg-1,灰β中)、高剂量(12.5 mg·kg-1,灰β高)、丙咪嗪(15 mg·kg-1)和生理盐水,给药60 min或5天后,通过免疫印迹对小鼠大脑前额叶组织中AMPA受体p-GluA1(S845)及其亚基GluA1、GluA2、GluA3表达水平检测。单因素方差分析(post hoc Tukey’s检验,*p<0.05,**p<0.01,***p<0.001)。GFPβG处理60 min后上调了p-GluA1(S845)磷酸化水平(A),而对GluA1(B)、GluA2(C)、GluA3(D)的表达水平没有影响。GFPβG处理5天后上调了p-GluA1(S845)磷酸化(E)和GluA1(F)的表达水平,而对GluA2(G)、GluA3(H)的表达水平没有影响。
大量研究表明AMPA受体亚基GluA1在Ser845位点的磷酸化是一个蛋白激酶A(PKA)位点,GluA1 Ser845磷酸化可以诱导神经元中AMPA受体活化,增加AMPA受体在神经元膜上的嵌入,促进LTP的发生,进而调节神经突触可塑性,因此GluA1 Ser845磷酸化被认为是一个广泛的通道开关[24-27]。临床研究结果表明,在抑郁症患者前额叶中AMPA受体亚基GluA1较正常人群表达水平显著降低[28,29]。我们研究发现,当GFPβG腹腔给药60 min后,可以快速增加CD-1小鼠前额叶中GluA1 Ser845位点的磷酸化水平,并促进前额叶皮层中GluA1在突触的定位,与阳性对照丙咪嗪结果相似[18](图4A)。当连续给药5天后,GFPβG和丙咪嗪均增加了小鼠前额中GluA1 S845的磷酸化水平,并促进了AMPA受体GluA1在前额叶及其突触部位的定位(图4E),值得一提的是,只有GFPβG增加了AMPA受体亚基GluA1水平[18](图4F),该结果与氯胺酮能够增强AMPA受体亚基GluA1信号来快速诱导突触的生长,使得氯胺酮具有持续一周左右的抗抑郁效果相似[30-32]。这些结果表明,GFPβG可以快速且持续的增加小鼠前额叶中GluA1 Ser845的磷酸化水平,进而活化AMPA受体亚基GluA1在前额叶及其突触部位的定位,而AMPA受体介导的神经突触可塑性异常与抑郁症的发生发展密切相关[33]。
2.4 增强突触中p-GluA1(S845)磷酸化和AMPA亚基的表达水平
大脑中AMPA受体四聚体类型主要有三种:即GluA1/2、GluA2/3和GluA1/3[34-36]。Ampuero等人研究发现,传统抗抑郁药物氟西汀的抗抑郁效果是通过调节大鼠前额叶皮层中GluA1/2型AMPA受体实现的[34]。我们的研究发现,GFPβG与丙咪嗪处理60 min或连续5天后,均显著增加了小鼠前额叶的突触中GluA1 Ser845位点的磷酸化水平;而在连续处理5天后,GFPβG与丙咪嗪均显著增加了小鼠前额叶的突触中GluA1、GluA2和GluA3的表达水平[18]。这些结果表明,GFPβG与丙咪嗪的抗抑郁效果也是通过调节前额叶中GluA1/2和GluA2/3 AMPA受体实现的。
2.5 GFPβG处理后的动物在停止给药后表现出延长的抗抑郁效果
先前研究表明氯胺酮等抗抑郁药物在动物行为学实验中表现出持续延长的抗抑郁效果,而且在总蛋白中上调了AMPA受体亚基GluA1分子水平[31,37]。我们研究中发现GFPβG在动物行为学实验中具有较强的抗抑郁效果,同时在总蛋白中也上调了AMPA受体亚基GluA1分子水平。我们研究中给CD-1小鼠腹腔连续注射高剂量GFPβG(12.5 mg·kg-1)和丙咪嗪(15 mg·kg-1)5天,而后停止给药长达3天或5天后进行抗抑郁行为学检测。实验结果表明GFPβG在小鼠悬尾和强迫游泳实验中表现出具有延长3天的抗抑郁效果,而停药5天后的强迫游泳实验结果表明,GFPβG延长的抗抑郁效果消失了[18]。
2.6 AMPA受体功能的增强在GFPβG发挥抗抑郁作用中具有重要作用
之前研究表明,锂盐、虫草素和右美沙芬等在小鼠悬尾和强迫游泳实验中表现出快速的抗抑郁效果是通过增强AMPA受体活性来实现的,并且AMPA受体特异性抑制剂能够阻断其抗抑郁效果[38-40]。研究表明,在小鼠慢性温和未知压力抑郁样模型悬尾实验中,AMPA受体抑制剂GYKI 52466有效抑制了氟西汀的抗抑郁效果[41];此外,Gould等人使用锂盐处理小鼠后,显著降低了小鼠在悬尾和强迫游泳实验中的不动时间,并且上调了AMPA受体亚基GluA1和GluA2的表达水平,且GYKI 52466几乎完全阻断了锂盐在动物抑郁样行为学实验中产生的抗抑郁效果[38],表明该抗抑郁效果是通过调节AMPA受体介导的信号通路实现的。与上述研究相似,我们使用AMPA受体特异性抑制剂GYKI 52466可以有效地抑制由GFPβG引起的快速抗抑郁效果[18],表明GFPβG的快速抗抑郁效果可能涉及AMPA受体介导的信号通路。
2.7 GFPβG的快速和较强的抗抑郁效果不同与神经兴奋性药物
虽然研究证实了氯胺酮具有快速且持续的抗抑郁效果[42],但考虑到其潜在的拟精神病效果和强烈的药物依赖性等副作用[30],目前美国食品药品监督管理局(FDA)还未将其列为临床治疗抑郁症的药物。还有研究表明其他一些神经兴奋性药物,如可卡因或安非他命也具有快速抗抑郁效果,但研究均显示这两种药物存在巨大的兴奋性神经毒性,并容易造成受试者强烈的药物成瘾性[43,44]。此外,这类神经兴奋性药物在停药期间会导致个体出现抑郁症状[45,46]。我们先前研究观察到GFPβG在小鼠体系中具有快速和能够延长3天左右的抗抑郁效果,与氯胺酮具有相似的效果,且旷野实验结果表明GFPβG处理组小鼠在总框和中心区域的移动距离较阴性对照生理盐水组无统计学差异,排除了其兴奋性中枢神经系统的作用;此外,GFPβG连续腹腔注射小鼠5天后并未影响体重变化,提示我们来自于药食同源性的野生菌灰树花中的GFPβG是一种相对比较安全的天然活性成分,具有较大的应用潜力和价值[18]。
3 总结与展望
中医药作为我国独特的药物资源优势,在许多疾病治疗中都具有独特的作用。中国已把中医药发展提升到国家战略高度,把“坚持中西医并重”确立为卫生与健康工作方针的重要内容,今后推动其落到实处将会大大提升居民健康水平。中药科学家屠呦呦研究员因在中药黄花蒿中发现青蒿素,使疟疾患者死亡率显著降低,获得2015年诺贝尔生理学或医学奖,这是中医药现代化对全球卫生与健康事业的突出贡献。
随着大量中医药对抑郁症疾病的深入研究,中医药在抑郁症的治疗上得到越来越多的认可和接受。近年来,国内外研究工作者都十分关注从传统药物、天然植物及菌类中寻找新型的抗抑郁活性药物,努力致力于中医药现代化的研究发展。
GFPβG是药食同源性的野生菌灰树花中的一种主要有效活性成分,我们先前研究发现GFPβG处理后的动物在行为实验中具有快速和延长3天的抗抑郁效果,深入其生物学机制研究表明,GFPβG是通过激活其受体Dectin-1增强神经突触兴奋性而产生的抗抑郁作用。这一发现将有利于开发出起效快、有延长抗抑郁药物作用、副作用小、安全的新型抗抑郁药物,也将有利于推动我国传统天然抗抑郁药物现代产业化的发展和进程。今后对于GFPβG发挥抗抑郁效果的作用生物学机制还有很多值得研究的方面,如需继续在抑郁样动物模型(如慢性温和不可预知压力模型、LPS诱导的炎症抑郁样模型和社会压力挫败模型等)中来深入研究:经GFPβG治疗后①神经免疫调节作用与抑郁症治疗之间的关系;②也将进一步检测Dectin-1下游信号分子的改变,从而来探讨GFPβG新的抗抑郁作用机制;③此外,也有大量文献表明抑郁症的发病与中枢神经中调控情绪的边缘系统密切相关,因此,除了大脑前额叶外,后续也将进一步检测边缘系统各关键脑区(如下丘脑、纹状体或海马等)中Dectin-1及AMPA受体在转录水平和翻译水平的变化。总之,中医药及其活性有效成分越来越多的被发现具有抗抑郁的潜能,尤其是中国拥有得天独厚的中药动植物和菌类资源,未来中医药在抑郁症临床和临床前的研究中都将值得进一步研究和挖掘。
1 Mathers C D,Loncar D.Projections of global mortality and burden of disease from 2002 to 2030.PLoS Med,2006,3(11):e442.
2 Holden C.Mental health.Global survey examines impact of depression.Science,2000,288(5463):39-40.
3 Cui J,Chisti Y.Polysaccharopeptides of Coriolus versicolor:physiological activity,uses,and production.Biotechnol Adv,2003,21(2):109-122.
4 Shen K P,Su C H,Lu T M,et al.Effects of Grifola frondosa non-polar bioactive components on high-fat diet fed and streptozotocin-induced hyperglycemic mice.Pharm Biol,2015,53(5):705-709.
5 Konno S.Synergistic potentiation of D-fraction with vitamin C as possible alternative approach for cancer therapy.Int J Gen Med,2009,2009(default):91-108.
6 Nanba H,Hamaguchi A,Kuroda H.The chemical structure of an antitumor polysaccharide in fruit bodies of Grifola frondosa(maitake).Chem Pharm Bull(Tokyo),1987,35:1162-1168.
7 Alonso E N,Ferronato M J,Gandini N A,et al.Antitumoral Effects of D-Fraction from Grifola Frondosa(Maitake)Mushroom in Breast Cancer.Nutr Cancer,2017,69(1):29-43.
8 Rajamahanty S,Louie B,O'Neill C,et al.Possible disease remission in patient with invasive bladder cancer with D-fraction regimen.Int J Gen Med,2009,2:15-17.
9 Soares R,Meireles M,Rocha A,et al.Maitake(D fraction)mushroom extract induces apoptosis in breast cancer cells by BAK-1 gene activation.J Med Food,2011,14(6):563-572.
10 Pyo P,Louie B,Rajamahanty S,et al.Possible immunotherapeutic potentiation with D-fraction in prostate cancer cells.J Hematol Oncol,2008,1(1):25.
11 Wasser S P.Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides.Appl Microbiol Biotechnol,2002,60(3):258-274.
12 LullC,WichersH J,SavelkoulH F.Antiinflammatoryand immunomodulating properties of fungal metabolites.Mediators Inflamm,2005,2005(2):63-80.
13 Brown G D,Gordon S.Immune recognition of fungal beta-glucans.Cell Microbiol,2005,7(4):471-479.
14 Brown G D,Herre J,Williams D L,et al.Dectin-1 mediates the biological effects of beta-glucans.J Exp Med,2003,197(9):1119-1124.
15 Kong E,Sucic S,Monje F J,et al.STAT3 controls IL6-dependent regulation of serotonin transporter function and depression-like behavior.Sci Rep,2015,5:9009.
16 Liu Y N,Peng Y L,Liu L,et al.TNFalpha mediates stress-induced depression by upregulating indoleamine 2,3-dioxygenase in a mouse model of unpredictable chronic mild stress.Eur Cytokine Netw,2015,26(1):15-25.
17 Yirmiya R,Rimmerman N,Reshef R.Depression as a microglial disease.Trends Neurosc,2015,38(10):637-658.
18 Bao H,Ran P,Zhu M,et al.The Prefrontal Dectin-1/AMPA Receptor Signaling Pathway Mediates The Robust and Prolonged Antidepressant Effect of Proteo-beta-Glucan from Maitake.Sci Rep,2016,6:28395.
19 Taylor P R,Brown G D,Reid D M,et al.The beta-glucan receptor,dectin-1,is predominantly expressed on the surface of cells of the monocyte/macrophage and neutrophil lineages.J Immuno,2002,169(7):3876-3882.
20 Shah V B,Huang Y,Keshwara R,et al.Beta-glucan activates microglia without inducing cytokine production in Dectin-1-dependent manner.J Immunol,2008(5),180:2777-2785.
21 Nagyoszi P,Wilhelm I,Farkas A E,et al.Expression and regulation of toll-like receptors in cerebral endothelial cells.Neurochem Int,2010,57(5):556-564.
22 Dennehy K M,Ferwerda G,Faro-Trindade I,et al.Syk kinase is required for collaborative cytokine production induced through Dectin-1 and Toll-like receptors.Eur J Immunol,2008,38(2):500-506.
23 Fang J,Wang Y,Lv X,et al.Structure of a beta-glucan from Grifola frondosa and its antitumor effect by activating Dectin-1/Syk/NF-kappaB signaling.Glycoconj J,2012.29(5-6):365-377.
24 Roche K W,O'Brien R J,Mammen A L,et al.Characterization of multiple phosphorylation sites on the AMPA receptor GluR1 subunit.Neuron,1996,16(6):1179-1188.
25 Banke T G,Bowie D,Lee H,et al.Control of GluR1 AMPA receptor function by cAMP-dependent protein kinase.J Neurosci,2000,20(1):89-102.
26 Lee H K,Barbarosie M,Kameyama K,et al.Regulation of distinct AMPA receptor phosphorylation sites during bidirectional synaptic plasticity.Nature,2000,405(6789):955-959.
27 Esteban J A,Shi S H,Wilson C,et al.PKA phosphorylation of AMPA receptor subunits controls synaptic trafficking underlying plasticity.Nat Neurosci,2003,6(2):136-143.
28 Beneyto M,Kristiansen L V,Oni-Orisan A,et al.Abnormal glutamate receptor expression in the medial temporal lobe in schizophrenia and mood disorders.Neuropsychopharmacology,2007,32(9):1888-1902.
29 Duric V,Banasr M,Stockmeier C A,et al.Altered expression of synapse and glutamate related genes in post-mortem hippocampus of depressed subjects.Int J Neuropsychopharmac,2013,16(1):69-82.
30 Caddy C,Giaroli G,White T P,et al.Ketamine as the prototype glutamatergic antidepressant:pharmacodynamic actions,and a systematic review and meta-analysis of efficacy.Ther Adv Psychopharmaco,2014,4(2):75-99.
31 Maeng S,Zarate C A,Du J,et al.Cellular mechanisms underlying the antidepressant effects of ketamine:role of alpha-amino-3-hydroxy-5-methylisoxazole-4-propionic acid receptors.Biol Psychiatry,2008,63(4):349-352.
32 Aan Het Rot M,Zarate C A,Charney D S,et al.Ketamine for depression:where do we go from here?Biol Psychiatry,2012,72(7):537-547.
33 Pittenger C,Duman R S.Stress,depression,and neuroplasticity:a convergence of mechanisms.Neuropsychopharmacology,2008,33(1):88-109.
34 Ampuero E,Rubio F J,Falcon R,et al.Chronic fluoxetine treatment induces structural plasticity and selective changes in glutamate receptor subunits in the rat cerebral cortex.Neuroscienc,2010,169(1):98-108.
35 Blanco E,Bilbao A,Luque-Rojas M J,et al.Attenuation of cocaineinduced conditioned locomotion is associated with altered expression of hippocampal glutamate receptors in mice lacking LPA1 receptors.Psychopharmacology(Ber),2012,220(1):27-42.
36 Blanco E,Pavon F J,Palomino A,et al.Cocaine-induced behavioral sensitization is associated with changes in the expression of endocannabinoid and glutamatergic signaling systems in the mouse prefrontal cortex.Int J Neuropsychopharmacol,2015,18(1):xi.
37 Burgdorf J,Zhang X L,Nicholson K L,et al.a NMDA receptor glycinesite functional partial agonist,induces antidepressant-like effects without ketamine-like side effects.Neuropsychopharmacology,2013,38(5):729-742.
38 Gould T D,O'Donnell K C,Dow E R,et al.Involvement of AMPA receptors in the antidepressant-like effects of lithium in the mouse tail suspension test and forced swim test.Neuropharmacology,2008,54(3):577-587.
39 Nguyen L,Matsumoto R R.Involvement of AMPA receptors in the antidepressant-like effects of dextromethorphan in mice.Behav Brain Res,2015,295:26-34.
40 Li B,Hou Y,Zhu M,et al.3'-Deoxyadenosine(Cordycepin)Produces a Rapid and Robust Antidepressant Effect via Enhancing Prefrontal AMPA Receptor Signaling Pathway.Int J Neuropsychopharmacol,2016,19(4):pyv112.
41 Farley S,Apazoglou K,Witkin J M,et al.Antidepressant-like effects of an AMPA receptor potentiator under a chronic mild stress paradigm.Int J Neuropsychopharmacol,2010,13(9):1207-1218.
42 Murrough J W.Ketamine as a novel antidepressant:from synapse to behavior.Clin Pharmacol Ther,2012,91(2):303-309.
43 McCance-Katz E F,Kosten T R,Jatlow P.Concurrent use of cocaine and alcohol is more potent and potentially more toxic than use of either alone--a multiple-dose study.Biol Psychiatry,1998,44(4):250-259.
44 Pierce R C,Kalivas P W.A circuitry model of the expression of behavioral sensitization to amphetamine-like psychostimulants.Brain Res Brain Res Rev,1997,25(2):192-216.
45 Che Y,Cui Y H,Tan H,et al.Abstinence from repeated amphetamine treatment induces depressive-like behaviors and oxidative damage in rat brain.Psychopharmacology(Berl),2013,227(4):605-614.
46 Krzascik P,ZajdaM E,MajewskaM D.Theneurosteroid dehydroepiandrosterone sulfate,but not androsterone,enhances the antidepressant effect of cocaine examined in the forced swim test--Possible role of serotonergic neurotransmission.Horm Behav,2015,70:64-72.

