糜蛋白酶原粗品中猪牛羊源性成分的PCR检测
丁金国 王欣 黄臻辉


摘 要 目的:采用PCR方法检测糜蛋白酶原粗品中的猪、牛、羊源性成分。方法:利用柱式动物基因组DNA抽提试剂盒从糜蛋白酶原粗品中提取残留DNA,以其为模板通过PCR扩增法进行动物源性成分鉴定及考察该方法的特异性及灵敏度。结果:柱提取法能够提取适用于PCR反应的模板DNA。PCR方法对猪、牛、羊源性成分的鉴定具有特异性,且灵敏度分别达到0.02、0.02和0.2 ng/mg。结论:建立了一种快速、有效、适用于糜蛋白酶原粗品中猪、牛、羊源DNA鉴别的方法。
關键词 糜蛋白酶原粗品 PCR 种属鉴定
中图分类号:TQ464.53 文献标志码:A 文章编号:1006-1533(2018)07-0077-04
Identification of porcine, bovine and sheep derived-components in crude chymotrypsinogen by PCR
DING Jinguo*, WANG Xin, HUANG Zhenhui
(SPH No.1 Biochemical & Pharmaceutical Co., Ltd., Shanghai 200240, China)
ABSTRACT Objective: To determine the porcine, bovine and sheep derived components in crude chymotrypsinogen by PCR. Methods: The residual DNA was extracted from crude chymotrypsinogen by Ezup genomic DNA extraction kit and used as template for the PCR to identify the animal origin. The specificity and sensitivity of the established method were verified and the contents of animal derived components in crude chymotrypsinogen could be determined by PCR. Results: DNA template for PCR could be extracted by the kit. The PCR assay was proved to be specific and sensitive with the detection limit as low as 0.02, 0.02, 0.2 ng/mg for porcine, bovine and sheep derived components, respectively. Conclusion: A rapid and effective method is established for the identification of porcine, bovine and sheep derived components in crude chymotrypsinogen.
KEy WORDS chymotrypsinogen; PCR; species identification
动物来源的生化原料粗品通常会残留物种DNA信息,利用残留DNA作为模板通过聚合酶链式反应(PCR)法进行种属鉴定具有快速、灵敏、特异性强的特点,在肝素粗品的质量控制中得到深入研究[1-4]。研究发现,肝素粗品中DNA残留量较低,检测灵敏度需达到0.1~0.3 ng/mg(每1 mg肝素粗品中含0.1~0.3 ng DNA)[2-3]。研究还发现肝素对DNA有较强的吸附作用,干扰残留DNA的提取。肝素粗品残留DNA提取液中还可能含有抑制PCR反应的成分。这些研究发展成为Biogx实时荧光PCR试剂盒,它能够高灵敏度定量检测肝素粗品中反刍动物(不能区分牛、羊)与猪源性成分,在工业界得到广泛应用[5]。
2017年国家食品药品监督管理总局发布《药品生产质量管理规范生化药品附录》,要求生化药品的原材料来源应相对稳定,应明确动物的种属及器官组织,必要时对原材料的动物种属进行鉴别。糜蛋白酶为生化药品,系从牛胰中提取的一种蛋白水解酶,可以分解炎症部位纤维蛋白的凝结物,促进血凝块、脓性分泌物及坏死组织的溶化分解,从而净化创面、使肉芽组织新生,促进伤口愈合;也可雾化吸入用于化痰。糜蛋白酶由糜蛋白酶原粗品经胰蛋白酶激活后,经多次盐析、结晶得到。糜蛋白酶原粗品由新鲜胰脏经绞碎、提取、反复硫酸铵盐析得到,新鲜胰脏富含DNA酶。考虑到从猪、羊胰脏中也能提取纯化得到糜蛋白酶原粗品,为从源头上控制产品质量,对糜蛋白酶原粗品中残留DNA进行提取,设计猪、牛、羊源性特异引物进PCR检测,建立了一种鉴别糜蛋白酶原粗品种属来源的方法。
1 材料和方法
1.1 材料
糜蛋白酶原粗品源自我公司;猪、牛、羊源性胰脏基因组DNA (103 ng/ml)购自Zyagen公司;BioGX反刍源和猪源DNA检测试剂(Promega公司,批号:218-16-002A);RT-PCR 级纯化水(Ambion by life technologies,批号:1512065); 2×Premix Taq (Takara Ex Taq 含1.25 U/25 ml,dNTP混合物各0.4 mmol/L,Ex Taq缓冲液4 mmol/L,Mg2+,Takara公司,批号:A9601A);Ezup柱式动物基因组DNA抽提试剂盒(批号:C107KA1949)、琼脂糖H (批号:BA23BA0002)、4s green plus 核酸染色液(批号:CA11BA0012)、6×上样缓冲液(批号:BC02KA1558)、DNA分子量标准C(批号:BA09KA1263)均购自上海生工生物公司。引物由上海生工生物公司合成;无水乙醇(分析纯,上海振兴化工一厂,批号:201605301)。
1.2 仪器
7500-Fast实时荧光PCR仪(美国Applied Biosystems Ltd.);Gusto微量离心机和LP涡旋振荡器(美国Thermo Ltd.);HH-W600数显恒温三用水箱(上海乔跃公司);电子天平(上海精科公司);电泳仪(美国BioRad公司);蓝光切胶仪(上海生工生物公司)。
1.3 实验方法
1.3.1 糜蛋白酶原粗品中残留DNA的提取
称取约250 mg糜蛋白酶原粗品,利用Ezup柱式動物基因组DNA抽提试剂盒进行DNA的提取,以50 ml CE Buffer洗脱,所得DNA溶液于-20 ℃保存或进行PCR检测。
1.3.2 实时荧光PCR
以Biogx反刍源和猪源DNA检测试剂为基础构建糜蛋白酶原粗品的实时荧光PCR检测体系:每管实时荧光PCR检测粉末用100 ml纯水溶解成反应预混液。反应预混液25 ml,模板DNA 1 ml。PCR反应条件为:95 ℃变性120 s,然后,95 ℃ 10 s,56 ℃ 60 s,45个循环,每个循环的退火过程采集荧光。每次实验设阳性和阴性反应对照。阳性对照以标准DNA(10 ng/ml)为模板DNA,阴性对照以纯水代替模板DNA。以牛胰标准DNA梯度稀释液获得的Ct值对DNA浓度的对数作图得标准曲线,将检测Ct值代入标准曲线即可算出DNA浓度。
1.3.3 PCR
PCR反应体系的构建:模板溶液1 ml,上游引物(10 pmol/ml)1 ml,下游引物(10 pmol/ml)1 ml,2×Premix Taq 12.5 ml,加纯化水至25 ml。反应条件为94 ℃变性3 min,然后,94 ℃ 30 s,57 ℃ 30 s,72 ℃ 50 s,40个循环;72 ℃ 10 min;反应结束后于4 ℃保温。取24 ml PCR扩增产物加入4 ml上样缓冲液(含0.25%溴酚蓝、0.25%二甲苯苯胺、60%甘油)混合后上样。1%(w/v)琼脂糖凝胶,电压120 V电泳40 min,在蓝光切胶仪下进行观察。通过与DNA分子量标准比较,判断PCR产物特异性条带的相对分子质量大小,从而对样品是否含有猪牛羊源性成分进行判定。
1.3.4 凝胶电泳图像
采用4s green plus 核酸染色液在蓝光仪上用普通相机拍照。
2 结果
2.1 糜蛋白酶原粗品中残留DNA的提取
糜蛋白酶原粗品中残留DNA是PCR的模板DNA来源,要求能够有效提取,且提取液中不能含有Taq酶抑制剂等影响PCR反应的成分。糜蛋白酶原粗品由新鲜胰脏经过多步纯化得到,加之胰脏中富含DNA酶,故DNA因分离去除和酶降解而残留量极低。糜蛋白酶原等大分子蛋白也会对残留DNA提取造成干扰。使用Biogx实时荧光PCR对牛胰标准DNA进行检测,其线性范围、检测限、检测回收率均经过验证。糜蛋白酶原粗品中加入牛胰标准DNA,用不同方法提取混合物中的DNA,经Biogx实时荧光PCR对提取液进行DNA定量检测,评估提取回收率。实验发现用1.3.1所述柱提取法可从糜蛋白酶原粗品中有效提取残留DNA,提取回收率可稳定在1%左右。
2.2 引物设计
Biogx实时荧光PCR具有较高的灵敏度与定量检测能力,但不能区分牛、羊源性DNA。选择线粒体基因组的特征性序列:猪细胞色素氧化酶亚基I(COX I)基因EU623453.1、牛COX I基因DQ487094.1、羊COX I基因EU834864.1,使用Primer Premier软件设计引物[5]。猪源性成分鉴别引物(5′至3′):上游GGCACCCTGTACCTACTATTTGG,下游ATTCCGAATCCTGGTAAGATGAG,产物长度713 bp。牛源性成分鉴别引物(5′至3′):上游GAGAGTAGTAGTAGTACGGCGGTAAT,下游CATCCTCTATAGTTGAAGCTGGG,产物长度253 bp。羊源性成分鉴别引物(5′至3′):上游TAGATCTAACTATTTTCTCCCTACATCTG,下游GGTGTTGGTATAGGATAGGGTCTC,产物长度273 bp。
2.3 方法特异性验证
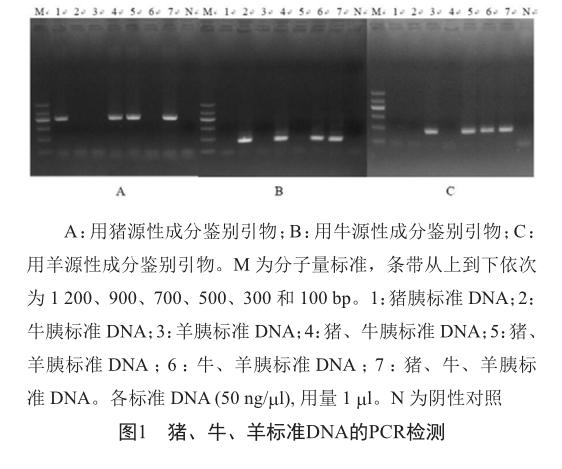
按照1.3.3所述配制PCR体系进行猪、牛、羊源性成分检测,琼脂糖凝胶电泳如图1所示。猪、牛、羊胰标准DNA及其混合物分别在相应的动物源性成分检测引物引导下进行PCR扩增,得到清晰且单一的条带。通过与DNA分子量标准比较,条带大小符合预期。产物条带经测序证明其核酸序列分别和猪COX I基因EU623453.1、牛COX I基因DQ487094.1、羊COX I基因EU834864.1相符。结果显示,所设计猪、牛、羊特异性引物分别仅可扩增出相应的动物源性成分(图1),说明本研究建立的PCR检测方法对猪、牛、羊源性成分检测具有高度特异性。
2.4 方法检测限验证
分别将1 ng/ml的猪、牛、羊胰标准DNA用水进行10倍梯度稀释,取各浓度的稀释液1 ml进行PCR检测,琼脂糖凝胶电泳如图2所示。随着模板量的减少,PCR产物条带亮度逐渐递减。以产生可清晰判断条带的最低模板量为本方法的检测限,可知猪、牛、羊胰标准DNA检测限分别为1 pg、1 pg和10 pg(图2)。250 mg糜蛋白酶原粗品经柱提取法抽提可得到50 ml提取液,如果提取液中牛残留DNA浓度达到1 pg/ml即可被检出。按照1%的提取回收率计算,即使250 mg糜蛋白酶原粗品中仅含有低至5 ng残留牛DNA也可被检出,检出限度为0.02 ng/mg。因而柱法提取联合PCR对糜蛋白酶原粗品中的猪、牛、羊源性成分能够特异性检出,检测限度可分别达到0.02、0.02和0.2 ng/mg。

2.5 糜蛋白酶原粗品中动物源性成分的PCR检测
结果如图3所示,糜蛋白酶原粗品1和2的DNA提取液中均检出牛源性成分且均未检出猪、羊源性成分;糜蛋白酶原粗品3的DNA提取液中猪、牛、羊源性成分均显示阴性。经Biogx实时荧光PCR检测该批次糜蛋白酶原中反刍DNA残留量为0.004 ng/mg,低于本文建立PCR的检测限,因此未检出。
3 讨论
糜蛋白酶原粗品种属来源的鉴别能够从源头上控制生化药品糜蛋白酶的质量、符合最新法规要求。
用Biogx实时荧光PCR可以用于评估残留DNA提取效率。本文参照文献磁珠法未能从糜蛋白酶原中有效提取DNA,而柱式提取法取得较好的效果。Ezup柱式动物基因组抽提试剂盒中含有蛋白酶K,可将与DNA结合的糜蛋白酶原等蛋白质降解,再通过吸附柱分离出DNA,分离液中不含有PCR反应抑制成分,从而获得可用于下一步PCR检测的DNA模板。
与肝素粗品类似,糜蛋白酶原粗品经过反复分离纯化,加上有DNA酶的降解作用,残留DNA含量极低,提取回收率也很低。因此选定合适的检测方法成为鉴别糜蛋白酶原粗品中动物源性成分的难点,特别是在保证鉴定结果特异性高的条件下还需尽量保证灵敏度。细胞色素氧化酶亚基I基因具有分子量小、结构简单稳定以及不与组蛋白结合因而裸露,并且拷贝数多。本文针对该基因设计并筛选出了特定引物对来区分偶蹄目中不同物种,通过优化选择了Takara Taq酶反应系统与PCR参数,PCR反应灵敏度达到pg级,符合糜蛋白酶原粗品中动物源性成分鉴定要求。
综上所述,本文建立了一种快速有效的、能够区分猪、牛、羊来源的糜蛋白酶原粗品的种属鉴定方法。研究结果能够明确糜蛋白酶原的种属来源,为生化药品糜蛋白酶的规范化生产提供了技術保证。为了能够检测残留DNA低于0.02 ng/mg的样品、定量检测糜蛋白酶原粗品中的异物种污染、提高检测效率,我们将优化残留DNA的提取方法以提高提取回收率,设计荧光探针提高PCR检测的灵敏度,调整引物使得猪、牛、羊源性PCR产物分子量差异明显且能够在同一反应体系中实现特异性反应,以实现多重PCR反应同时鉴定三个物种。
致谢:感谢汪雅雯、刘弘忍对本文的贡献。
参考文献
[1] 余燕, 何素婷, 王自强, 等. 实时荧光定量PCR和常规PCR检测肝水解肽样品中牛、猪源性成分的对比研究 [J].中国生化药物杂志, 2015, 32(5): 18-20.
[2] Concannon SP, Wimberley PB, Workman WE. A quantitative PCR method to quantify ruminant DNA in porcine crude heparin [J]. Anal Bioanal Chem, 2011, 399(2): 757-762.
[3] Auguste C, Dereux S, Martinez C, et al. New developments in quantitative polymerase chain reaction applied to control the quality of heparins [J]. Anal Bioanal Chem, 2011, 399(2): 747-755.
[4] Auguste C, Dereux S, Rousset M, et al. Validation of quantitative polymerase chain reaction methodology for monitoring DNA as a surrogate marker for species material contamination in porcine heparin[J]. Anal Bioanal Chem, 2012, 404(1): 43-50.
[5] Ekins J, Peters SM, Jones YL, et al. Development of a multiplex real-time PCR assay for the detection of ruminant DNA [J]. J Food Prot, 2012, 75(6): 1107-1112.

