乌腺金丝桃内生真菌分离鉴定及其醇溶物的抑菌活性
范东海,赵丽丽,常桂英
(吉林农业科技学院,吉林吉林132101)
植物内生菌是指生活史的某一或全部时期生活于健康植物体内,而又不引起寄主植物明显病害症状的细菌或真菌,它与植物在长期的进化过程中形成了互惠共生相互依存的关系[1]。
乌腺金丝桃(Hypericum attenuatum)别称稳心草、赶山鞭,属于植物界、被子植物门、木兰纲、山茶目、藤黄科(Guttiferae)金丝桃属(Hypericum)植物[2],作为中草药在民间广为使用。高度0.3~0.7 m,有发达的侧根和须根。茎竖直生长,植株上有许多黑色斑点分散生长,因而得名乌腺金丝桃。乌腺金丝桃叶片呈长卵形,花瓣五瓣、黄色,生长在植物顶端,果实深棕色、卵圆形,种子为细长的小圆柱形。一般在每年的7—8月间开花,在8—9月间结果。乌腺金丝桃大多分布在潮湿的小山丘、土坡、山脚路边的草丛、草原、石砾地、林地及其周围,广泛生长于中国黑龙江、吉林、辽宁及内蒙古等地区。金丝桃属植物的化学成分研究结果表明,该属植物主要含有二蒽酮类、黄酮类、间苯三酚类和芳香酸类[3-4]化合物等化学成分,具有抗菌消炎、收敛止血以及治疗黄疸、肝炎及疮疖肿毒的作用,对心律失常、心肌缺血、心衰和增强免疫力等具有较好的功效,同时还具有抗抑郁、抗肿瘤及抗病毒等活性[5]。尤其是其中的黄酮成分对心律失常、心肌缺血、心衰、抑郁等心血管疾病具有很强的药理活性。研究采用根段直接培养法[6],将传统形态分类与现代分子生物学技术相结合,对乌腺金丝桃根部真菌进行分离、鉴定,旨在为开展植物真菌研究提供帮助。
1 材料与方法
1.1 材料
乌腺金丝桃全草(采自吉林农业科技学院乌腺金丝桃栽培基地)。
1.2 试剂与仪器
1.2.1 主要试剂 乙醇(分析纯),氯化汞(分析纯),液氮,二甲苯(分析纯),PDA配方:马铃薯200 g、水1 L、葡萄糖20 g、琼脂20 g,pH值自然。
1.2.2 主要仪器 高压蒸汽灭菌锅(MLS-3751L-PC,松下健康医疗器械株式会社);超净工作台(SW-CJ-ZFD,苏州安泰空气技术有限公司);智能光照培养箱(PGX-350A,乔枫实业有限公司);冰箱(BCD-221TMBA,青岛海尔股份有限公司);高速离心机(HC-2514,科大创新股份有限公司中佳分公司);PCR扩增仪(THERM-1000,美国AXYGEN公司);电泳仪(JY600,北京君意东方电泳设备有限公司);凝胶成像仪(Image Quant LAS500,美国通用电气)。
1.3 方法与准备
1.3.1 材料的预处理 取健壮的纤细根用自来水冲洗干净,剪成1~2 cm段长。
1.3.2 消毒方法和时间选择 75%乙醇消毒30 s→无菌水冲洗3~4次→无菌滤纸吸干→0.1%氯化汞消毒1 min→无菌水清洗3~4次→无菌滤纸吸干
1.3.3 菌株的分离与纯化 将处理好的根段置于PDA培养基上,每皿接4段,10个重复,于25℃恒温培养。待菌丝从根段的横切面长出,并围绕根段生长形成菌落后,挑取尖端菌丝接于培养基中,纯化。纯化后的菌株转接在试管斜面培养基上,置于4℃冰箱内保存,备用。同时将最后1次无菌水冲洗液涂布于培养基中,于25℃恒温培养,作为对照判断表面消毒是否彻底。
1.3.4 内生真菌种属鉴定 对分离得到的内生真菌进行显微形态观察,根据其菌丝体颜色、孢子形态、产孢结构及有无横隔等特征,对其进行形态学鉴定[7-8]。除形态学鉴定外,通过分子生物学手段,通过扩增分析真菌rDNA的ITS序列,对其进行分子鉴定。
1.3.5 菌根真菌基因组DNA的提取 用十六烷基三甲基溴化铵(CTAB)法[9]提取真菌基因组DNA,在用酚-三氯甲烷提取前单独用酚抽提1次,除去蛋白质。
1.3.5.1 PCR反应及产物检测 选用的引物序列为:ITS1:5′-TCCGTAGGTGAACCTGCG-3′;ITS4:5′-TCCTCCGCTTA TTGATATGC-3′。用于 ITS扩增的 PCR反应体系见表1。PCR反应参数为94℃预变性5 min,94℃变性30 s,53℃退火1 min,72℃后延伸10 min,45个循环;72℃延伸30 s。

表1 ITS扩增的PCR 50μL反应体系
1.3.5.2 鉴定 取 5μL PCR产物,用 1.0%的琼脂糖凝胶进行电泳检测,由北京华大基因研究中心进行测序。
1.3.5.3 系统发育树的构建 将获得的菌根真菌的ITS全序列与GenBank中的核酸数据库进行同源性比对,选择同源性较高的序列。使用ClustalX1.81软件对筛选出的序列进行全序列多重比对,用MEGA5.1软件计算遗传距离,并以相应的种属为外群进一步采用N-J法聚类构建系统发育树。
1.3.6 乌腺金丝桃醇溶物的抑菌效果 (1)乌腺金丝桃醇溶物的提取:采摘乌腺金丝桃全草,洗净,将其干燥,80%乙醇浸提 12 h,收集醇溶液[10-12],提取浸膏,干燥,用真空冷冻抽滤机干燥得结晶物,置于-40℃下储存,备用。(2)供试菌液的制备:LB培养基的配制与灭菌→细菌的活化(37℃、24 h)→配制菌悬液备用。(3)滤纸片法抑菌效果测定:制备4种浓度分别为2、4、6、8 mg/mL的乌腺金丝桃醇溶物。采用滤纸片法,将直径为10 mm的滤纸片灭菌后,分别浸泡于各浓度胞外粗提物溶液中2 h,分别吸取0.4 mL各供试菌悬液涂布于培养皿上,且以无菌生理盐水组作对照。每个处理3个重复,置于37℃条件下培养24 h,测量各供试菌在不同浓度下的抑菌圈大小。
2 结果与分析
2.1 培养基观察结果
从乌腺金丝桃根中分离出1株于PDA培养基上生长良好的优势菌株,编号A85276。由图1、图2可知,菌落棉絮状,菌丝紧密生长,正面中部呈浅黄色,边缘呈白色;后期边缘呈粉红色,波浪状。菌丝有隔,分枝,孢子呈圆柱形。


2.2 系统发育树的构建
由所得的系统发育树(图3)可知,三线镰刀菌(Fusarium tricinctum)与编号菌株A85276相似度很高,而且处于系统发育树的同一分枝上,可证明所分离得到的菌株为三线镰刀菌。
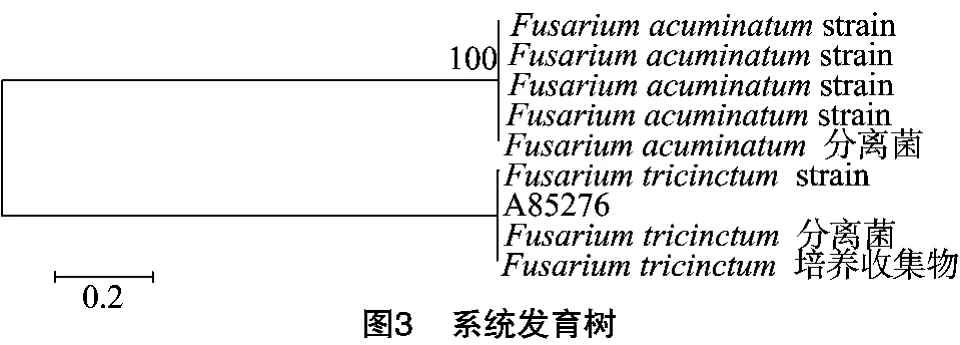
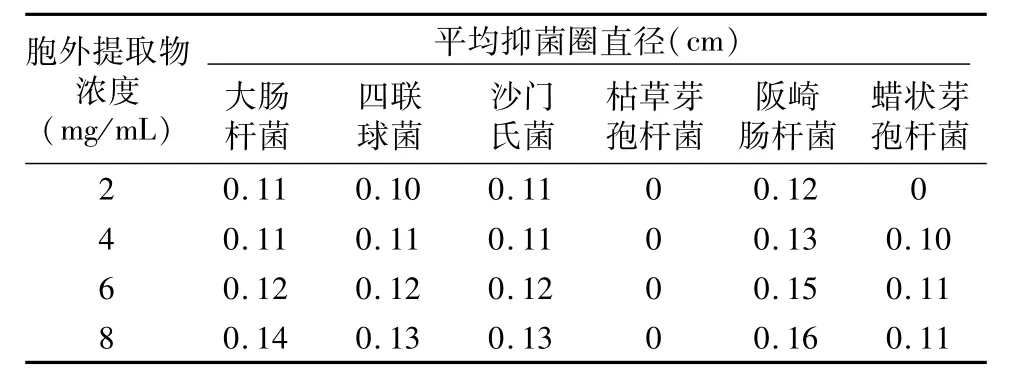
表2 乌腺金丝桃醇溶物的抑菌效果
2.3 乌腺金丝桃醇溶物的抑菌作用
由表2可见,乌腺金丝桃醇溶物的浓度越高,乌腺金丝桃醇溶物的抑菌圈直径整体越大,说明胞外粗提物的浓度与抑菌效果呈正相关关系;同时,沙门氏菌、阪崎肠杆菌、大肠杆菌等革兰氏阴性菌的抑菌圈直径比较长,而四联球菌、蜡状芽孢杆菌、枯草芽孢杆菌等革兰氏阳性菌的抑菌圈直径与革兰氏阴性菌相比较短。可能的原因是革兰氏阳性菌能产生外毒素,在菌体开始生长的阶段,代谢旺盛,细胞增殖快,外毒素含量高,对乌腺金丝桃醇溶物的活性破坏作用强,产生的抑菌效果不明显;革兰氏阴性菌能产生内毒素,在菌体生长阶段,代谢旺盛,细胞增殖快,也有少量衰亡、死亡的细胞会释放出内毒素,但含量低,对乌腺金丝桃醇溶物的活性破坏作用弱,产生的抑菌效果明显。
3 结论与讨论
采用根段直接培养法分离乌腺金丝桃内生真菌,在形态、分子鉴定的基础上,将来自药用植物乌腺金丝桃根部的1株内生真菌鉴定为三线镰刀菌。其对乌腺金丝桃的生长产生的影响还需要进一步研究。抑菌试验表明,乌腺金丝桃醇溶物对细菌有抑制作用,并与醇溶物浓度呈正相关,推测其醇溶物中可能含有抑制细菌生长的化学成分,未来可能在生物防治等方面提供作用。
综上所述,菌根研究的不断壮大,在一定程度上可丰富其他相关学科的内容,并促进其发展。特别是现代科学技术飞速发展的今天,基于学科之间的联合、相互渗透的大趋势,菌根研究对其他相关学科的进展将发挥越来越大的作用。
参考文献:
[1]邹文欣,谭仁祥.植物内生菌的研究新进展[J].植物学报,2001,43(9):881-892.
[2]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,2004.
[3]肖志勇.金丝桃属植物化学成分研究进展[J].中国野生植物资源,2004,23(1):6-7.
[4]江纪武,肖庆祥.植物药有效成分手册[M].北京:人民卫生出版社,1986.
[5]江苏省植物研究所,中国医学科学院药物研究所.新华本草纲要(一册)[M].上海:上海科学技术出版社,1991:214-218.
[6]肖 军,杨 涛,杨 镇,等.蓝莓菌根菌的分离与回接试验[J].辽宁农业科学,2012(5):13-16.
[7]戴芳澜.真菌的形态和分类[M].北京:科学出版社,1987.
[8]刘应仙,孙会林.菌根的作用及菌根真菌的分离和鉴定[J].中国林业,2011(4):52.
[9]庄彩云,李潞滨,杨 凯,等.适用于rDNA ITS分析的兰属菌根真菌培养及DNA提取方法[J].北京农学院学报,2007,22(3):4-6.
[10]张 喜.乌腺金丝桃中金丝桃素的含量测定及提取纯化金丝桃素的工艺研究[D].长春:吉林大学,2011.
[11]王 玲,索朗斯珠,马俊英.金丝桃素的提取分离及其药理活性研究现状[J].动物医学进展,2005,26(5):32-35.
[12]邢桂珍.金丝桃素的提取与化学合成工艺的研究[D].兰州:中国农业科学院兰州畜牧与兽药研究所研究生院,2007.

