采用蒙特卡洛法评定转基因玉米DAS-4-40278-9的测量不确定度
宋 君,叶先林,尹 全,张富丽,王 东,李 洁
(1.四川省农业科学院 分析测试中心,四川 成都 610066;2.四川省农业科学院 农村经济与农业信息研究所,四川 成都 610066)
与抗常见的草甘膦或草丁膦类除草剂转基因作物不一样,转基因玉米DAS-4-40278-9是一种抗吲哚乙酸衍生物(生长激素)——苯氧基羧酸类除草剂的转基因作物。DAS-4-40278-9玉米(商品名为EnlistTMMaize)由陶氏农业科学公司(DOW AgroSciences LLC)研发,2011年美国、澳大利亚、新西兰、墨西哥和中国台湾率先批准使用该玉米品系作为食品和饲料的生产、加工原材料。目前,该转基因玉米品系的商业化种植时间较短。2012年加拿大首次在本国进行商业化种植该品系,美国和巴西分别在2014和2015年开始商业化种植DAS-4-40278-9玉米[1]。截至目前,我国尚未批准转基因玉米DAS-4-40278-9进口。转基因玉米DAS-4-40278-9转化体的抗除草剂目的基因aad-1由来自玉米本身的启动子ZmPer3’UTR和终止子ZmUbi1调控。本实验室根据转基因玉米DAS-4-40278-9品系的外源基因与受体基因组间的旁侧序列设计了一对特异引物和探针,在优化PCR反应体系的基础上,建立了转基因玉米DAS-4-40278-9的实时荧光定量PCR检测方法,并验证和确认方法的特异性、灵敏度和准确度都达到欧盟转基因生物检测技术的要求[2-3]。
为了评估检测结果的质量、可靠性以及数据的可比较性,《检验检测机构资质认定评审准则》[4]要求实验室在特定情况下,在出具检测结果的同时给出检测结果的不确定度。转基因生物及成分的定量检测方法是随着20世纪末实时荧光定量PCR技术的发明和化学基团标记技术在寡核苷酸上的广泛应用的基础上发展起来的一种基因定量测量技术。由于转基因生物定量测量步骤繁多、所有反应都集中在20~100 μL内的试管中进行。因此,转基因成分的定量操作都是微量操作。微小的“误差”或“失误”经过聚合酶链式反应(polymerase chain reaction,PCR)都会被“放大”若干倍,导致结果产生极大的不确定度,但是目前不确定度在转基因成分定量检测中的应用却少有报道[5-6]。大多数从事转基因生物及产品的试验人员对不确定度知识及其评定了解甚少[7],而关于蒙特卡洛法(Monte Carlo Method,MCM)评定转基因生物成分的测量不确定度在国际上鲜见报道。
MCM是一种根据实验室测量的各输入量的概率分布,模拟抽取“海量”样本(每个输入量在95%包含概率下的抽样量为106次)、将海量样本按照设定的概率分布通过建立的数学测量模型传递、计算获得检测结果(输出量)的不确定度及包含区间的数值计算方法。MCM的实施必须在计算机的辅助下才能完成。为了避免计算复杂的偏导数(灵敏度系数)以及判断转基因生物及产品测量是否满足“正态分布假设”的困惑,本实验利用MCM来评定转基因玉米DAS-4-40278-9的测量不确定度,研究新方法在转基因生物及产品测量不确定度评定中的应用,为转基因成分测量不确定度评定提供适合的方法。
1 材料与方法
1.1 材料、试剂及仪器
用含量为10%的转基因玉米DAS-4-40278-9的基因组DNA的系列稀释溶液(5个浓度点)作为定量PCR仪的校准子(Calibrator)校准仪器(拟合校准曲线)。以含量为1%的转基因玉米DAS-4-40278-9标准品作为待测样品;DNA的分离与纯化采用北京天根生化科技有限公司生产的高效植物基因组DNA提取试剂盒;实时PCR试剂购自Toyobo公司(Osaka,Japan)生产的THUNDERBIRDTMProbe qPCR试剂盒;试验中用到的引物/探针按照本实验室报道的方法合成[2](上海生工合成和标记);分光光度计(Nanodrop-1000,Thermo,USA)和定量PCR仪(7500,ABI,USA)是本研究中用到的主要仪器设备,分别用于检测提取到的DNA的质量,扩增和定量检测玉米内源基因(zSSIIb)、转基因玉米DAS-4-40278-9片段。
1.2 测量方法
标准物质和试样DNA的分离和纯化,按照试剂盒说明书操作。
将提取到的标准物质DNA稀释成92.0、23.0、6.0、1.5、0.4 ng·μL-1。根据玉米基因组大小[8]估算,上述DNA溶液分别相当于每μL含1.7×106、4.0×105、1.0×105、2.5×104、6.3×103拷贝DNA分子。取3 μL上述系列标准物质DNA溶液作为20 μL PCR体系的扩增模板。PCR体系含2×Master MIX、上/下游引物(扩增玉米內源基因zSSIIb和DAS-4-40278-9片段)各0.5 μmol·μL-1、探针0.25 μmol·μL-1。PCR反应程序为95 ℃ 10 min、95 ℃ 15 s、60 ℃ 1 min(40个循环)。上述系列标准物质DNA溶液浓度点做3个平行扩增反应。5个浓度点的标准物质DNA的量及其PCR仪的响应值(threshold of cycles,Ct)作为PCR仪的校准子(calibrators),分别拟合zSSIIb和DAS-4-40278-9片段的校准曲线。
取待测样品的DNA约50~100 ng作为模板,分别扩增待测样品的玉米內源基因zSSIIb和DAS-4-40278-9片段,PCR体系和反应程序同上。待测样品重复测量24次。
2 结果与分析
2.1 测量模型
转基因成分定量检测的原理是利用一系列标准物质DNA作为PCR模板,通过內、外源基因的扩增反应,建立内/外源基因的校准曲线,然后将测试样品的内/外源基因的Ct值(PCR反应的仪器检测值)代入内/外源基因的校准曲线,获得测试样品的内/外源基因的绝对含量,再通过外源基因绝对含量与內源基因绝对含量的比值,计算得到测试样品中外源基因的相对含量。本文按照文献[7]建立测量模型。
2.2 MCM不确定度评定
根据GUM Supp1,MCM不确定度评定是利用对概率分布进行随机抽样进行分布传播的方法,通过建立的数学测量模型定义输出量(测试样品中转基因玉米DAS-4-40278-9的相对百分含量C),利用MATLAB软件实施MCM的输入(确定各输入量并设定输入量的概率分布函数(probability distribution function,PDF)、选择MCM试验样本量的大小M)、MCM的传播(从输入量的PDF中抽取M个样本值、对输入量的样本矢量计算相应输出量的模型值)和MCM的输出(计算获得输出量的平均值、标准不确定度和特定包含概率下的包含区间)。
2.2.1 MCM输入
系列标准物质DNA的已知量及其响应值(Cti)(表1和表2)和测试样品的内/外源基因的Ct值(表3)作为输入量。Cti和Ct遵循均匀分布R(a,b)(a为均匀分布的下限,b均匀分布的上限),构建ξ=a+(b-a)r(ξ为任意值,r为从标准均匀分布中抽取的随机数),从均匀分布中抽取106个样本。测试样品的内/外源基因的绝对含量(A)作为输入量,设定为正态分布N(y,u2(y))(y为最佳估计值,u(y)为标准不确定度),从标准正态分布N(0,1)中抽取随机数r,对任意值ξ,构造ξ=y+u(y)r。

表1 zSSIIb内源基因校准曲线拟合Table 1 Fitting of calibration curve for endogenous gene zSSIIb
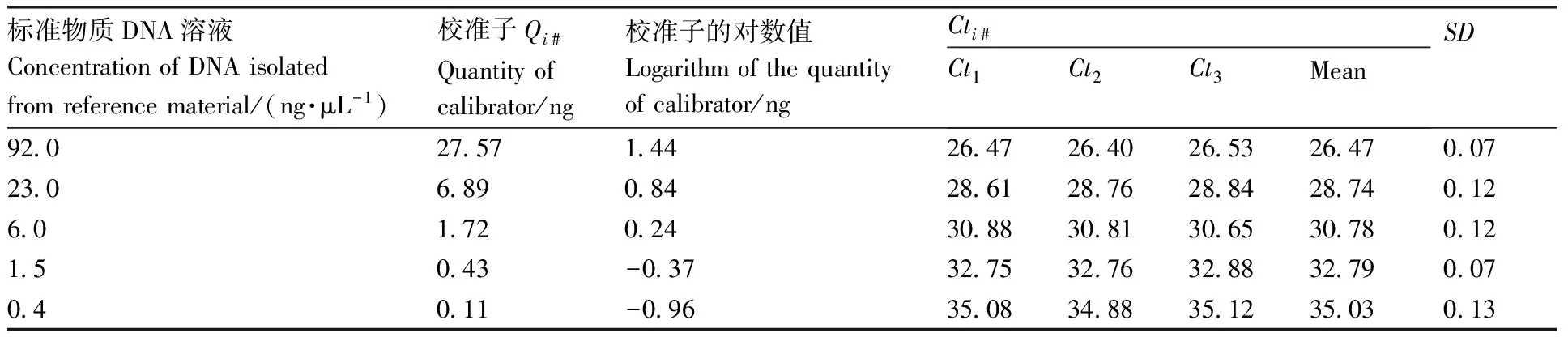
表2 DAS-4-40278-9片段校准曲线拟合Table 2 Fitting of calibration curve for the flanking fragments of DAS-4-40278-9 line
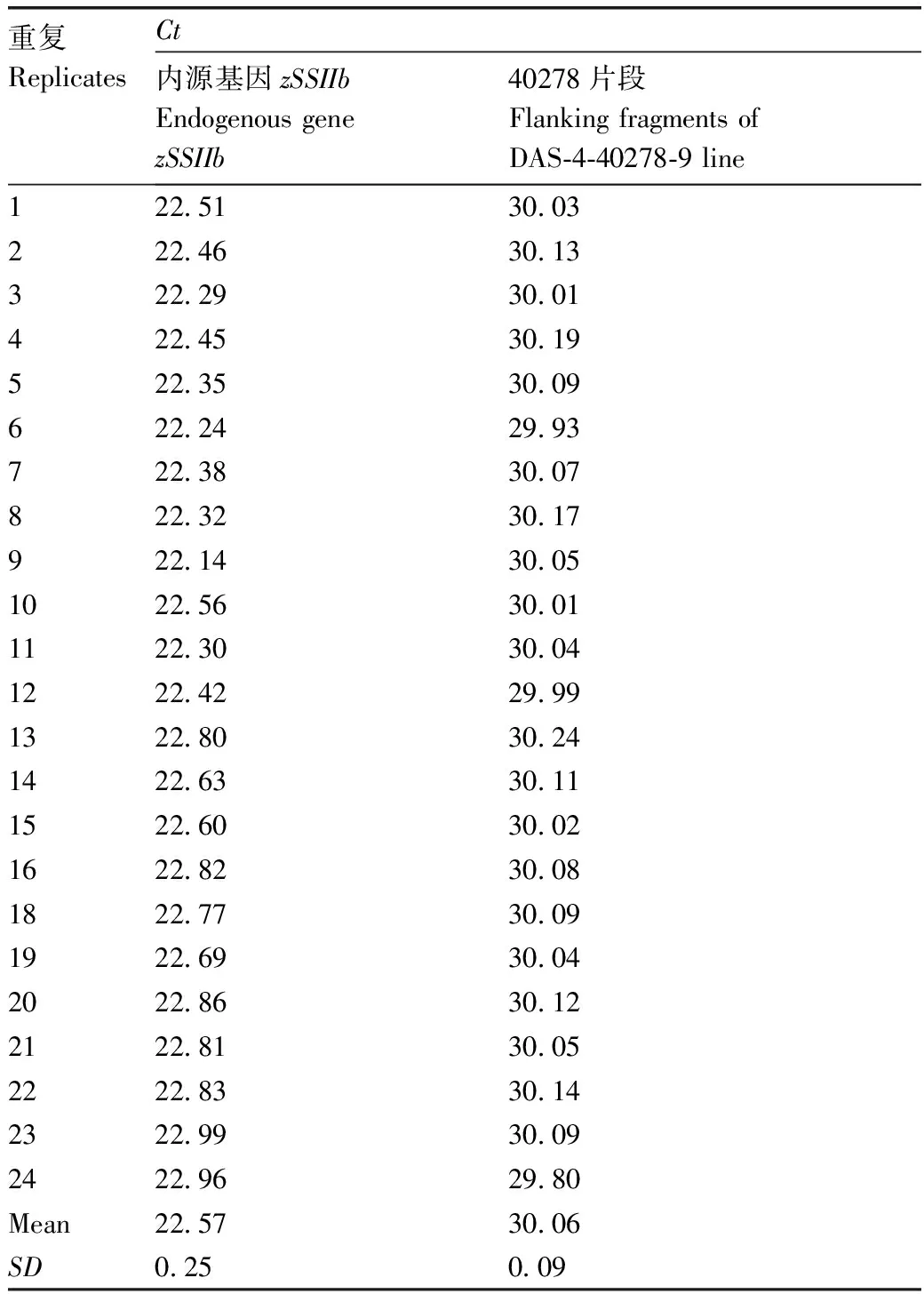
表3 试样中内源基因zSSIIb和DAS-4-40278-9片段的Ct值Table 3 Ct values for endogenous gene zSSIIb and the flanking fragments of DAS-4-40278-9 line in the testing sample
2.2.2 MCM传播和输出
从输入量Cti的PDF(均匀分布)中抽取M=106个样本值,计算获得内/外源基因校准曲线的斜率m和截距k。由于m和k是两个相关联的输出量,二者的PDF为双元正态联合(联合正态分布),所以在MCM传播过程中按JCGM 102∶2011[9]计算m和k。各输入量的分布类型、均值和包含区间见表4。类似地,从测试样品的内/外源基因Ct值的均匀分布中抽取106个样本量,计算获得内/外源基因绝对含量的PDF和平均值。从测试样品的内/外源基因绝对量的正态分布中抽取106个样本,获得输出量DAS-4-40278-9分子片段的相对含量C的PDF、平均值、标准不确定度以及包含区间。
3 结论
测试样品中转基因玉米DAS-4-40278-9的相对含量的平均值为1%,与理论含量一致,不确定度非常小(3.07×10-4)。转基因玉米DAS-4-40278-9相对含量的测量值在95%的概率下落在极小的分布范围0.94%~1.06%内,充分显示本次试验的测量质量高,数据可靠。MATLAB程序运行产生的转基因玉米DAS-4-40278-9相对含量的概率分布为正态分布。
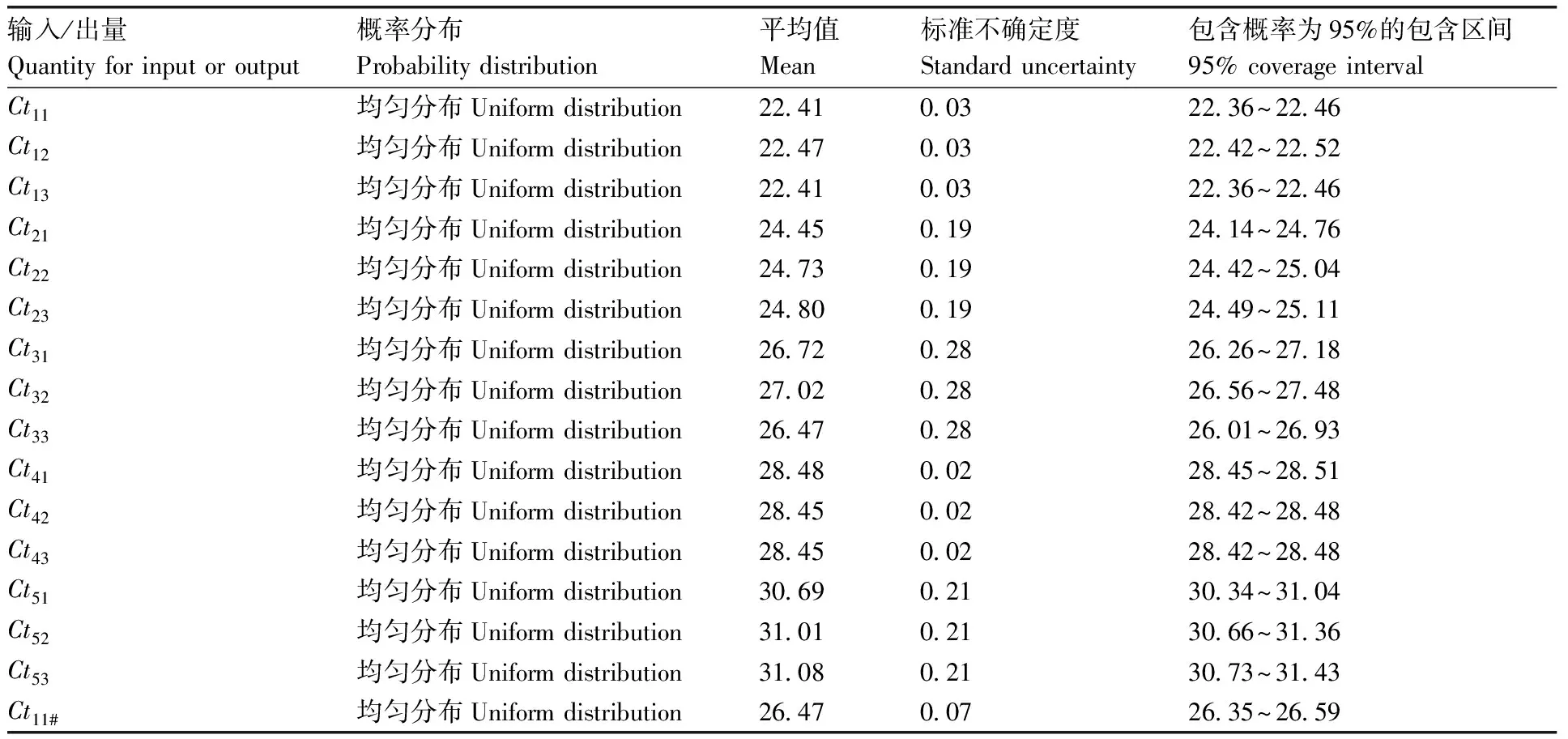
表4 各输入/输出量的分布及不确定度和95%置信度的包含区间Table 4 The probability distribution for all the input and output quantities and their 95% coverage intervals
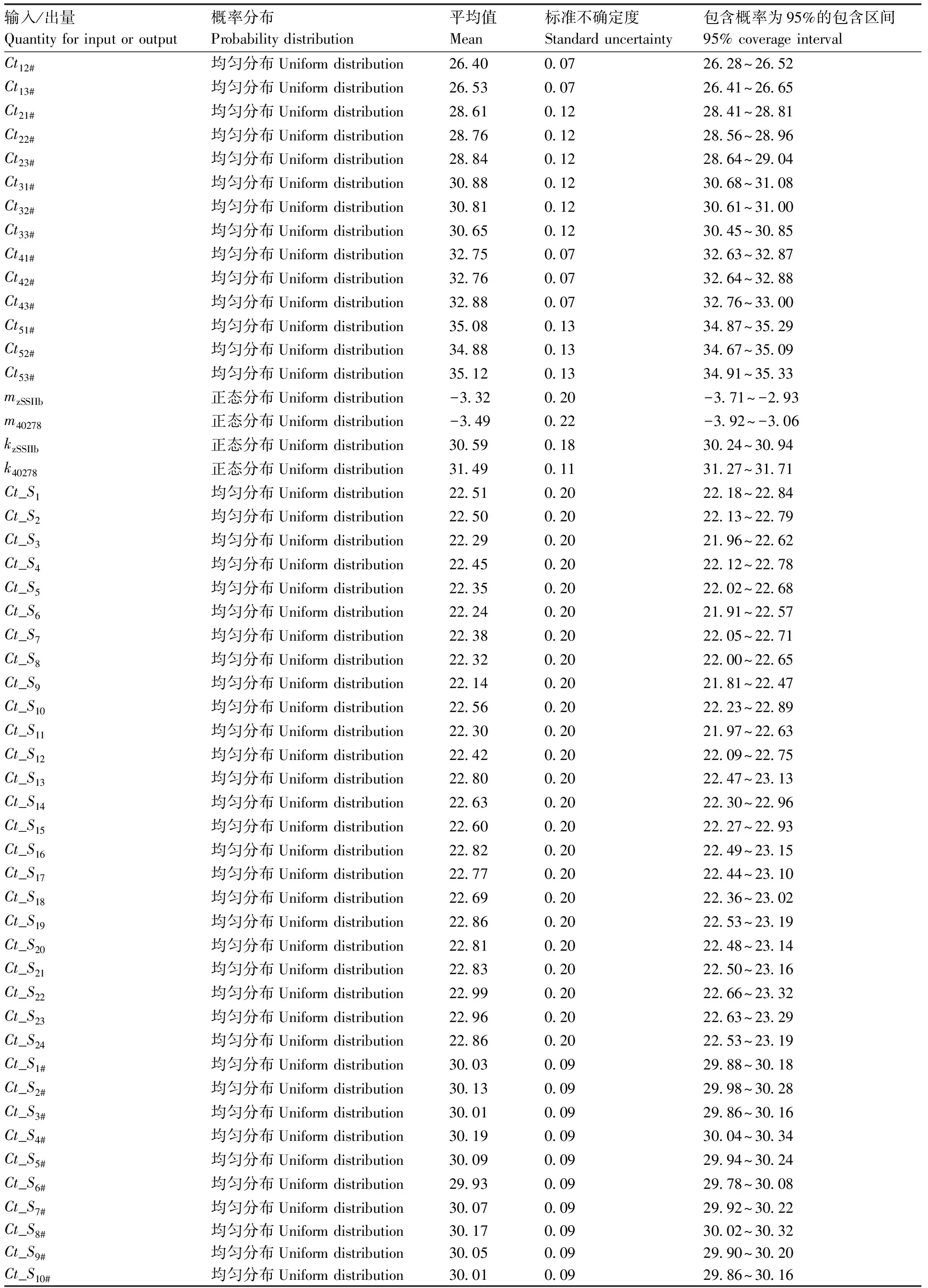
续表4

续表4
Ct11~Ct53(统称Cti)表示zSSIIb基因测量中标准物质各浓度点的响应值;Ct11#~Ct53#(统称Cti#)表示40278测量中标准物质各浓度点的响应值;Ct_S1~Ct_S24(统称Ct_Si)表示试样24次重复测量zSSIIb基因获得的Ct值;Ct_S1#~Ct_S24#(统称Ct_Si#)表示试样24次重复测量40278片段获得的Ct值;Q_zSSIIb表示试样中zSSIIb的绝对含量;Q_40278表示试样中40278片段的绝对含量;C表示试样中40278片段的相对含量;mzSSIIb和m40278分别为zSSIIb基因和40278片段的校准曲线的斜率;kzSSIIb和k40278分别为zSSIIb基因和40278片段的校准曲线的截距。
Ct11~Ct53(Cti) represents the instrument response of theithcalibrator used as the DNA template for PCR ofzSSIIbgene;Ct11#~Ct53#(Cti#) represents the instrument response of theithcalibrator used as the DNA template for PCR of 40278;Ct_S1~Ct_S24(Ct_Si) represents theithCtvalues forzSSIIbgene in the test sample;Ct_S1#~Ct_S24#(Ct_Si#) represents theithCtvalues for 40278 fragments in the test sample;Q_zSSIIbrepresents the absolute content forzSSIIbgene in the test sample;Q_40278 represents the absolute content for 40278 fragments in the test sample;Crepresents the measurand the relative content of 40278 fragments in the test sample;mzSSIIbandm40278represent slopes of calibration curves forzSSIIband 40278 fragments,respectively;kzSSIIbandk40278represent intercepts of calibration curves forzSSIIband 40278 fragments,respectively.

图1 DAS-4-40278-9片段相对含量的概率分布Fig.1 Probability distribution for the relative content of DAS-4-40278-9 fragments in the test sample
在所有输入/出量的不确定度中,玉米内源基因zSSIIb绝对定量的不确定度最大,达到7.25 ng,这与样品中细胞的裂解率、DNA的提取率和PCR模板的扩增率不一致有关。因此,采用绝对定量来表征转基因成分的含量是极不科学的。转基因成分的含量一般用相对含量表达,通过采用外源基因绝对含量除以内源基因绝对含量来降低细胞裂解率、DNA提取率和DNA模板扩增率不一致导致的测量结果偏差。除内源基因zSSIIb绝对定量的不确定度外,DNA溶液的系列梯度稀释中的6.0 ng·μL-1浓度点的稀释产生的不确定度达到0.28(Ct31~Ct33),0.4 ng·μL-1DNA溶液的稀释产生的不确定度为0.21(Ct51~Ct53),23 ng·μL-1DNA溶液的稀释产生的不确定度为0.19(Ct21~Ct23)。这在所有不确定度中具有相对较大的贡献,因此是影响转基因成分测量的主要因素。在解决如何提高转基因成分检测质量时,应重点考虑提高参考物质DNA溶液浓度的稀释的准确度,降低其不确定度。
本实验在MATLAB软件的基础上编写了“概率分布传播”的计算机程序代码,应用MCM法评定了转基因成分的测量不确定度。与传统的GUM法相比,MCM法完全采用计算机程序辅助,避免了采用GUM法需要手动计算复杂的各输入量的灵敏度系数的偏导数。同时,MCM法获得的不确定度评定结果的概率分布可能是正态分布或其他分布,因此在使用MCM法时无需再考虑输入量的对称性和遵守输出量正态分布的假设。实践中,为了获得可靠的不确定度评定结果,研究人员往往还要使用MCM法对GUM法的评定结果进行验证,建议在开展转基因成分测量不确定度评定时应尽量采用MCM法。
参考文献(References):
[1] ISAAA. GM crop database[EB/OL]. (2017-08-08)[2017-12-01]. http://www.isaaa.org/gmapprovaldatabase/event/default.asp?EventID=139.
[2] 尹全,李忆,王东,等. 转基因抗除草剂玉米DAS-40278-9 品系特异实时荧光定量PCR 检测方法的建立[J]. 中国食品学报,2016,16(5):147-154.
YIN Q,LI Y,WANG D,et al. Establishment of event-specific quantitative PCR of event DAS-40278-9 herbicide-tolerant maize[J].JournalofChineseInstituteofFoodScienceandTechnology,2016,16(5):147-154. (in Chinese with English abstract)
[3] ZEL J,MILAVEC M,MORISSET D,et al. How to reliably test for GMOs[M]. New York: Springer,2012.
[4] 范华. 实验室资质认定管理体系理论与实践[M]. 北京:中国水利水电出版社,2014.
FAN H. The theory and practice of the management system for laboratory qualification[M]. Beijing: China Water and Power Press, 2014.
[5] 宋君,雷绍荣,刘勇,等. 实时荧光定量PCR检测转基因玉米NK603结构特异基因的测量不确定度研究[J].西南农业学报,2012,25(4):1147-1151.
SONG J,LEI S R,LIU Y,et al. Uncertainty in measuring construct specific fragments of genetically modified maize,event NK603,by quantitative real time PCR[J].SouthwestChinaJournalofAgriculturalSciences,2012,25(4):1147-1151. (in Chinese with English abstract)
[6] 宋君,雷绍荣,郭灵安,等. 实时荧光定量PCR检测转基因玉米MON863的测量不确定度分析[J]. 玉米科学,2012,20(5):45-49.
SONG J,LEI S R,GUO L A,et al. Uncertainty in measuring flanking fragments of genetically modified maize,event MON863,by quantitative real time PCR[J].JournalofMaizeSciences,2012,20(5):45-49. (in Chinese with English abstract)
[7] SONG J,NIU B,WANG D,et al. Quantifying the measurement uncertainty of the nopaline synthase terminator in mixed samples of genetically modified rice using a bottom-up approach[J].FoodControl,2017,73:1548-1555.
[8] ARUMUGANATHAN K,EARLE E. Nuclear DNA content of some important plant species[J].PlantMolecularBiologyReporter,1991,9(3):208-218.

