芥蓝1-脱氧-D-木酮糖-5-磷酸合成酶基因BaDXS1的克隆及原核表达
薛生玲,江 敏,常嘉琪,刘 洋,魏 淋,周建坤,张 芬,孙 勃,*
(1.四川农业大学 园艺学院,四川 成都 611130; 2.浙江大学 园艺系,浙江 杭州 310058)
芥蓝(Brassicaalboglabra)属十字花科芸薹属蔬菜,主要以花薹和嫩叶为食用器官,起源于我国南方,在广东、福建等地区广泛栽培[1]。芥蓝具有悠久的栽培历史和丰富的种质资源,因其富含维生素C、芥子油苷、类胡萝卜素及总酚等物质,而具有极高的营养价值和保健作用[2],深受广大人民群众的喜爱。
类胡萝卜素是萜类物质[3],在植物质体中主要依靠2-甲基-D-赤藓糖醇-4-磷酸途径(2-methyl-D-erythritol-4-phosphate pathway,MEP)合成[4]。1-脱氧-D-木酮糖-5-磷酸合成酶(1-deoxy-D-xylulose-5-phosphate synthase,DXS)是该途径的首要限速酶,Lois等[5]研究发现,在番茄的成熟过程中,DXS的表达量与类胡萝卜素的积累成正比;Estévez等[6]通过在拟南芥中超量表达DXS基因,叶绿素、类胡萝卜素、维生素E、赤霉素和脱落酸等萜类物质的含量都提高了,而将DXS基因沉默后,这些物质含量均降低了;潘夕春等[7]通过将番茄DXS基因转入已重建了番茄红素生物合成途径的大肠埃希菌中,发现该菌能大量积累番茄红素。这些研究结果显示,DXS表达量的高低与上述萜类物质的含量成正相关,进一步证实了DXS是萜类物质生物合成途径中的一个关键酶。目前,DXS基因已从番茄[7]、玉米[8]、鱼腥草[9]、茉莉花[10]、思茅松[11]、土豆[12]等多种植物中成功分离,而芥蓝中尚未发现有关该基因的报道。
本研究采用RT-PCR方法,以芥蓝叶片为材料,首次分离出BaDXS1基因的CDS全长,对该基因序列进行生物信息学分析,并构建原核表达载体,将该基因转化至大肠埃希菌体内,进行诱导表达。本实验为进一步研究BaDXS1基因的生物学功能及芥蓝中类胡萝卜素的合成调控提供了理论依据。
1 材料与方法
1.1 实验材料
实验材料为白花芥蓝品种明丰香菇,待幼苗长出3~4片真叶,剪取其新鲜叶片进行总RNA提取,用于后续实验。
1.2 实验试剂
反转录试剂盒、DL2000 DNA Marker、EmeraldAmp Max PCR Master Mix(2×Premix)、Premixed Protein Marker(Broad)(6.5~200 ku)等购于大连宝生物公司,SanPrep柱式DNA胶回收试剂盒、异丙基硫代半乳糖苷(IPTG)、X-Gal、氨苄青霉素(Amp)等购于上海生物工程有限公司,TransStartFastPfuFly DNA Polymerase聚合酶、pEASY-Blunt Cloning Kit、pEASY-Blunt E1 Expression Kit、BL21(DE3)表达感受态细胞、Trans1-T1克隆感受态细胞等购于北京全式金生物技术有限公司。
1.3 总RNA提取与反转录cDNA合成
用改良的CTAB法[13]提取芥蓝明丰香菇的总RNA,参照TaKaRa反转录试剂盒说明书进行cDNA模板的合成,所得产物于-20 ℃保存。
1.4 基因克隆
根据NCBI已公开的甘蓝、白菜等同源物种的DXS基因序列设计芥蓝特异性引物(表1),引物送至上海生工生物工程公司合成。PCR扩增反应体系(40 μL):模板1.6 μL,引物(10 μmol·L-1)各1.6 μL,缓冲液8 μL,2.5 mmol·L-1dNTP 3.2 μL,Taq酶0.8 μL,ddH2O 23.2 μL。PCR扩增条件:94 ℃ 2 min;94 ℃ 20 s,57 ℃ 20 s,72 ℃ 33 s,共40个循环;72 ℃再延伸10 min;12 ℃保存。扩增产物经1.0%琼脂糖凝胶电泳检测合格后,用SanPrep柱式DNA胶回收试剂盒纯化回收产物。将产物连接至平末端pEASY-Blunt克隆载体上,转入大肠埃希菌Trans1-T1克隆感受态细胞中,挑取阳性单菌落扩大培养,经菌液PCR筛选后,送至上海生工生物工程公司测序。
1.5 生物信息学分析
利用NCBI-ORF、ExPASy在线软件计算其分子量、等电点、不稳定系数等理化性质;TMHMM软件分析和推测蛋白质跨膜结构;WoLF PSORT软件进行亚细胞定位预测;ChloroP 1.1软件预测是否存在转运肽;在NCBI网站上用BLAST程序及DNAMAN软件进行同源序列比对及保守结构域分析; DNAMAN软件进行系统进化树的构建[14-15]。
1.6 原核表达载体构建及表达
利用Rare Codon Calculator(RaCC)在线软件对芥蓝BaDXS1序列进行稀有密码子分析。将纯化回收后的芥蓝BaDXS1基因片段与原核表达载体pEASY-Blunt E1在25 ℃下连接30 min,连接产物转化至大肠埃希菌Trans1-T1克隆感受态细胞,涂在LB(含Amp)固体培养基上,挑取白色单菌落,经菌液PCR和测序等检测,采用碱裂解法提取筛选出的重组质粒pEASY-Blunt E1-BaDXS1。将提取的重组质粒转入大肠埃希菌表达感受态BL21(DE3)细胞,在D值为0.6~0.8、37 ℃条件下经1 mmol·L-1的IPTG诱导表达8 h后提取蛋白。最后,将处理的样品取10 μL经SDS-PAGE电泳和考马斯亮蓝染色,检测目的蛋白在大肠埃希菌内的表达情况和存在形式。

表1 芥蓝BaDXS1基因克隆引物Table 1 The cloning primer of BaDXS1 in Brassica alboglabra
2 结果与分析
2.1 芥蓝DXS1基因的克隆
将PCR扩增产物经1%的琼脂糖凝胶电泳检测后(图1),得到一条约2 000 bp的条带,与目的基因DXS的片段大小相符。测序后,确定该序列的CDS全长为2 139 bp,并将其定名为芥蓝BaDXS1。
2.2 生物信息学分析
利用NCBI-ORF和ExPASy软件对芥蓝BaDXS1基因所编码的氨基酸进行理化分析,结果表明,BaDXS1由712个氨基酸残基组成,氨基酸种类和比例见图2;分子式为C3417H5418N962O1019S29;理论分子量为77.21 ku,等电点(pI)为8.59,为碱性蛋白;不稳定指数为36.69,属稳定蛋白;脂肪指数为85.07,平均亲水系数为-0.160。利用TMHMM软件预测BaDXS1蛋白无跨膜结构。亚细胞定位软件WoLF PSORT预测BaDXS1蛋白位于叶绿体。在线软件ChloroP预测BaDXS1蛋白的N端具有41个氨基酸的质体转运肽序列。
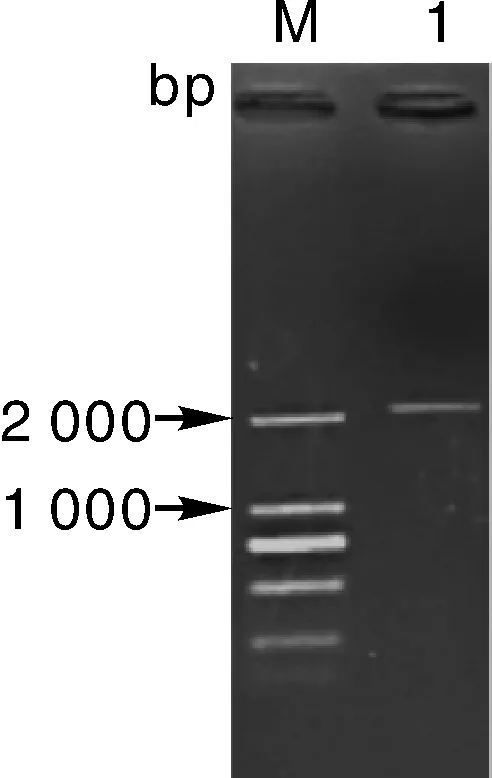
M,DL2000; 1,PCR产物。M,DL2000; 1,PCR products.图1 BaDXS1基因PCR扩增产物Fig.1 PCR amplification products of BaDXS1
利用NCBI-CDD对BaDXS1氨基酸序列进行保守结构分析(图3),发现该蛋白含TPP结合位点、转酮醇结构域、1-脱氧-木酮糖-5-磷酸合酶嘧啶结合功能域等多个结构域。对BaDXS1氨基酸序列与6种不同植物的DXS氨基酸序列进行NCBI-BLAST比对并结合DNAMAN软件进行分析,芥蓝DXS1与甘蓝(Brassicaoleracea,XP_013622774.1)、拟南芥(Arabidopsisthaliana,AAC49368.1)、番茄(Solanumlycopersicum,NP_001234672.1)、烟草(Nicotianatabacum,NP_001312959.1)、菠菜(Spinaciaoleracea,KNA08069.1)和橙子(Citrussinensis,KDO74968.1)的DXS氨基酸相似性分别为100%、84.56%、79.69%、79.78%、77.27%和78.84%。序列比对结果表明,DXS氨基酸序列的相似性较高,说明该蛋白在进化过程中高度保守,且C端序列相较于N端序列保守(图4),ChloroP 1.1预测显示BaDXS1的N端含一段41个氨基酸的转运肽序列。
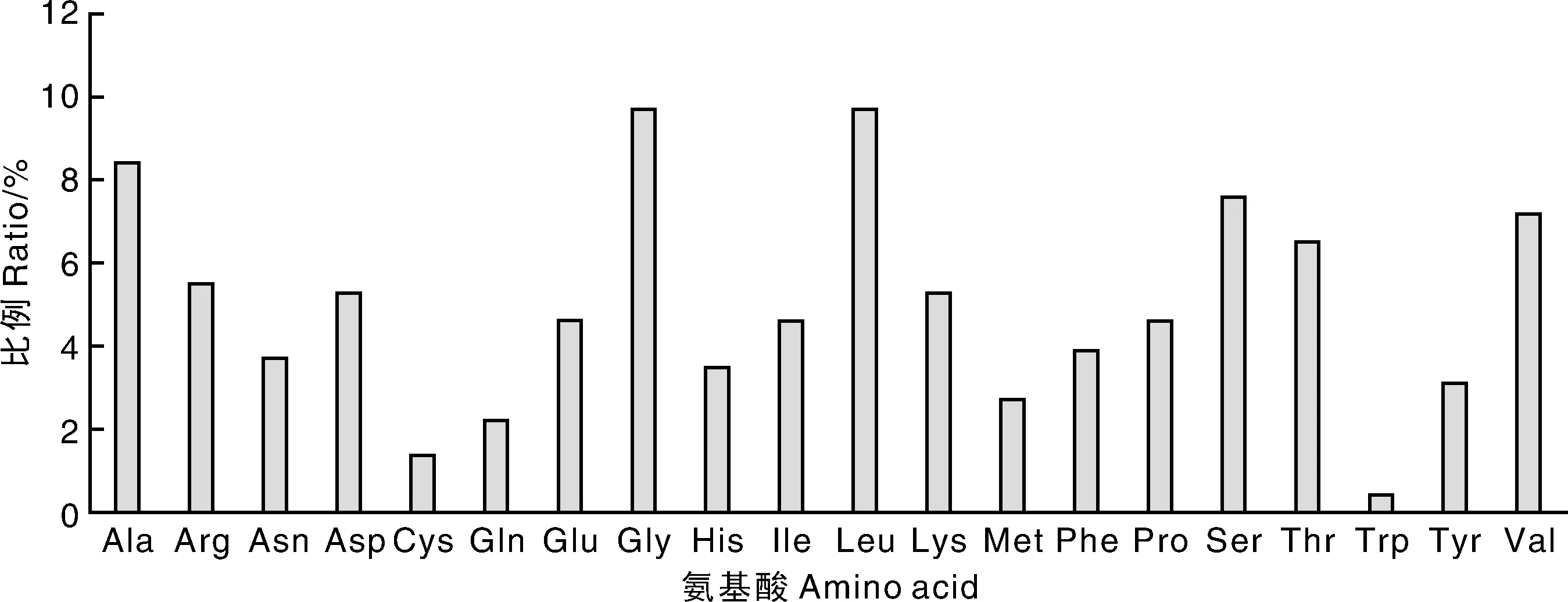
图2 芥蓝BaDXS1蛋白的氨基酸组成Fig.2 Amino acid composition of BaDXS1
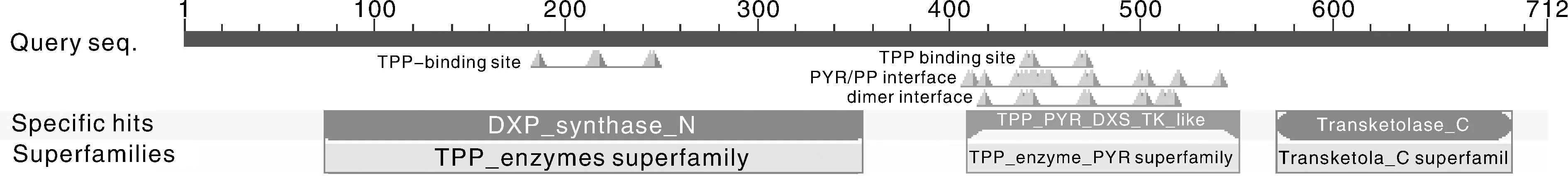
图3 BaDXS1蛋白保守结构域分析Fig.3 Conserved domains analysis of BaDXS1

Ba,芥蓝; Bo,甘蓝; At,拟南芥; Sl,番茄; Nt,烟草; So,菠菜; Cs,橙子。Ba,Brassica alboglabra; Bo,Brassica oleracea (XP_013622774.1); At,Arabidopsis thaliana (AAC49368.1); Sl,Solanum lycopersicum (NP_001234672.1); Nt,Nicotiana tabacum (NP_001312959.1); So,Spinacia oleracea (KNA08069.1); Cs,Citrus sinensis (KDO74968.1).图4 DXS蛋白的氨基酸序列比对Fig.4 Alignment of deduced amino acid sequences of DXS
根据NCBI已公布的不同物种的DXS氨基酸序列,选取16种与芥蓝BaDXS1蛋白进行系统进化树分析,采用邻近法(neighbor-joining)构建系统发育树(图5)。该进化树分为3个大的分支,第一大分支包括十字花科的芥蓝、甘蓝、欧洲油菜、白菜、萝卜、荠菜及拟南芥和茄科的烟草、番茄、土豆及南非醉茄2个小支;第二大分支包括芸香科的克莱门柚及橙子和大戟科的橡胶树、麻疯树及蓖麻2个小支;杨柳科的毛果杨单独形成1支。结果表明,同科物种间的DXS在进化过程中亲缘关系较近,其中十字花科芥蓝BaDXS1与其同属的甘蓝BoDXS亲缘关系最近。
2.3 原核表达
将重组质粒pEASY-Blunt E1-BaDXS1转化至大肠埃希菌表达感受态细胞BL21(DE3)中,经IPTG诱导后,提取总蛋白,进行SDS-PAGE电泳及考马斯亮蓝染色检测(图6),在66.4~97.2 ku间出现特异性条带,与预测蛋白的相对分子量77.21 ku基本一致,表明芥蓝BaDXS1蛋白在大肠埃希菌体内成功表达。进一步分离上清和沉淀中的蛋白,检测结果显示,大部分目的蛋白存在于沉淀中,表明该蛋白在大肠埃希菌体内主要以包涵体的形式存在。
3 讨论
在植物中,DXS作为MEP途径的首要限速酶,最早是在胡椒薄荷[16]和拟南芥[17]中分离获得的。本研究首次分离了芥蓝DXS1基因,该基因CDS区全长为2 139 bp,可编码712个氨基酸。对BaDXS1蛋白进行亚细胞定位预测和分析,显示该蛋白很可能位于叶绿体。根据BaDXS1蛋白氨基酸序列与其他6个不同物种的DXS氨基酸序列比对发现,该序列N端相较于C端的保守性较差。BaDXS1蛋白的N端序列中富含丝氨酸和苏氨酸,而含少量的酸性氨基酸,这与叶绿体转运肽的性质相符,该结果与BaDXS1蛋白的亚细胞定位预测结果相一致。推测该蛋白是在叶绿体转运肽的引导下,定位于叶绿体,而该蛋白的C端序列因含多种结构域而高度保守,其可能在叶绿体内催化丙酮酸和3-磷酸甘油醛合成1-脱氧-D-木酮糖-5-磷酸这个过程中起作用[11]。

图5 17种不同物种的系统进化树分析Fig.5 Phylogenetic tree analysis of 17 different species
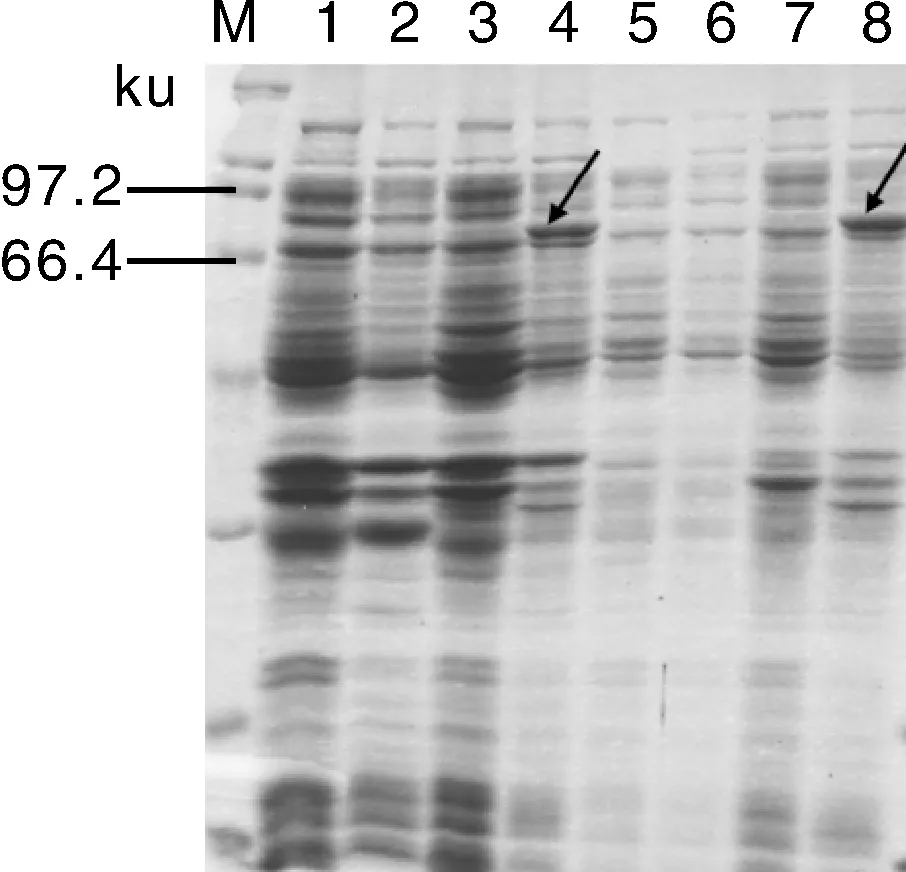
M,Protein marker(6.5~200 ku); 1~4,总蛋白检测; 5~6,上清中蛋白检测; 7~8,沉淀中蛋白检测。1,未诱导空载; 2,诱导空载; 3,未诱导BL21(DE3)(pEASY-Blunt E1-BaDXS1); 4,诱导8 h的BL21(DE3)(pEASY-Blunt E1-BaDXS1); 5、7,未诱导BL21(DE3)(pEASY-Blunt E1-BaDXS1); 6、8,诱导8 h的BL21(DE3)(pEASY-Blunt E1-BaDXS1)。M,Protein marker(6.5~200 ku); 1-4,Detection of total protein; 5-6,Detection of protein in the supernatant; 7-8,detection of protein precipitation; 1,non-induced control; 2,Induced control; 3,Non-induced expression products of pEASY-Blunt E1-BaDXS1 in BL21(DE3); 4,pEASY-Blunt E1-BaDXS1 transformed bacterial cells induced respectively for 8 h in BL21(DE3); 5,7,non-induced expression products of pEASY-Blunt E1-BaDXS1 in BL21(DE3); 6,8,pEASY-Blunt E1-BaDXS1 transformed bacterial cells induced respectively for 8 h in BL21(DE3).图6 重组质粒pEASY-Blunt E1-BaDXS1在大肠埃希菌中的表达检测Fig.6 Expression of pEASY-Blunt E1-BaDXS1 in Escherichia coli
本研究中,BaDXS1蛋白在大肠埃希菌中成功表达,但其表达量较低。外源基因结构(如密码子偏好性)和表达条件均会影响外源基因在大肠埃希菌体内的表达[18]。本实验中,我们对BaDXS1基因进行稀有密码子分析,发现该基因具有多个稀有密码子,其中含1个六联体和多个二联体,当外源基因中含有成串或多个大肠埃希菌稀有密码子时,则会导致翻译很难进行,目的蛋白表达量过低[19]。我们在实验过程中采用的是不含稀有密码子的大肠埃希菌表达感受态BL21(DE3),这可能是导致该蛋白表达量较低的原因之一;另一方面,依据刘永强等[20]研究发现,诱导温度及诱导时间对重组蛋白在大肠埃希菌中的表达量产生显著影响,而诱导前菌液浓度和IPTG浓度对蛋白的表达量影响不显著。本实验中采用的诱导温度为37 ℃、诱导时间为8 h,可能是由于诱导温度较高、诱导时间较短,进而影响重组蛋白在菌体内的表达量较低。我们将在后续实验中采用含有稀有密码子的大肠埃希菌表达感受态细胞、降低诱导温度及延长诱导时间等手段,进一步优化原核表达体系,使BaDXS1蛋白获得高效表达。
不同植物中,DXS基因家族成员的数目及功能也各自不同,如番茄只有1个DXS基因[5],拟南芥中有3个DXS基因,但只有1个DXS蛋白具有催化功能[21],柑橘中有3个DXS基因,其中CitDXS1起主要作用[22]。目前,芥蓝中还未发现有关BaDXS基因家族成员的数目及相应功能的报道。本研究为进一步研究BaDXS1基因功能奠定了基础,同时也有助于芥蓝DXS基因家族其他成员的分离及功能研究。
参考文献(References):
[1] 孙勃,方莉,刘娜,等. 芥蓝不同器官主要营养成分分析[J]. 园艺学报,2011,38(3): 541-548.
SUN B,FANG L,LIU N,et al. Studies on main nutritional components of Chinese kale among different organs[J].ActaHorticulturaeSinica,2011,38(3): 541-548. (in Chinese with English abstract)
[2] 孙勃,张芬,夏雪,等. 芥蓝八氢番茄红素脱氢酶基因BaPDS1和BaPDS2的克隆与表达分析[J]. 园艺学报,2016,43(11): 2257-2265.
SUN B,ZHANG F,XIA X,et al. Cloning and expression analysis ofBaPDS1 andBaPDS2 inBrassicaalboglabra[J].ActaHorticulturaeSinica,2016,43(11): 2257-2265. (in Chinese with English abstract)
[3] SMOLIKOVA G N,MEDVEDEV S S. Seed carotenoids: synthesis,diversity and functions[J].RussianJournalofPlantPhysiology,2015,62(1): 1-13.
[6] ESTÉVEZ J M,CANTERO A,REINDL A,et al. 1-deoxy-D-xylulose-5-phosphate synthase,a limiting enzyme for plastidic isoprenoid biosynthesis in plants[J].JournalofBiologicalChemistry,2001,276: 22901-22909.
[7] 潘夕春,陈敏,刘颜,等. 番茄dxs基因的克隆及在大肠杆菌中的颜色互补[J]. 园艺学报,2007,34(2): 371-376.
PAN X C,CHEN M,LIU Y,et al. Cloning of deoxyoxylulose-5-phosphate synthase gene from tomato and its color complementation inE.coli[J].ActaHorticulturaeSinica,2007,34(2): 371-376. (in Chinese with English abstract)
[8] CORDOBA E,PORTA H,ARROYO A,et al. Functional characterization of the three genes encoding 1-deoxy-D-xylulose 5-phosphate synthase in maize[J].JournalofExperimentalBotany,2011,62(6): 2023-2038.
[9] 魏麟,伍贤进,李胜华,等. 鱼腥草1-脱氧-D-木酮糖-5-磷酸合成酶1基因克隆与表达分析[J]. 中草药,2014,45(11): 1607-1612.
WEI L,WU X J,LI S H,et al. Cloning and expression analysis of 1-deoxy-D-xylulose-5-phosphate synthase 1 gene inHouttuyniacordata[J].ChineseTraditionalandHerbalDrugs,2014,45(11): 1607-1612. (in Chinese with English abstract)
[10] 孙君,陈桂信,叶乃兴,等. 茉莉花香气相关基因JsDXS基因及其启动子的克隆与表达分析[J]. 园艺学报,2014,41(6): 1236-1244.
SUN J,CHEN G X,YE N X,et al. Cloning and expression analysis of deoxyoxylulose-5-phosphate synthase gene related to aroma fromJasminumsambacand isolation of its promoter[J].ActaHorticulturaeSinica,2014,41(6): 1236-1244. (in Chinese with English abstract)
[11] 王毅,周旭,毕玮,等. 思茅松1-脱氧-D-木酮糖-5-磷酸合酶(DXS)基因的克隆及功能分析[J]. 林业科学研究,2015,28(6): 833-838.
WANG Y,ZHOU X,BI W,et al. Identification and characterization of a 1-deoxy-D-xylulose-5-phosphate synthase gene fromPinuskesiyavar.langbianensis[J].ForestResearch,2015,28(6): 833-838. (in Chinese with English abstract)
[12] HENRIQUEZ M A,SOLIMAN A,LI G,et al. Molecular cloning,functional characterization and expression of potato (Solanumtuberosum) 1-deoxy-d-xylulose 5-phosphate synthase 1 (StDXS1) in response toPhytophthorainfestans[J].PlantScience,2016,243: 71-83.
[13] CHEN Q,YU H W,WANG X R,et al. An alternative cetyltrimethylammonium bromide-based protocol for RNA isolation from blackberry (RubusL.)[J].GeneticsandMolecularResearch,2011,11(2): 1773-1782.
[14] 黄路平,刘仑,鲁黎明,等. 烟草NtKAT3基因克隆、序列和表达分析[J]. 浙江农业学报,2017,29(7): 1057-1063.
HUANG L P,LIU L,LU L M,et al. Cloning,sequence and expression analysis of a potassium channelNtKAT3 in tobacco[J].ActaAgriculturaeZhejiangensis,2017,29(7): 1057-1063. (in Chinese with English abstract)
[15] 任学良,李立芹,许力,等. 烟草糖基转移酶基因NtGT3的克隆与生物信息学分析[J]. 浙江农业学报,2017,29(1): 23-30.
REN X L,LI L Q,XU L,et al. Cloning and bioinformatic analysis of glucosetransferase geneNtGT3 inNicotianatabacum[J].ActaAgriculturaeZhejiangensis,2017,29(1): 23-30. (in Chinese with English abstract)
[16] LANGE B M,WILDUNG M R,MCCASKILL D,et al. A family of transketolases that directs isoprenoid biosynthesis via a mevalonate-independent pathway[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,1998,95 (5): 2100-2104.
[17] LOIS L M,CAMPOS N,PUTRA S R,et al. Cloning and characterization of a gene fromEscherichiacoliencoding a transketolase-like enzyme that catalyzes the synthesis of D-1-deoxyxylulose 5-phosphate,a common precursor for isoprenoid,thiamin,and pyridoxol biosynthesis[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,1998,95(5): 2105-2110.
[18] 尹春光,杜立新,赵桂平,等.Mx基因稀有密码子和mRNA结构及大肠杆菌表达优化[J]. 遗传,2009,31(1): 75-82.
YIN C G,DU L X,ZHAO G P,et al. Optimizing the expression ofMxgene inEscherichiacoilbased on rare codon and mRNA structure[J].Hereditas,2009,31(1): 75-82. (in Chinese with English abstract)
[19] 薛生玲,张芬,江敏,等. 芥蓝八氢番茄红素合成酶基因BaPSY1的克隆及原核表达[J]. 基因组学与应用生物学,2017,36(2): 734-739.
XUE S L,ZHANG F,JIANG M,et al. Cloning and prokaryotic expression of phytoene synthase gene inBrassicaalboglabra[J].GenomicsandAppliedBiology,2017,36(2): 734-739. (in Chinese with English abstract)
[20] 刘永强,王熙然,叶云天,等. 草莓FaUVR8基因的cDNA克隆、生物信息学分析及原核表达条件优化[J]. 分子植物育种,2016,14(11): 2964-2975.
LIU Y Q,WANG X R,YE Y T,et al. Cloning,bioinformatic analysis of strawberryFaUVR8 gene and optimization of its prokaryotic expression conditions[J].MolecularPlantBreeding,2016,14(11): 2964-2975. (in Chinese with English abstract)
[22] PENG G,WANG C,SONG S,et al. The role of 1-deoxy-d-xylulose-5-phosphate synthase and phytoene synthase gene family in citrus carotenoid accumulation[J].PlantPhysiology&Biochemistry,2013,71(2): 67-76.

