西瓜复合根际促生菌剂构建与促生效应研究
徐伟慧,吕智航,史一然,姜佳莹,胡云龙,王志刚,*
(1.齐齐哈尔大学 生命科学与农林学院,黑龙江 齐齐哈尔 161006; 2.抗性基因工程与寒地生物多样性保护黑龙江省重点实验室,黑龙江 齐齐哈尔 161006)
西瓜[Citrulluslanatus(Thunb.)Matsum & Nakai]是我国设施园艺主要栽培作物之一,随着化肥使用率不断增高,造成土壤理化性质下降、土壤微生态系统失衡、根系发育不良、生长势下降等一系列问题。所以,调节土壤生态系统中有益微生物的种群和数量[1-2],帮助植物建立良好的根际生长条件[3-5],是提高西瓜产量和品质的有效手段之一。
植物根际促生菌(plant growth-promoting rhizobacteria,PGPR)具有固氮、溶磷、解磷、解钾、分泌植物激素、产生铁载体,改善土壤环境,调节植物生长,提高植物抗逆能力等多种促生效应[6]。解磷菌是将土壤中有机磷转化为植物能够吸收利用的可溶性磷的特殊微生物功能类群,也称为有机磷细菌[7],在转化土壤有机磷和提高磷肥利用率及植物生长等方面有显著作用[4]。溶磷菌是将土壤中难溶性无机磷酸盐转化为植物可吸收利用的形态,也称为无机磷细菌[8-9]。PGPR中产激素菌可以分泌调节植物生长的信号物质,如吲哚乙酸和赤霉素。吲哚乙酸具有促进细胞分裂和分化,调节生根等功能[10]。赤霉素和生长素在调节细胞扩大和组织分化方面有相互叠加的作用[11]。一些促生菌分泌铁载体可抑制某些植物病原菌,同时作为根际铁的提供者促进植物的生长发育[12]。
PGPR作为植物促进方面的接种剂,在农业生产中起着重要的作用[13]。Serratiaproteamaculans会增加鹰嘴豆(Cicerarietinum)根长、侧根数量和长度及根质量[14];接种Azospirillumbrasilense会增加菜豆根长、根鲜质量、降低根系直径,增加细根在总根长中的比例[15];王志刚等[5,16-17]研究发现,单独接种Sphingomonassp. CL01、PantoeaananatisHYL01和Plantibactersp.WZW03会增加西瓜根长、根干质量、根体积、根尖数,显著增加根系直径0~0.5 mm根长所占总根长的比例,对西瓜根系具有明显的促生效应。
PGPR是促生微生物肥料的主要菌种类群。近年来,因微生物肥料的开发对菌种的需求,使植物根际促生菌的筛选成为研究热点。利用不同功能菌株组合、功能互补并筛出复合菌剂,是微生物菌剂研究应用向多菌复合发展的趋势[18]。本研究基于本实验室筛选的解磷菌、溶磷菌、固氮菌和解钾菌,研究菌株分泌IAA、赤霉素和铁载体的能力及菌株间的拮抗作用,筛出复合菌剂;通过盆栽试验研究多功能复合菌对西瓜幼苗根系生长的促生效应,为开发复合菌剂、提高西瓜产量提供理论基础与技术支持。
1 材料与方法
1.1 供试材料
供试土壤采自齐齐哈尔市嫩江边黑土,土壤基本性状为,有机质18.26 g·kg-1,碱解氮30.59 mg·kg-1,有效磷28.26 mg·kg-1,速效钾83.12 mg·kg-1,土壤pH 6.02,EC 0.59 ms·cm-1。供试西瓜品种为京欣1号,购买于北京金种子公司。供试菌株由齐齐哈尔大学生命科学与农林学院微生物生态实验室从西瓜根际筛选获得,菌株类型及编号见表1。
1.2 试验设计
1.2.1 菌株分泌激素及铁载体的测定
制备菌株种子液,测定不同解磷菌、溶磷菌、固氮菌和解钾菌分泌IAA、赤霉素和铁载体的能力。
菌株分泌IAA测定。IAA测定参考张东艳等[6]的方法。将200 μg·mL-1的IAA标准液按浓度梯度0、25、50、75、100、125、150、175 μg·mL-1进行稀释,采用Salkowski显色法测定吸光值(D530),绘制标准曲线。将菌株接于LB液体培养基中,置于摇床培养(30 ℃,120 r·min-1)24 h制作种子液,按1%的接种量将种子液接入含有200 mg·L-1色氨酸的液体LB培养基中,置于摇床培养(30 ℃,120 r·min-1),每24 h采用Salkowski显色法定量测定IAA,连续测量5次。
铁载体测定。铁载体测定参考胡碧惠等[19]的方法。将待测菌株接种于MKB液体培养基中,30 ℃摇床(120 r·min-1)培养48 h,离心菌悬液取上清,将3 mL上清液与3 mL CAS 检测液充分混匀,反应1 h,于630 nm处测定吸光值 (As)。另取3 mL不接菌MKB液体培养基与3 mL CAS检测液充分混合,于630 nm处测定吸光值(Ar)。铁载体含量测定根据文献[20]进行计算。
菌株分泌赤霉素的测定。赤霉素的测定参考肖志壮等[21]的方法。将分析纯赤霉素溶于体积分数为70%的乙醇中配置成100 μg·mL-1的赤霉素标准液,按浓度梯度0、10、30、40、50、60 μg·mL-1进行稀释,取各浓度的赤霉素溶液0.5 mL与4.5 mL 浓硫酸充分混匀,置于冰浴中10 min,再置28 ℃水浴中1 h,取出置室温下放置15 min,测定412 nm处吸光值,绘制标准曲线。将菌株接种于LB培养基中,置于摇床(30 ℃,120 r·min-1)上振荡培养24 h制备种子液,按1%的接种量将种子液转接LB培养基中,摇床振荡(30 ℃,120 r·min-1)培养,每24 h离心(10 000 r·min-1,10 min)取上清测定菌株赤霉素浓度,连续测5次,确定各菌株最大赤霉素分泌量。
1.2.2 菌株间的拮抗试验
选择解磷菌、溶磷菌、固氮菌和解钾菌中的一种分别与其他菌株在同一固体培养基中进行点培养,每个处理设置3个重复,经过一段时间培养,观察两菌落之间是否存在抑菌带及抑菌带的宽度和菌种的拮抗方向等,存在明显拮抗带的为拮抗阳性,相反的就是拮抗阴性[22]。选择相互协同或无拮抗作用的菌株进行4菌组合,最终作为供试的复合菌剂。每一组合的菌液按照1∶1∶1∶1(体积比)的比例混合,复合菌悬液的浓度为D600=0.5。
1.2.3 复合菌剂对西瓜促生试验
西瓜种子用0.1%升汞消毒8 min,无菌水浸泡8 h,30 ℃无菌催芽,待西瓜胚根长至0.5 cm左右时分别将西瓜种子播种到灭菌土和非灭菌土的育苗盘中。待西瓜两片子叶展平,选取长势一致的幼苗分别移至装有灭菌土和非灭菌土的营养钵中(10 cm×10 cm,装有223 g土),同时,分别浇灌3种复合菌剂(R1、R2、R3)10 mL,非灭菌土壤以浇灌清水(CK1)为对照,灭菌土壤以浇灌无菌水(CK2)为对照,幼苗置于人工气候箱中培养(28 ℃/光照12 h,18 ℃/黑暗12 h,湿度为60%),试验期间采用称量法分别浇灌清水(非灭菌土壤)和无菌水(灭菌土壤),每个处理重复20盆。不同处理对应编号如表2所示。
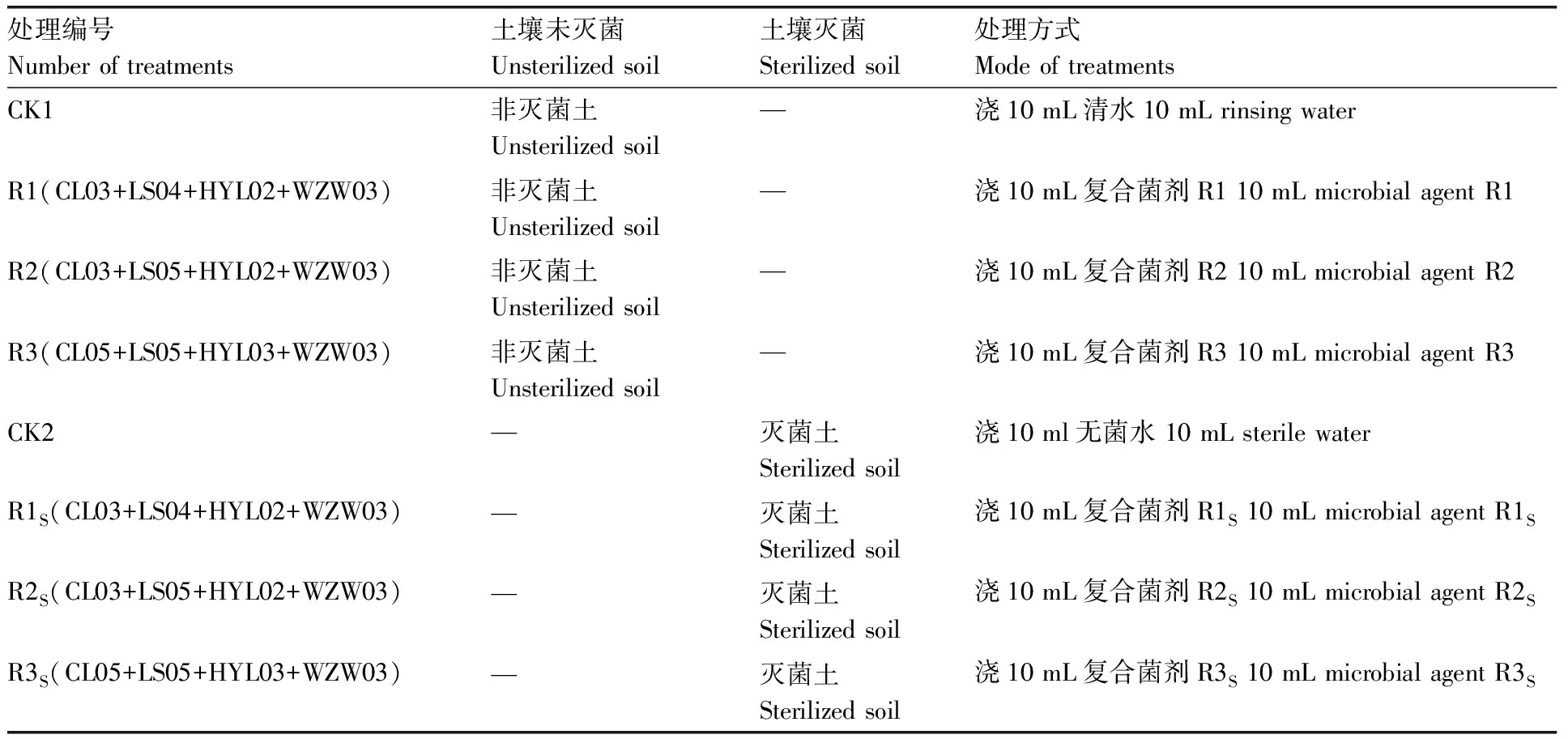
表2 不同处理对应编号Table 2 Number of different treatments
表中“—”指未进行处理。
“—” represents no treatment.
处理30 d后收集西瓜根系采用称量法测量地下部干质量,用根系分析仪(ScanMaker i800 plus)扫描并获得根系图像,根系分析软件(Scan Wizard EZ)分析根系长度、根体积、根表面积、根系平均直径、根尖数等[23]。
1.3 数据处理
采用Excel、Origin 9和SPSS软件系统进行数据处理及统计分析。
2 结果与分析
2.1 菌株分泌IAA、赤霉素和铁载体的能力
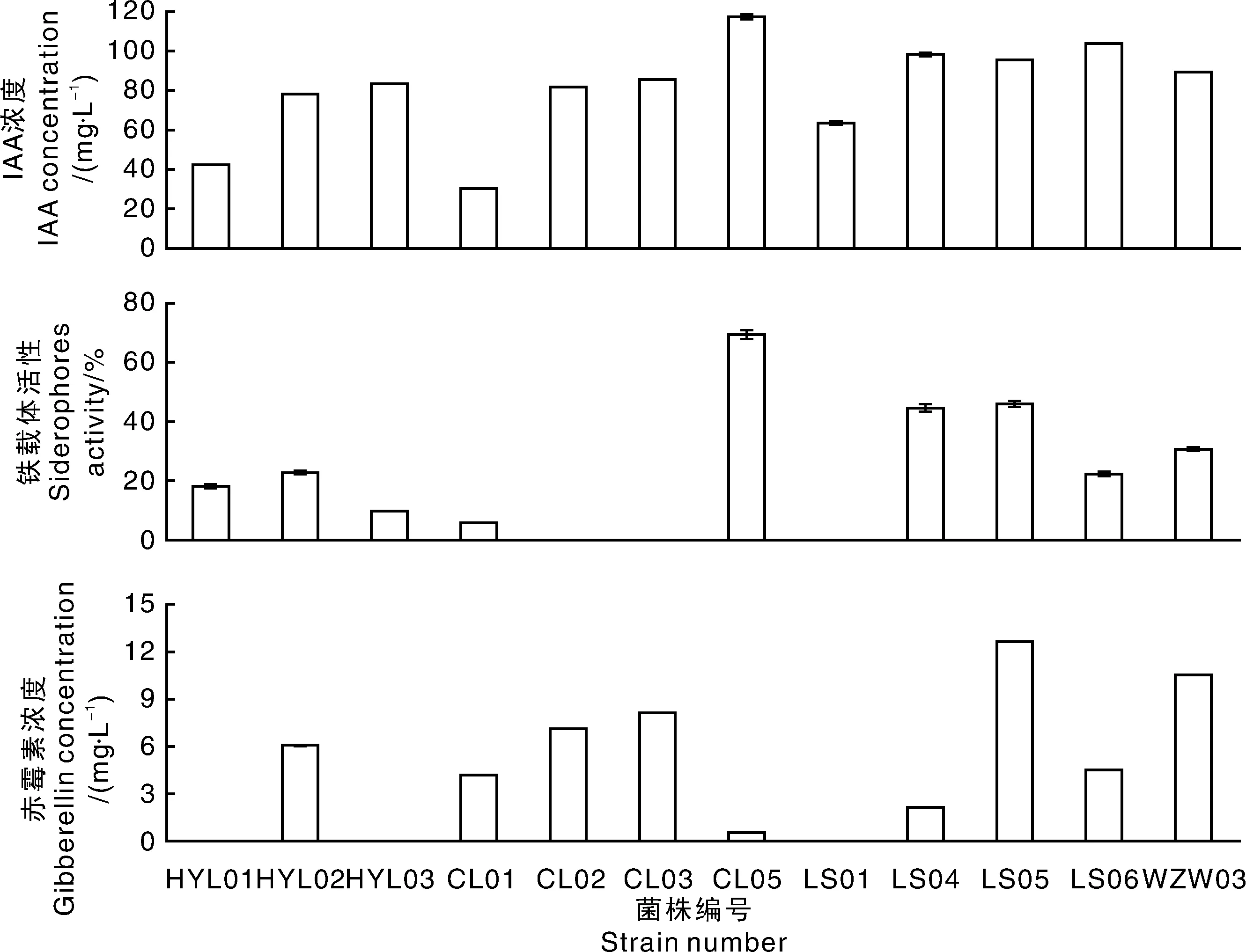
图1 供试菌株分泌IAA、赤霉素和铁载体的能力Fig.1 Ability of experimental strains to secrete IAA and gibberellin and product siderophores
定量测定结果显示(图1),菌株StreptomycesCL05分泌IAA量最多,达到117.30 mg·L-1,而菌株LS06、LS04、LS05、WZW03 分泌IAA的量相对较高,分别为103.60、98.10、95.40、89.41 mg·L-1。其余菌株分泌IAA量均分布在30~85 mg·L-1。此外,分泌铁载体活性最高的菌株是StreptomycesCL05,其活性为69.43%;其他菌株产铁载体活性由高到低依次为LS05(45.85%)、LS04(44.54%)、WZW03(30.68%)、HYL02(22.71%)、LS06(22.27%)、HYL01(18.27%)、HYL03(9.71%)、CL01(5.67%),而菌株CL02、CL03、LS01不具有产铁载体的能力。菌株MicromonosporaLS05分泌赤霉素的量最高,其分泌量是12.66 mg·L-1,其次是解钾菌WZW03,分泌赤霉素的量为10.59 mg·L-1,而菌株HYL01、HYL03和LS01均不分泌赤霉素,其余菌株分泌量在0.50~8.17 mg·L-1。
2.2 菌株间的拮抗效果
利用平板对峙法研究了3株溶磷菌、4株解磷菌、4株固氮菌和1株解钾菌间的拮抗作用,表3所示,菌株CL02和CL01与3株溶磷菌均没有拮抗作用,菌株CL03与菌株HYL02没有拮抗作用,菌株CL05与菌株HYL02和HYL03没有拮抗作用;菌株HYL01对菌株CL03和CL05均有拮抗;菌株LS01对3株溶磷菌均有拮抗,菌株LS04对菌株HYL03有拮抗作用。4株解磷菌与4株固氮菌间无拮抗作用。菌株CL02和LS01对解钾菌株WZW03有拮抗作用;其他供试菌株对解钾菌株WZW03无拮抗作用。根据以上分析结果,对菌种间无拮抗作用的菌株进行组合,最终选择出无拮抗作用的3种复合菌剂,分别是:复合菌剂R1,CL03+LS04+HYL02+WZW03;复合菌剂R2,CL03+LS05+HYL02+WZW03;复合菌剂R3,CL05+LS05+HYL03+WZW03。
2.3 三组复合菌剂对西瓜根系生长的影响
复合菌剂处理30 d后,用水浸泡营养钵中的土壤,轻轻取出西瓜根系,清水缓缓冲洗掉根系上的土壤,用根系分析仪扫描西瓜幼苗根系并进行拍照,见图2。由表4可知,在非灭菌土壤中,复合菌剂R2显著提高了西瓜根长、根表面积、根体积、根尖数和根干质量(P<0.05)。与对照相比,复合菌剂R2对西瓜幼苗根长、根表面积、根体积、根尖数和根干质量分别提高了79.0%、46.8%、57.1%、162.7%、49.1%。复合菌剂R1和R3处理的西瓜幼苗根长、根表面积、根体积、根干质量与对照相比无显著差异,显著提高了根尖数(P<0.05)。
在灭菌土壤中,3组复合菌剂处理西瓜幼苗根系形态图,见图3。由表5可知,在灭菌土壤中,复合菌剂R2S显著提高了西瓜幼苗根长、根表面积、根体积、根尖数和根干质量,显著降低了根系平均直径(P<0.05)。与对照相比,复合菌剂R2S对西瓜幼苗根长、根表面积、根体积、根尖数和根干质量分别提高了191.8%、302.4%、160.0%、206.5%、139.6%,根系平均直径比对照降低了17.5%。复合菌剂R1S和R3S处理显著提高了西瓜幼苗根长、根尖数和根干质量,而根表面积、根体积、根系平均直径与对照相比无显著差异(P<0.05)。
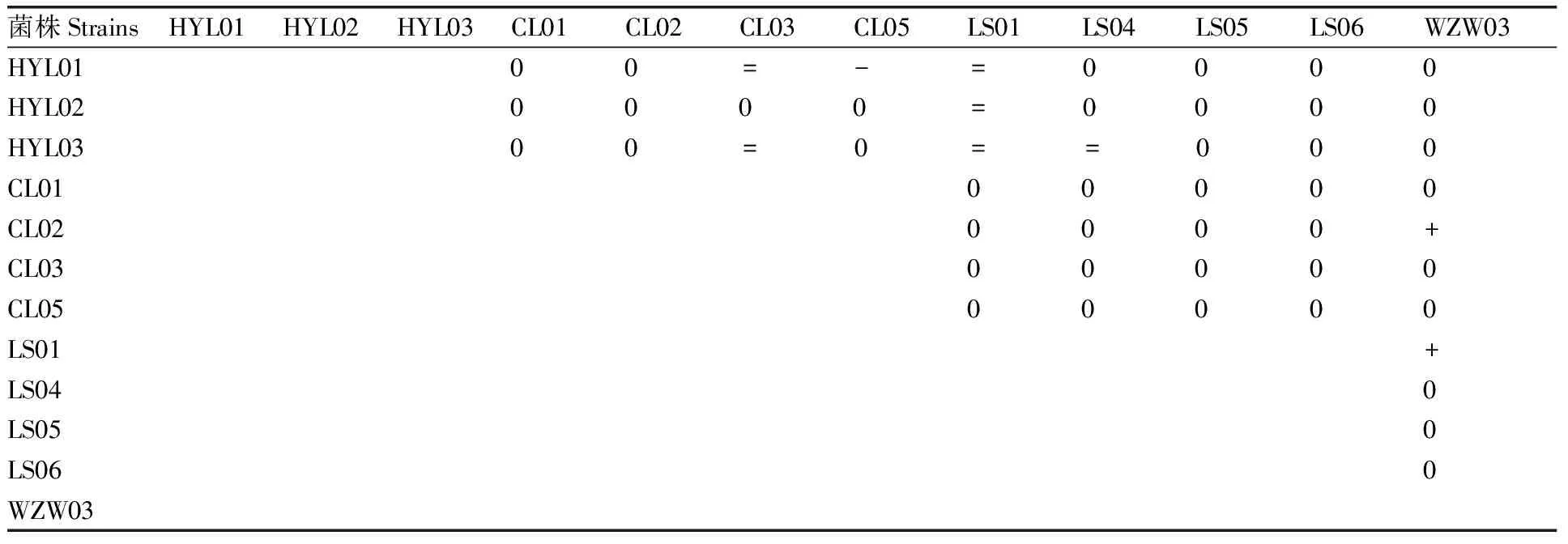
表3 供试菌株间的拮抗作用Table 3 Antagonistic effect among experimental strains
表中“+”表示竖排菌种对横排菌种拮抗;“-”表示横排菌种对竖排菌种拮抗;“=”表示互相拮抗;“0”表示无拮抗。下同。
“+” represents the antagonism of the strain in the vertical line to the strain in the horizontal lines; “-” represents the antagonism of the strain in the horizontal line to the strain in the vertical lines; “=” represents the antagonism between the strains in the horizontal and vertical lines; “0” represents no antagonism. The same as below.
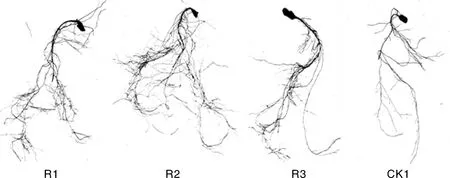
图2 未灭菌土壤中复合菌剂处理的西瓜幼苗根系形态Fig.2 Roots morphology of watermelon seedlings in unsterilized soil after complex bacteria treatment
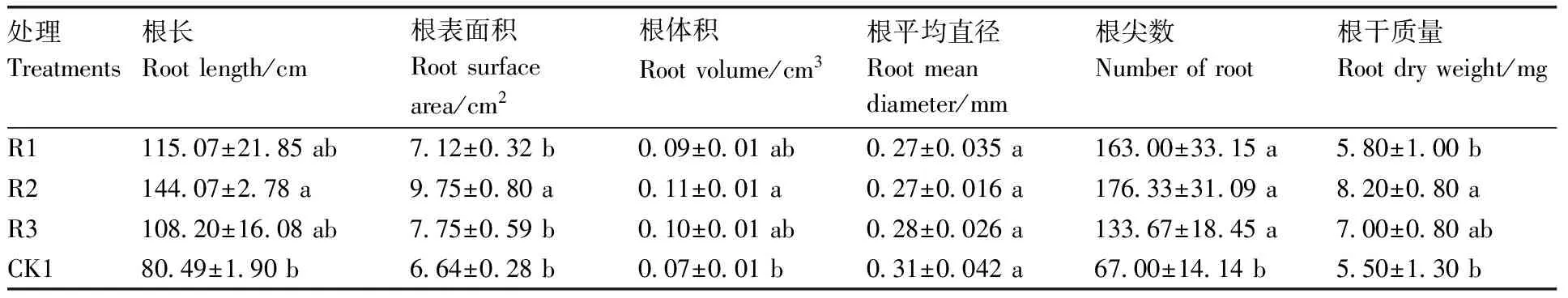
表4 未灭菌土壤中复合菌剂对西瓜幼苗根系的影响Table 4 Effects of complex bacteria on growth of watermelon roots in unsterilized soil
表中同列不同行数据后没有相同小写字母表示不同处理间差异显著(P<0.05),下同。
The values without the same lowercase letters in the same column showed the significant difference atP<0.05. The same as below.
图3 灭菌土壤中复合菌剂处理的西瓜幼苗根系形态Fig.3 Roots morphology of watermelon seedlings in sterilized soil after complex bacteria treated
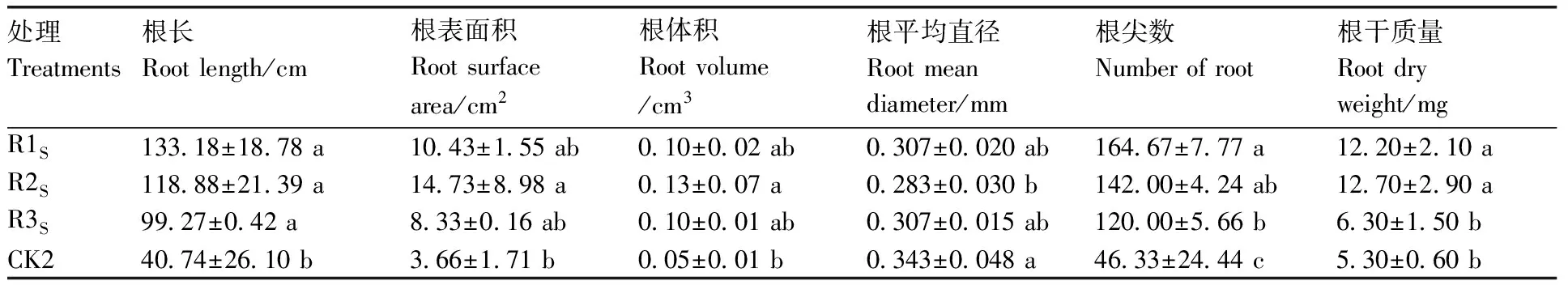
表5 灭菌土壤中复合菌剂对西瓜幼苗根系的影响Table 5 Effects of complex bacteria on growth of watermelon roots in sterilized soil
3 讨论
复合菌剂的使用能有效改善土壤微生物区系,有效提高土壤酶活力,抑制病害发生,减缓连作障碍[24]。构建复合菌剂是根据菌株间的拮抗性或者促抑关系,将功能菌株进行优化组合[25-26]。本研究利用实验室筛选的不同溶磷菌、解磷菌、固氮菌及解钾菌菌株进行拮抗试验,并最终获得无拮抗作用的复合菌剂R1、R2和R3。R2和R2S处理能有效提高西瓜幼苗根长、根表面积、根体积、根尖数和根干质量,R2S处理能有效降低西瓜根系直径,说明该复合菌剂能促进毛细根的生成,优化西瓜根系。李勤奋等[26]施用复合菌剂C1和C2能明显促进番茄的生长,其他几个研究也证实了PGPR菌株混合物由于协同作用具有更好的促生和生防效果[27-28]。本实验中R2S处理对西瓜根系的促生效果优于R2,可能原因是在非灭菌土壤中复合菌剂R2与土壤中某些或某个菌种存在养分竞争或拮抗作用,导致R2复合菌群的繁殖受到影响,这个现象可归功于土壤中总微生物的活性[29]。
PGPR除了促进植物对养分的吸收外[5,16-17],还可通过产生植物激素、嗜铁素等物质促进植物生长[30]。大部分PGPR可以产生IAA,促进植物根系的生长发育[31],增加次生根和根毛的数量[32]。构建复合菌剂R1、R2和R3的菌株都具有较高分泌IAA的能力,显然这不是复合菌剂R2优于R1和R3的主要原因。赤霉素和生长素在调节细胞扩大和组织分化方面有相互叠加的作用[11]。构成复合菌剂R2的4种菌株CL03、LS05、HYL02、WZW03产赤霉素和IAA的能力都较强,复合菌剂R2与R1比较,两种复合菌剂有共同的菌株(CL03、HYL02、WZW03),差异菌株是LS05(R2)和LS04(R1),LS05菌株分泌赤霉素的浓度是12.65 mg·L-1,LS04菌株分泌赤霉素的浓度是2.13 mg·L-1,同样,R2与R3比较,差异菌株CL03和HYL02(R2中含有)分泌赤霉素的浓度分别是8.17 mg·L-1和6.10 mg·L-1,而菌株CL05和HYL03(R1中含有)分泌赤霉素的浓度分别是0.59 mg·L-1和0 mg·L-1,因此,复合菌剂R2的4株菌分泌赤霉素的能力远远超过R1和R3的菌株,这可能是复合菌剂R2对西瓜根系促生效果优于R1和R3的主要原因。铁元素是生物体必需元素之一,土壤中能够被生物利用的铁元素很少,PGPR产嗜铁素与铁结合,从而被植物吸收利用,促进生长[33-34]。复合菌剂R2与R1比较,除了共有的菌株外,差异菌株产铁载体的量大致相同,菌株LS05产铁载体为45.85%,菌株LS04产铁载体量为44.54%,二者无显著差异,R2与R3比较,R3的4种菌株产铁载体总量远高于R2的4种菌株,说明优势复合菌剂与复合菌剂中菌株产铁载体的总量无相关性。复合菌剂R2成为优势菌剂有可能还存在其他原因,仍需进一步研究证明。从本实验供试菌株分泌IAA、GA和产铁载体的能力看,分泌IAA和GA的能力高产铁载体的能力不一定高,如菌株CL03具有较高分泌IAA和GA的能力,但不具有产铁载体的能力;具有产铁载体和分泌IAA的能力,分泌赤霉素的能力不一定高,如菌株HYL03,说明菌株分泌IAA、GA和产铁载体无相关性。
本研究结果证实,复合菌剂R2对西瓜根系具有促生效应,其在复杂的大田环境下的应用效果还有待进一步研究。同时,进一步研究复合菌剂最优载体的筛选,可为多功能复合菌肥的开发利用提供理论参考。
参考文献(References):
[1] LING N,ZHANG W W,TAN S Y,et al.Effect of the nursery application of bioorganic fertilizer on spatial distribution ofFusariumoxysporumf. sp.niveumand its antagonistic bacterium in the rhizosphere of watermelon[J].AppliedSoilEcology,2012,59(4): 13-19.
[2] LEE S W,LEE S H,BALARAJU K,et al. Growth promotion and induced disease suppression of four vegetable crops by a selected plant growth-promoting rhizobacteria (PGPR) strainBacillussubtilis21-1 under two different soil conditions[J].ActaPhysiologiaePlantarum,2014,36(6): 1353-1362.
[3] HAYAT R,AHMED I,SHEIRDIL R A. An overview of plant growth promoting rhizobacteria (PGPR) for sustainable agriculture[C]//MUHAMMAD A,MÜNIR Ö,MUHAMMAD S. Crop production for agricultural improvement. Netherlands: Springer,2012: 557-579.
[4] MEHTA P,WALIA A,CHAUHAN A,et al. Plant growth promoting traits of phosphate-solubilizing rhizobacteria isolated from apple trees in trans Himalayan region of Himachal Pradesh[J].ArchivesofMicrobiology,2013,195(5): 357-369.
[5] 王志刚,胡云龙,徐伟慧,等. 鞘氨醇单胞菌菌株CL01的分离鉴定及其对连作西瓜的促生效应[J]. 农业生物技术学报,2015,23(10):1360-1367.
WANG Z G,HU Y L,XU W H,et al. Isolation and identification ofSphingomonassp. CL01 and its promoting effects on watermelon (Citrulluslanatus) in continuous cropping soil[J].JournalofAgriculturalBiotechnology,2015,23(10): 1360-1367.(in Chinese with English abstract)
[6] 张东艳,刘烨,吴越,等. 花生根际产IAA菌的筛选鉴定及其效应研究[J]. 中国油料作物学报,2016,38(1): 104-110.
ZHANG D Y,LIU Y,WU Y,et al. Isolation and identification of IAA-producing strains from peanut rhizosphere and its promoting effects on peanut growth[J].ChineseJournalofOilCropSciences,2016,38(1): 104-110.(in Chinese with English abstract)
[7] 吴鹏飞,张冬梅,郝丽红,等. 解磷微生物研究现状与展望[J]. 中国农业科技导报,2008,10(3): 40-46.
WU P F,ZHANG D M,HAO L H,et al. Status quo and prospects of phosphate-soluble microorganisms[J].JournalofAgriculturalScienceandTechnology,2008,10(3): 40-46.(in Chinese with English abstract)
[8] 赵小蓉,林启美,李保国. 溶磷菌对4种难溶性磷酸盐溶解能力的初步研究[J]. 微生物学报,2002,42(2):236-241.
ZHAO X R,LIN Q M,LI B G. The solubilization of four insoluble phosphates by some microorganisms[J].ActaMicrobiologicaSinica,2002,42(2):236-241.(in Chinese with English abstract)
[9] 臧威,孙剑秋,王鹏,等. 东北地区四种农作物根际磷细菌的分布[J]. 中国生态农业学报,2009,17(6): 1206-1210
ZANG W,SUN J Q,WANG P,et al. Distribution of phosphobacteria in rhizosphere soils of four crops in Northeast China[J].ChineseJournalofEco-Agriculture,2009,17(6): 1206-1210. (in Chinese with English abstract)
[10] 王忠. 植物生理学[M]. 北京: 中国农业出版社,2000: 271-275.
[11] FRIGERIO M,ALABADI D,PEREZ-GOMEZ J,et al. Transcriptional regulation of gibberellin metabolism genes by auxin signaling in Arabidopsis[J].PlantPhysiology,2006,142(2): 553-563.
[12] 赵翔,陈绍兴,谢志,等. 高产铁载体荧光假单胞菌Pseudomonasfluorescenssp-f 的筛选鉴定及其铁载体特性研究[J]. 微生物学报,2006,46(5): 691-695.
ZHAO X,CHEN S X,XIE Z,et al. Isolation,identification and over-siderophores production ofPseudomonasfluorescenssp-f[J].ActaMicrobiologicaSinica,2006,46(5): 691-695.(in Chinese with English abstract)
[13] LUGTENBERG B J J,CHIN-A-WOENG T F C,BLOEMBERG G V. Microbe-plant interactions: principles and mechanisms[J].AntonieVanLeeuwenhoek,2002,81(1/2/3/4): 373-383.
[14] SHAHZAD S M,KHALID A,ARSHAD M,et al.Improving nodulation,growth and yield ofCicerarietinumL. through bacterial ACC deaminase induced changes in root architecture[J].EuropeanJournalofSoilBiology,2010,46(5): 342-347.
[15] GERMAN M A,BURDMAN S,OKON Y,et al. Effects ofAzospirillumbrasilenseon root morphology of common bean (PhaseolusvulgarisL.) under different water regimes[J].BiologyandFertilityofSoils,2000,32(3): 259-264.
[16] 王志刚,胡云龙,徐伟慧,等. 一株溶磷菌的分离鉴定及对西瓜根系的促生效应[J]. 浙江农业学报,2015,27(5): 798-803.
WANG Z G,HU Y L,XU W H,et al. Separation and identification of a phosphorus solubilizing bacteria and its promoting effect on watermelon root[J].ActaAgriculturaeZhejiangensis,2015,27(5): 798-803.(in Chinese with English abstract)
[17] 王志刚,刘帅,徐伟慧,等. 硅酸盐细菌的分离鉴定及其对西瓜的促生效应[J]. 核农学报,2015,29(11): 2208-2214.
WANG Z G,LIU S,XU W H,et al. The isolation and identification of a silicate bacterium and the promoting effects on watermelon[J].JournalofNuclearAgriculturalSciences,2015,29(11): 2208-2214.(in Chinese with English abstract)
[18] 李俊,姜昕,李力,等. 微生物肥料的发展与土壤生物肥力的维持[J]. 中国土壤与肥料,2006(4): 1-5.
LI J,JIANG X,LI L,et al. Development of microbial fertilizer and maintaining of soil biological fertility[J].SoilsandFertilizersSciencesinChina,2006(4):1-5. (in Chinese with English abstract)
[19] 胡碧惠,赵春贵,杨素萍. 铁对产铁载体的沼泽红假单胞菌光合色素与铁载体合成的影响[J]. 微生物学报,2014,54(4): 408-416.
HU B H,ZHAO C G,YANG S P. Influence of iron on siderophore and photosynthetic pigments biosynthesis by siderophore-producingRhodopesudomonnas palustris[J].ActaMicrobiologicaSinica,2014,54(4): 408-416.(in Chinese with English abstract)
[20] MACHUCA A,MILAGRES A M F. Use of CAS-agar plate modified to study the effect of different variables on the siderophore production byAspergillus[J].LettersinAppliedMicrobiology,2003,36(3): 177-181.
[21] 肖志壮,杨加华,邢红宏,等. 赤霉素的分光光度法测定[J]. 烟台大学学报(自然科学与工程版),1997,10(4): 265-268.
XIAO Z Z,YANG J H,XING H H,et al. A spectrophotometric method for the determination of gibberellin[J].JournalofYantaiUniversity(NaturalScienceandEngineering),1997,10(4): 265-268.(in Chinese with English abstract)
[22] 李小俊,成丽霞,吴彦彬,等.拮抗菌抗菌谱及发酵液拮抗能力测定的新方法[J]. 生物技术,2007,17(1): 55-58.
LI X J,CHENG L X,WU Y B,et al. New methods of testing fermentation liquid antagonistic effect of antagonistic bacteria and antimicrobial spectrum[J].Biotechnology,2007,17(1): 55-58.(in Chinese with English abstract)
[23] XU W H,WANG Z G,WU F Z. Companion cropping with wheat increases resistance to Fusarium wilt in watermelon and the roles of root exudates in watermelon root growth[J].PhysiologicalandMolecularPlantPathology,2015,90: 12-20.
[24] 赵亚慧,华雪洁,杜海岩,等. 花生化感物质降解菌和抗连作拮抗菌复合菌剂应用效果的研究[J]. 土壤通报,2016,47(3): 599-604.
ZHAO Y H,HUA X J,DU H Y,et al. Research on the application effect of compound bacterium agent for allelochemicals degradation bacteria and antagonistic bacteria resistance to continuous cropping[J].ChineseJournalofSoilScience,2016,47(3): 599-604.(in Chinese with English abstract)
[25] 曹恩珲,侯宪文,李光义,等. 复合菌剂对盆栽番茄土壤理化性质及微生物活性的影响[J]. 生态环境学报,2011,20(5):875-880.
CAO E H,HOU X W,LI G Y,et al. Effect of combination bacteria on soil physicochemical properties and soil microbial activity by pot tomato experiments[J].EcologyandEnvironmentalSciences,2011,20(5):875-880.(in Chinese with English abstract)
[26] 李勤奋,邓晓,吴春媛,等. 复合菌剂对番茄抗病促生的效果研究[J]. 生态环境学报,2012,21(11): 1836-1840.
LI Q F,DENG X,WU C Y,et al. Study on the effects of complex bacterium on growth enhancement and disease resistance of tomato[J].EcologyandEnvironmentalSciences,2012,21(11): 1836-1840.(in Chinese with English abstract)
[27] RAUPACH G S,KLOEPPER J W. Mixtures of plant growth-promoting rhizobacteria enhance biological control of multiple cucumber pathogens[J].Phytopathology,1998,88(11): 1158-1164.
[28] JETIYANON K,KLOEPPER J W. Mixtures of plant growth-promoting rhizobacteria for induction of systemic resistance against multiple plant disease[J].BiologicalControl,2002,24(3): 285-291.
[29] BERENDSEN R L,PIETERSE C M J,BAKKER P A H M. The rhizosphere microbiome and plant health[J].TrendsinPlantScience,2012,17(8): 478-486.
[30] LIU K,GARRETT C,FADAMIRO H,et al. Induction of systemic resistance in Chinese cabbage against black rot by plant growth-promoting rhizobacteria[J].BiologicalControl,2016,99: 8-13.
[31] SHAO J H,XU Z H,ZHANG N,et al. Contribution of indole-3-acetic acid in the plant growth promotion by the rhizosphere strain Bacillus amyloliquefaciens SQR9[J].BiologyandFertilitySoils,2015,51(3): 321-330.
[32] SWARUP R,PERRY P,HAGENBEEK D,et al. Ethylene upregulates auxin biosynthesis inArabidopsisseedlings to enhance inhibition of root cell elongation[J].PlantCell,2007,19(7): 2186-2196.
[34] 崔晓双,王伟,张如,等. 基于根际营养竞争的植物根际促生菌的筛选及促生效应研究[J]. 南京农业大学学报,2015,38(6): 958-966.
CUI X S,WANG W,ZHANG R,et al. Screening of plant growth-promoting rhizobacteria based on rhizosphere nutrition competiveness and investigation of their promoting effects[J].JournalofNanjingAgriculturalUniversity,2015,38(6): 958-966.(in Chinese with English abstract)

