嗜水气单胞菌生物被膜形成的影响因素
冯 富,曲业鹏,马有智
(浙江大学 动物科学学院,浙江 杭州 310058)
生物被膜是一种附着于生物或非生物表面,包裹着由其自身产生的细胞外多聚基质、具有三维结构的细胞群体[1],是细菌生长过程中为适应生存环境而在固体表面上生长的一种与游离菌相对应的存在形式[2]。据报道,细菌形成生物被膜存在免受外界伤害、营养条件丰富、细菌与细菌间形成共同体以及细菌自我编码的生存方式等多种诱因[3]。
嗜水气单胞菌(Aeromonashydrophila,AH)在自然界中广泛分布,对水产动物、畜禽和人类均有致病性,可引起多种水产动物的败血症和人类腹泻,往往给淡水养殖业造成惨重的经济损失。近年来嗜水气单胞菌生物被膜引起了国内外学者的关注,已有研究将嗜水气单胞菌生物被膜作为口服疫苗[4],而生物被膜形成影响因素方面鲜有报道。本研究采用生物被膜体外定量检测方法,探讨了时间、温度、Ca2+、Mg2+、葡萄糖以及人纤维蛋白原对嗜水气单胞菌生物被膜形成的影响,为制备生物被膜条件优化提供了数据参考。
1 材料和方法
1.1 材料
嗜水气单胞菌AH-X由浙江大学水产动物健康养殖实验室提供;TSA培养基、BHI培养基购自北京陆桥技术股份有限公司;LB培养基按常规使用方法配制;人纤维蛋白原购自上海生工生物技术有限公司。
1.2 生物被膜的形成与测定
生物被膜制备与定量检测参考Stepanovic等[4-5]的96孔板法并加以改进,具体步骤如下:菌悬液与培养基按1∶100体积混合均匀后取200 μL加入到96孔细胞培养板小孔中,25 ℃(或37 ℃)静置培养后弃去培养液,用生理盐水250 μL清洗3次以去除游离菌,55 ℃烘箱干燥后往各孔加入200 μL甲醇,固定15 min,室温干燥;往各孔加入200 μL 0.1%结晶紫溶液,室温染色30 min后弃去染色液,0.85%生理盐水250 μL清洗3~5次;55 ℃干燥后各孔加入33%乙酸200 μL,待完全溶解后用酶标仪测定D570值。
1.3 培养时间对生物被膜形成的影响
将培养时间设置为2、8、12、20、24、36、48 h,按1.2方法测定不同培养时间生物被膜的D570值。
1.4 培养温度对生物被膜形成的影响
将培养温度设置为25、37 ℃,按1.2节方法测定各培养温度所形成的生物被膜的D570值。
1.5 葡萄糖对生物被膜形成的影响
添加2%、3%、4%、5%、6%、8%、10%和20%不同浓度梯度的葡萄糖于LB培养基中作为能量来源,用优化后的最佳条件25 ℃培养AH-X,按1.2节方法测定各培养温度所形成的生物被膜的D570值。
1.6 Ca2+、Mg2+对生物被膜形成的影响
分别向LB培养基中添加CaC12、MgC12至终浓度为0.1、1.0和10.0 mmoL·L-1,按1.2节方法测定添加CaC12和MgC12所形成的生物被膜的D570值。以不添加CaC12、MgC12的LB培养基为阴性对照。
1.7 人纤维蛋白原对生物被膜形成的影响
分别向LB培养基中添加人纤维蛋白原至终浓度分别为0、0.5、1.0、2.0、5.0 mg·mL-1,按1.2节方法测定各浓度的生物被膜形成量。
1.8 数据处理
实验结果以平均数±标准偏差表示,采用Excel、Graphpad prism 5软件进行统计分析。
2 结果与分析
2.1 培养时间对生物被膜形成的影响
采用LB培养基,在不同的培养时间对生物被膜进行测定。如图1所示,培养2 h后生物被膜已经开始形成,在12 h时生物被膜D570达到峰值。

图1 培养时间对生物被膜形成量的影响
2.2 培养温度对生物被膜形成的影响
如图2所示,将嗜水气单胞菌分别置于25 ℃与37 ℃培养,分别取3个时间点16、24和48 h进行测定,25 ℃条件培养下形成生物被膜的D570值均高于37 ℃,经统计分析均为差异极显著。
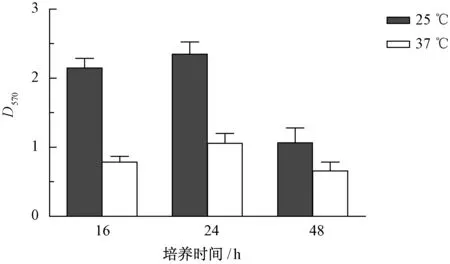
图2 培养温度对生物被膜形成量的影响
2.3 葡萄糖对生物被膜形成的影响
如图3所示,在葡萄糖浓度从0到2%时嗜水气单胞菌生物被膜形成的D570值极显著增加,当浓度大于3%时,AH生物被膜的D570值随葡萄糖浓度增加而下降,大于6%后趋于平稳。

图3 葡萄糖对生物被膜形成量的影响
2.4 Ca2+、Mg2+ 对生物被膜形成的影响
如图4所示,随着Ca2+浓度的增加,生物被膜形成量呈现上升趋势。当氯化钙浓度到达10.0 mmoL·L-1时,嗜水气单胞菌生物被膜形成量显著高于对照组和0.1、1.0 mmoL·L-1添加组。如图5所示,添加氯化镁各组之间形成生物被膜量没有显著差异。
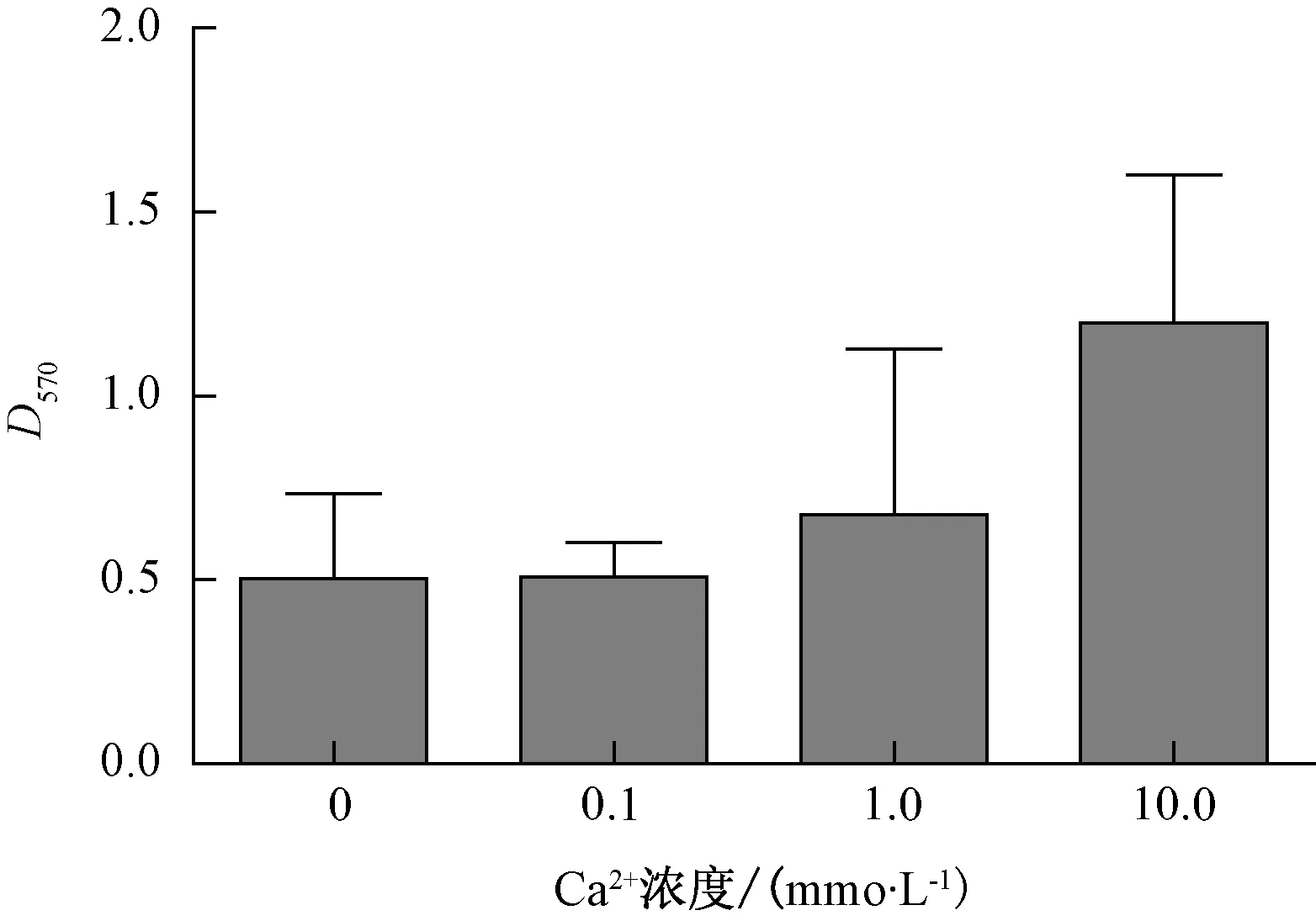
图4 Ca2+对生物被膜形成量的影响
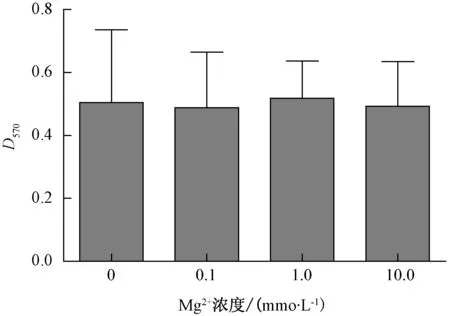
图5 Mg2+ 对生物被膜形成量的影响
2.5 人纤维蛋白原对生物被膜形成的影响
如图6所示,添加不同浓度纤维蛋白原各组生物被膜形成的D570与不添加纤维蛋白原的组差异极显著,添加不同浓度纤维蛋白原的各组间无显著差异。

图6 人纤维蛋白原对生物被膜形成量的影响
3 讨论
Abdallah等[6]研究发现温度对生物被膜的形成影响极显著,Fuchs等[7]发现温度同时影响生物被膜形成量和结构。本研究结果显示25 ℃条件下生物被膜的形成量显著高于37 ℃,与其结果一致,由此推测嗜水气单胞菌生物被膜形成的最适温度可能在25~30 ℃。
一定浓度葡萄糖有利于嗜水气单胞菌生物被膜的形成,生物被膜形成量显著上升,其原因可能是一定浓度葡萄糖可以促进嗜水气单胞菌的生长,并且可以增加细菌间的黏合度,更利于形成生物被膜或已形成的生物被膜不易被分解[8-9]。当葡萄糖浓度大于3%时反而对生物被膜的形成有抑制作用,其可能原因是葡萄糖浓度过高,造成渗透压过高,对细菌的增殖有抑制作用,因此生物被膜的形成量会在一定程度上减少。据文献报道,在低营养的M63培养基中添加葡萄糖以后有利于生物被膜的形成[10],与以上研究结果一致。
Kannan等[11]研究结果显示钙离子促进胞外多糖形成以及提高黏附力的作用远远大于镁离子,从而更有利于生物被膜的形成与稳固。殷文政等[12]研究了4种金属阳离子(Mg2+、Ba2+、Ca2+、Fe2+)对乳源性金黄色葡萄球菌生物被膜生长的影响,结果显示,Mg2+离子和有限浓度的Fe2+离子可以促进乳源性金黄色葡萄球菌生物被膜的生长。本试验结果表明钙离子能促进嗜水气单胞菌生物被膜的形成,而提高镁离子浓度生物被膜的形成没有显著变化。镁离子对生物被膜形成影响的差异性,推测是由于细菌种类的不同而产生的。
本试验发现人纤维蛋白原对嗜水气单胞菌生物被膜的形成有抑制作用,而对链球菌[13-14]、肠球菌[15-16]的生物被膜形成有促进作用。研究显示纤维蛋白原对生物被膜形成的作用并不是对细菌增殖的影响[14],而是有其他机制的存在。纤维蛋白原与细菌[17-18]及其表面吸附蛋白结合[19],从而增强其吸附力,提高了生物被膜的形成能力。链球菌能合成纤维蛋白原表面结合蛋白[17],为二者黏附的桥梁,推测嗜水气单胞菌表面可能缺少这种蛋白,故纤维蛋白原不能促进其生物被膜的形成,至于抑制作用的原因还有待进一步的研究。
参考文献:
[1] 俞军, 袁海兰, 欧仁建,等. 水霉菌生物膜体外模型构建及结构特征[J]. 中国预防兽医学报, 2015, 37(9):669-673.
[2] 李京宝, 韩峰, 于文功. 细菌生物膜研究技术[J]. 微生物学报, 2007, 47(3):558-561.
[3] JEFFERSON K K. What drives bacteria to produce a biofilm[J]. Fems Microbiology Letters, 2004, 236(2):163-173.
[4] 毛秀秀, 覃映雪, 邹文政,等. 致病性嗜水气单胞菌生物膜的形成特性[J]. 中国水产科学, 2011, 18(2):371-378.
[5] STEPANOVIC S, VUKOVIC D, DAKIC I, et al. A modified microtiter-plate test for quantification of staphylococcal biofilm formation[J]. Journal of Microbiological Methods, 2000, 40(2):175-179.
[6] ABDALLAH M, KHELISSA O, IBRAHIM A, et al. Impact of growth temperature and surface type on the resistance ofPseudomonasaeruginosaandStaphylococcusaureusbiofilms to disinfectants[J]. International Journal of Food Microbiology, 2015, 214:38.
[7] FUCHS F M, DRIKS A, SETLOW P, et al. An improved protocol for harvestingBacillussubtiliscolony biofilms[J]. Journal of Microbiological Methods, 2017, 134:7-13.
[8] 张秀平, 郭占达, 陈陆,等. 不同培养条件对鸭源鸡杆菌生物被膜形成的影响[J]. 中国兽医学报, 2014, 34(7):1083-1088.
[9] 欧阳凤菊, 李兆利, 赫明雷,等. 禽致病性大肠杆菌生物被膜的形成及其影响因素[J]. 中国预防兽医学报, 2010, 11(9):672-676.
[10] 陶健, 曹贝贝, 魏法山,等. 致病性大肠杆菌O157:H7生物被膜形成的影响因素研究[J]. 中国预防兽医学报, 2015, 37(8):600-603.
[11] KANNAN A, KARUMANCHI S L, RAMALINGAM S, et al. Quantitative study on the effect of calcium and magnesium palmitate on the formation ofPseudomonasaeruginosa, biofilm[J]. Journal of Microbiology Immunology & Infection, 2016, 49(6):988-991.
[12] 殷文政, 冯思明. 金属阳离子对乳源金黄色葡萄球菌生物被膜生长的影响[J]. 北京:第四届中国北京国际食品安全高峰论坛, 2011.
[13] FEHRMANN C, JURK K, BERTLING A, et al. Role for the fibrinogen-binding proteins coagulase and Efb in theStaphylococcusaureus-Candidainteraction[J]. International Journal of Medical Microbiology Ijmm, 2013, 303(5):230-238.
[14] BONIFAIT L, GRIGNON L, GRENIER D. Fibrinogen induces biofilm formation byStreptococcussuisand enhances its antibiotic resistance[J]. Applied & Environmental Microbiology, 2008, 74(15):4969-4972.
[15] MONTEALEGRE M C, ROSA S L L, ROH J H, et al. TheEnterococcusfaecalisEbpA pilus protein: attenuation of expression, biofilm formation, and adherence to fibrinogen start with the rare initiation codon ATT[J]. mBio,2015, 6(3):3.
[17] GREEFF A D, BUYS H, VERHAAR R, et al. Contribution of fibronectin-binding protein to pathogenesis ofStreptococcussuisserotype 2[J]. Infection & Immunity, 2002, 70(3):1319-25.
[18] 游铁博. 金黄色葡萄球菌生物被膜和纤维蛋白原结合能力研究[D]. 合肥:中国科学技术大学, 2014.
[19] SOUZA M C, DOS SANTOS L S, SOUSA L P, et al. Biofilm formation and fibrinogen and fibronectin binding activities byCorynebacteriumpseudodiphtheriticuminvasive strains[J]. Antonie Van Leeuwenhoek, 2015, 107(6):1387-1399.

