有机光致变色二芳基乙烯染料的发展动态
朱世琴,李萌祺,朱为宏†
①华东理工大学科技信息研究所,上海 200237;②华东理工大学精细化工研究所,上海 200237
现代化学工业及其产品工程的推动力来自于人类对美好生活的需求与创新,其发展的准则是高附加值、高利润率和极其安全的水准,传统的染料化学工业在高新技术领域中重新焕发出光彩就颇为典型[1-5]。联合国大会宣布2015年为国际光年(2015 International Year of Light, www.light2015.org),希望借此纪念千年来人类在光领域的重大发现,强调“推动可持续发展,解决能源、教育、农业和卫生等世界性问题的光技术的重要性”。目前新型光电功能性染料研究已成为精细化工学科发展的前沿领域,如基于传感识别的荧光染料、开发可用于绿色太阳电池的敏化染料的发展已进入白热化、快速发展的通道。但与其形成鲜明对比的是,具有光响应、呈双稳态特征的光致变色染料(photochromic dye)的产品开发及其应用则相对滞后。
光致变色染料在发生光致异构化反应过程中,不仅吸收光谱会发生显著变化,而且其他光化学及光物理性能也会发生明显改变,如光折指数、电折常数、荧光、氧化-还原电位和空间结构等[6-12]。目前,对光致变色染料的研究主要集中在二芳基乙烯、俘精酸酐、螺吡喃、偶氮苯等类化合物上,其中基于二芳基乙烯型的光致变色染料由于具有优异的热稳定性和耐疲劳性,引起广泛的重视,特别是在新一代光致变色防伪油墨、变色眼镜、有机光存储、多阶存储、分子开关材料、细胞成像等应用领域中[13-22]。目前,二芳基乙烯型光致变色染料作为一类具有特殊功能的专业性的染料,与当前的光、电、热、化学、生化等高新技术领域密切相关。
1 六元环烯桥修饰:引入芳香性较低的六元环可极大拓展双稳态的光致变色体系
从化学本质来讲,二芳基乙烯光致变色染料在紫外光的作用下发生典型的周环反应,引起颜色的变化。但二芳基乙烯在基态存在平行和反平行两种构象,在光的激发下,分子从HOMO轨道跃迁到LUMO轨道,在这个过程中,为了保持轨道的对称性,电环化反应总是通过顺旋过程进行。当分子处于平行构象顺旋闭环以后,由于芳基如噻吩上两个甲基的位阻效应,使得闭环体极不稳定。因此,光致变色反应主要是通过反平行构象的顺旋反应进行的。当中心烯桥为非环状时,此类光致变色化合物不仅仅能够发生电环化反应,同时还能发生反式-顺式(trans-cis)异构化。由于顺式(cis-)不能发生环化反应,因此会大大降低体系的抗疲劳性,经过多次循环以后,顺式的含量逐步上升(图1)。因此,为了防止trans-cis异构化的发生,通常在中心烯桥内引入杂环来消除副反应。
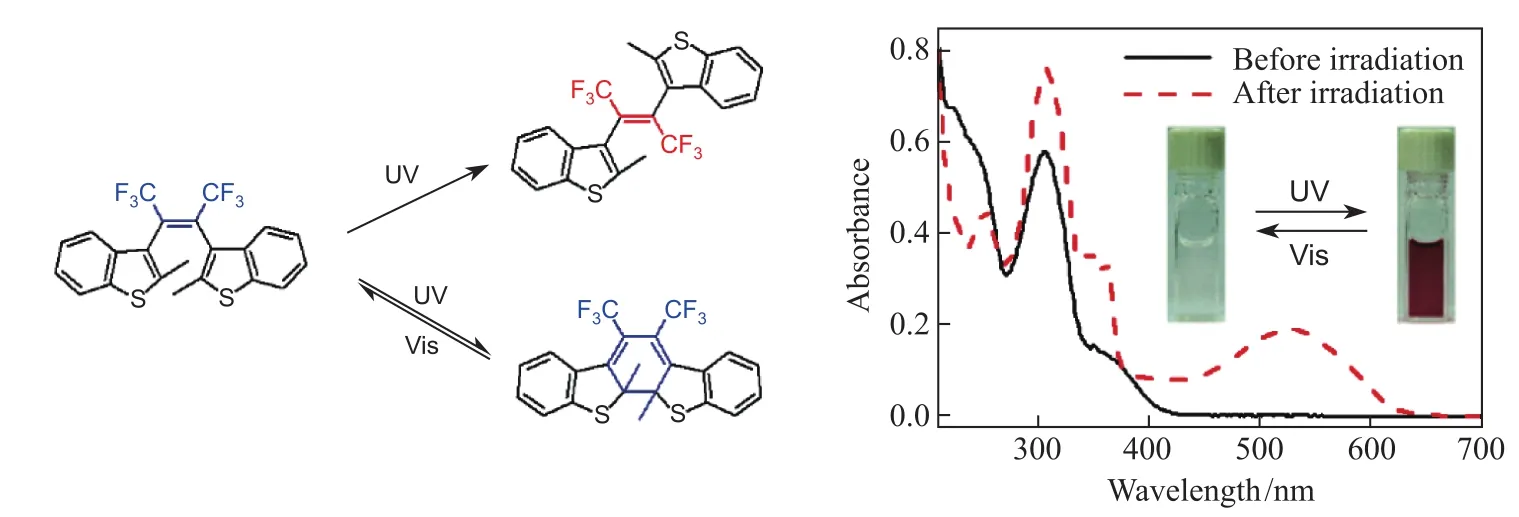
图1 光致变色现象(photochromism)是在不同波长光的诱导下,特定结构的化合物能够在两个不同的态之间实现可逆的结构变化,且这两个态具有不同的吸收光谱。二芳基乙烯在紫外光的作用下发生典型的周环反应,引起颜色的变化(注:非环状烯桥光致变色体系同时存在反式-顺式(trans-cis)异构和电环化异构)
到目前为止,基于典型的二噻吩乙烯的分子设计主要集中在侧端的噻吩修饰,如日本的Irie[6]、国内蒲守志等[23-25]开发了多个系列芳杂环二芳基乙烯化合物,其将吡唑、吡咯甚至苯环都引入到全氟的二芳乙烯的侧边作为杂环。相比之下,二噻吩乙烯的烯桥则主要集中在五元环上,如全氢环戊二烯、全氟环戊二烯、马来酸酐和马来酰亚胺等烯桥(图2)。由于六元环烯桥闭环量子产率较高的特性,近年来以六元环为烯桥的光致变色化合物也引起广泛关注,如华东理工大学田禾研究组[26]将氮杂卟啉镁作为烯桥,香港任咏华院士等[27]将邻菲罗啉作为烯桥,并将其与一些金属络合,研究其发光行为。最近任咏华院士等进一步将磷杂环戊烯氧化物作为烯桥,实现可见光诱导开关的同时仍具有优异的光致变色性能[28]。北京理化所陈懿研究组[29]对lucas路线方法进行了重大改进,报道了一类新的以二氢噻吩和二氢吡咯为烯桥的二芳乙烯化合物。该方法的最大优点是,拓展了二噻吩乙烯的烯桥类型,其易于合成不对称的二芳乙烯,也适用于不同的芳杂环体系。但六元环烯桥具有一定的芳香性,在暗处常温下会自动恢复到开环体,这是由于发生闭环后芳香稳定化能发生了大量损失。因此,引入芳香性较低的六元环能够拓展双稳态的光致变色体系。我们课题组[30-31]系统地比较了萘酰亚胺、苯并噻二唑、二苯并噻二唑作为烯桥的开、闭环体双稳态(图3),通过引入强吸电子性的二苯并噻二唑为六元环烯桥,成功地获得了溶液及晶体的高双稳态、荧光开关效应,突破了传统六元环烯桥闭环体不稳定的偏见,甚至实现了闭环体的成功分离。进一步的系统研究揭示了烯桥芳香性与对应光致变色闭环体热稳定性之间的关系,以VIP(very important paper)论文发表,并被日本的Irie、Kawai、Fukaminato以及德国的Würthner等教授在其综述中进行了评述。该体系为双稳态六元环光致变色化合物提供了全新的发展思路。

图2 (a) 二噻吩乙烯型光致变色染料主要通过侧端的噻吩和烯桥两种渠道进行修饰;(b) 常见的五元环烯桥的二噻吩乙烯体系

图3 双稳态六元环烯桥体系的芳香性与双稳态之间的关系:芳香性递减,闭环体稳定性增强
2 光致变色的门控效应
通常而言,光致变色反应依据分子吸收光子的比例而进行,这样的线性光响应的性质,实际上是不利于作为信息存储的介质的,因为常规使用光信号作为输出手段的检测方法,如吸收和荧光光谱,会在读取数据的过程中破坏存储的数据。采用门控的光致变色体系,是一个很好的规避这些不利因素的途径。如我们课题组成功地在二芳基乙烯侧端引入联噻唑等配位单元,通过特定的BF3、汞离子配位实现高效光致变色门控效应[32-33]。又如复旦大学易涛[34]、Christophe Coudret[35]、Branda[36]等调控分子内氢键,当活性的羟基被酯化后,光致变色反应则可以正常进行,反之通过水解反应可以再次限制光致变色反应。香港大学的任咏华院士也开发了一个独特的门控的二芳基乙烯[37](图4)。由于其自身存在极强的π-π/pπ(B)的辐射失活途径,激发态二芳基乙烯无法正常发生闭环反应。通过简单地加入F-与B中心配位则关闭了这一失活途径,使光致变色反应顺利发生,反之,通过加入B(C6F5)3和甲醇可以移除F-,回到初始光惰性态(图4)。光致变色的门控效应一般依赖于外界的刺激,但对其所采用的刺激手段、门控效率、可逆性的研究仍具有挑战性[38]。

图4 调控辐射失活途径,实现光致变色的门控效应
3 光致变色的手性调控
化合物宏观性质的“手性”对功能材料的设计具有很大的诱惑,目前如手性(或螺旋形)自组装已引起很大反响。手性所对应的旋光度、圆二色信号均可作为非破坏性的读出信号,基于此可以建立光控手性开关。这对拓展光致变色在无损信息存储和生物手性识别方面的应用有着重要的意义。巧合的是,现在主流的二芳基乙烯的结构类似于三联苯(1个烯桥和2个芳基),因而由于骨架扭曲,在开环状态包含了互变的一对手性的构象(P和M螺旋)和一个非手性的构象(图5),而在闭环反应过程中则对应地生成一对手性的对映异构体(R,R)和(S,S)。但在溶液中,开环体的平行构型和反平行构型实际上会发生高速转换,因此对这种对映体的专一性(enantiospecificity)的研究一直是具有挑战的课题。

图5 光致变色染料的二芳基乙烯体系在可逆的开环、闭环过程中存在5个异构体,即一对开环的手性对映体、一对闭环的手性对映体和1个光非活性的开环体
目前实现手性光致变色反应的调控更多的是采用外围的辅助手段,如引入手性基团诱导非对映异构反应[39-42],在单晶[43-45]和超分子[46-49]状态进行光反应, 通过共价键或位阻限定构型[50]。如通过共价键可以捆绑住开环体中的互变构象,从而实现维持开闭环中的手性调控。如图6所示对应专一性的光致变色反应[51],而且它们在远离吸收边带的750 nm仍表现出较大的旋光度的改变[52],使得其在无损信号输出方面颇受重视。然而,此工作建立于闭环体热不稳定的二苯基乙烯体系之上,因此限制了其进一步发展。
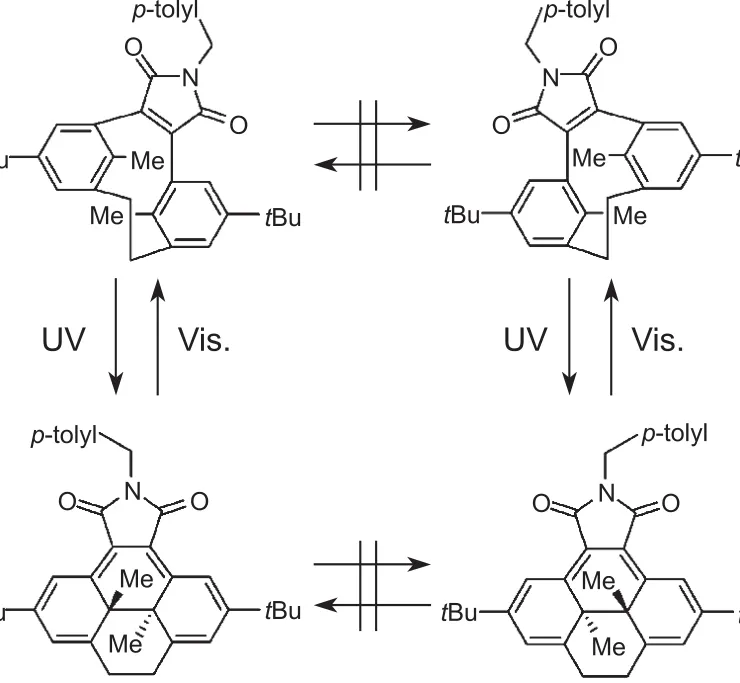
图6 采用共价键固定开环体中的互变构象,实现维持开闭环中的手性调控
还有一类值得一提的方式是,Feringa等利用sergeant-soldier的超分子手性放大效应[47],实现了图7的分子凝胶,在其中加入少量的手性前体即可诱导有手性选择的闭环反应(ee=10%~40%)。目前此类方法由于较低的效率和严格的介质要求限制了其进一步应用,不过此类获得手性选择的方式对其他手性体系具有一定的借鉴价值。
4 光致变色的化学反应调控
在众多化学反应条件的选择性上,光是最容易和便捷的,这是因其快速的开关过程和远程操作的能力而决定的。二芳基乙烯在紫外和可见光的作用之下可以可逆地在开闭环间转化,无疑是最有希望的构成分子开关的基本元素之一。目前,二芳基乙烯已经在光学、磁性、电导、化学反应以及生物开关方面取得了不少进展,其中比较热门的一个研究方向是利用二芳基乙烯体系调控其他化学反应的活性(包括不对称催化),甚至生物活性。如美国的Bielawski教授研究了以咪唑作为烯桥的二芳基乙烯[53-54],发现其作为一个氮杂环卡宾可催化酯的交换以及酰胺化反应。其开环体在强碱作用下失去活泼氢,表现为一个咪唑卡宾结构,可以很好地催化反应,而发生闭环反应之后电子云遍布整个分子,卡宾的电子云密度降低,反应效率下降。又如Branda教授等设计在活性反应位点引入手性恶唑啉单元[55],使得开环状态的二芳基乙烯可以与Cu双齿配位,进而催化偶氮脂类与烯烃的手性环丙化反应。而通过紫外光照转化为闭环体之后,由于无法与Cu双齿配位,反应则完全没有手性选择性(图8)。同时,二芳基乙烯可以通过引入生物的多肽结构[56-57],从而实现光控抗生性的药物分子。通过药理研究,开环体的抗菌要远高于闭环体,这对以后开发智能区域性选择性治疗有一定的指导意义。另外,金属有机骨架(MOF,metalorganic framework)材料是一种相对新型的多孔材料,由于其结构的多样性、可设计性、可剪裁性以及超高的比表面积,近年来吸引了广泛的研究兴趣,并在很多领域展现了潜在的应用前景,特别是在催化、分离方面的应用更受到青睐[58-60]。

图7 利用sergeant-soldier的超分子手性放大效应,实现维持开闭环中的手性调控

图8 在光致变色单元中引入手性恶唑啉单元,通过光调控手性催化选择性:在开环状态下,手性恶唑啉单元可以与Cu双齿配位,表现很好的手性环丙化反应;在闭环状态下,由于无法与Cu双齿配位,反应则完全没有手性选择性
5 光致变色的自组装体系和表面张力的光调控
光致变色二芳基乙烯单元也可以引入到自组装或MOF结构中,调节自组装结构的化学物理性质[61-64]。我们课题组和华东师范大学的杨海波课题组合作报道了一系列通过Pt配位形成的含有多个二芳基乙烯单元的光致变色体系(图9),通过超分子自组装环化法实现精确控制环结构、定量闭环转化以及可逆的光响应[65]。
Feringa等将亲水的聚醚和疏水的胆固醇同时引入二芳基乙烯中[66],开环体在水溶液中形成双分子层,经过光照生成的闭环体表现为囊泡结构;而在有机溶剂中,开环体容易形成规则的凝胶纤维,闭环体则相对松散,从而实现了通过光照改变溶液的形态。我们课题组[67]将自然界普遍存在的手性氨基酸基团和萘酰亚胺基团引入二芳基乙烯侧链,基于分子间氢键驱动力在非极性溶剂中形成螺旋自组装超分子体系,并伴随着手性信号的放大;同时利用二芳基乙烯光开关功能有效调节分子自组装行为和荧光发射。Irie等[68-70]更是将光致变色二芳乙烯单元引入到表面超亲水性和疏水性界面(surface wettability)的光学调控。与其他界面表面张力不同的是,该调控可以采用光进行有效的可逆调控,直接的证据就是表面接触角可在150.4°~81.1° 之间可逆变化(图10)。

图9 通过超分子自组装环化法实现双稳态,具有定量闭环转化、可逆的光响应特征

图10 利用光致变色二芳基乙烯单元进行表面亲水性和疏水性界面的光学可逆调控
6 光致变色体系的晶形颜色的调控
光致变色体系无论在溶液或晶体中的颜色调控,均可以通过化学结构的修饰实现丰富的颜色,如黄、橙、蓝、绿等颜色的变化。实际上,很多光致变色体系由于晶形的缘故,仅以一种反平行构型存在,这对光致变色的闭环量子效率非常有利。二芳乙烯单元的光致变色体系在晶体中,如满足反平行构型以及环化反应的两个活性碳之间的距离小于4.2 Å(1Å=0.1 nm),一般可发生典型的光致变色变化。但到目前为止,真正宽光谱、单一组分的黑色还未能实现。Irie等则采用3种二芳基乙烯的光致变色染料(对应的闭环体呈黄色、红色、蓝色)形成混晶,得到深黑色的宽光谱(图11)。非常有趣的是,该晶体的颜色可采用选择性的波长得到单一组分的颜色[71]。该类多重颜色的光致变色晶体在三维光存储和光控全色显示方面具有很好的应用潜力。
7 利用光致变色体系提高光学成像分辨率
光学平板蚀刻是制造纳米结构的关键技术,不同的复杂技术已经被发明出来用于提高纳米定制分辨率。2014年诺贝尔化学奖就授予了超分辨荧光成像技术,而光致变色染料在该领域也表现出了很好的应用前景。图12显示了该技术的原理[72],即在顶部的记录光阻材料层,引入一层光致变色薄膜,该层薄膜采用了两种吸收在UV(λ1)和可见光(λ2)之间互相转化的异构体,这样同时应用于重叠峰在λ1λ2节点的干涉图案。吸收在λ1使得薄膜在该波长显示为透明,但是暴露在区域波长λ2会使其回归到原来异构体并且继续在λ1有吸收峰,形成一个稳定的纳米尺寸的透明孔径。该项技术可以限制光的空间尺寸使之远小于使用波长,从而极大地提高光学成像分辨率。扫描电子显微镜的图像显示了分辨率线的宽度大约为30 nm,远小于所用于记录的波长325 nm。华中科技大学朱明强教授等最近在这方面也取得很好的进展[73]。其采用独特的分子设计,发展一种超级荧光分子开关,将基于二芳基乙烯的荧光分子开关比提高了4个数量级,达到1万倍以上,响应速率也大幅度提高。利用这些新特点制作出具有超级光敏感的全光晶体管,同时还对两亲性嵌段共聚物溶液自组装纳米结构进行光学纳米成像,该体系在全光晶体管和超分辨成像方面表现出极好的应用潜力。

图11 利用不同颜色的光致变色二芳乙烯实现全光谱吸收晶体及光控颜色的调控

图12 利用光致变色体系提高光学成像分辨率的原理:(a) 纳米尺寸的记录射束处于分别采用波长λ1照射时产生的透明区和波长λ2照射时的不透明区之间;(b) 用吸光度调制的亚波长线条的扫描电镜照片。扫描电子显微镜的图像显示了分辨率线的宽度大约为30 nm,远小于所用于记录的波长325 nm
光致变色染料基于光诱导共轭体系的改变,调控光的选择性吸收和能量转换,使之具有对信息和能量的获取、传输、转换、存储、处理与显示等功能,已拓展为π-电子共轭体系与分子光电子学重要的组成部分,其相关深入的基础与应用研究对先进光电功能材料这一国家科技规划重点支持的领域具有十分重要的意义。但与无机材料相比,光致变色染料产品的工程化、功能化等已成为应用的瓶颈,其稳定性机制的研究也相对薄弱。
8 位阻型烯桥体系与手性专一性响应
二芳基乙烯的抗疲劳度在目前已知的光致变色体系中无疑是最为突出的,但并不是所有的二芳基乙烯都具有高的光量子效率。目前公认高抗疲劳的化合物中最具代表性的都是基于全氟环戊烯烯桥,然而此烯桥的专利几乎全在日本人手里,因此开发自主的新型高抗疲劳的光致变色染料体系具有重大意义,而设计并合成具有低成本、高性能的二芳基乙烯仍然是一个很有挑战性的课题。比如光致变色二芳基乙烯体系的开环体拥有平行异构体(parallel conformer)和反平行异构体(anti-parallel conformer),由于芳基的自由旋转导致二者可以互相转化,在溶液中的分布大约为1:1,故闭环量子产率(ΦO-C)在溶液中通常被限制在50 %以下。虽然可以通过烯桥和二芳基间分子内的弱作用力,诱使反平行异构体成为优势构象异构体,但常需要依赖特定的反应环境,且会损害二芳基乙烯自身最基本的优点——热稳定性和抗疲劳度。
因此,需要建立一种广谱的高光敏性(ΦO-C> 50%)并同时仍具有高双稳态以及高抗疲劳度的二芳基乙烯体系。我们课题组[74-75]以具有高双稳态的位阻性二苯并噻二唑砌块作为烯桥,同时创新性地在侧链引入大空间体积的芳基体系,与烯桥产生较大分子内位阻效应,彻底阻断了平行与反平行异构体的互相转化,并成功地实现了平行与反平行异构体的拆分,将溶液中闭环量子效率提高到50 %以上(ΦO-C=73%)的同时,仍然保有高的双稳态和优异的抗疲劳度。进一步地对侧链芳基进行修饰,引入吸电子基团(如硝基),通过抑制分子内ICT效应,成功地将闭环量子效率提高到91%,从而接近理论上100 %的效率(图13)。

图13 通过增大侧链与烯桥位阻得到纯反平行构型以提高光敏性,并通过引入吸电子基团抑制ICT效应以进一步提高闭环量子效率
基于上述工作,我们课题组[76]又成功地实现了完全的手性拆分和手性专一性响应。平行与反平行构型的分离使得二芳基乙烯体系手性异构体的拆分也得以实现。通过制备型高效液相成功地分离得到了BBTE化合物的5个高热稳定的构象异构体:反平行异构体的P-ap-BBTE 和M-ap-BBTE、平行异构体的p-BBTE、闭环体(R,R)-c-BBTE 和(S,S)-c-BBTE(图14)。所有异构体经过X射线单晶衍射,确证了各自的绝对构型。反平行和闭环异构体的对映异构体间可以发生对映异构专一选择性的光致变色反应,彻底解决了二芳基乙烯内在自发消旋而无手性响应的问题。通过掺杂于聚合物基质中,此类二芳基乙烯的内源性的手性响应可以应用于光手性信号调控和以旋光度作为无损输出信号的光存储材料。未来可以更进一步地对此类结构的芳基基团进行修饰,在自组装、化学反应调控、生物领域以及光信息存储等领域将有广泛而深入的应用。
9 总结与展望
二芳基乙烯型光致变色染料由于拥有优异的双稳态和抗疲劳度,在光信息存储、防伪油墨、分子开关和生物成像等领域受到广泛重视和应用。本文介绍了近几年来二芳基乙烯化合物在拓展性能和应用领域所取得的成果,其中与传统侧端的二芳基修饰不同,我们课题组聚焦烯桥修饰和功能化,主要通过六元环烯桥修饰。基于课题组所发展的分子体系——位阻型二苯并噻二唑砌块(building block)作为烯桥[74-77],最近我们成功地发展了新型位阻型烯桥的光致变色染料体系,围绕功能染料产品工程科学基础问题,寻求具有位阻效应的二芳基乙烯体系的特有构象异构体分离,以突破活性构象异构体的动态拆分,实现光诱导手性对映专一性,探索建立具有手性信号响应的手性开关及光存储。基于位阻型烯桥概念,从分子设计和源头创新出发,推动位阻型烯桥的光致变色染料体系及其产品工程科学基础问题的研究,为发展“化学产品工程”知识体系作出贡献,进一步推动并探索在光致变色领域如光致变色防伪油墨、变色眼镜、光限域染料等典型领域中的产业化应用[78-79],在功能性染料体系及应用方面形成自主知识产权体系。

图14 BBTE 所有热稳定异构体间的拆分以及开闭环手性异构体间的专一性响应
(2017年11月25日收稿)■
参考文献
[1] HUNGER K. Industrial dyes: chemisty, properties, applications [M].Kelkheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, 2003.
[2] KIM S H. Functional dyes [M]. [S. l.]: Elsevier Science Ltd., 2006.
[3] TIAN H. 4th International Conference on Molecular Sensors and Molecular Logic Gates [C]. Shanghai, November 9-12, 2014.
[4] YANG Z G, CAO J F, HE Y X, et al. Macro-/micro-environmentsensitive chemosensing and biological imaging [J]. Chemical Society Review, 2014, 43(13): 4563-4601.
[5] TANG B, ZHENG X, LIN T, et al. Hydrophobic structural color films with bright color and tunable stop-bands [J]. Dyes and Pigments, 2014,104: 146-150.
[6] IRIE M, FUKAMINATO T, MATSUDA K, et al. Photochromism of diarylethene molecules and crystals: memories, switches, and actuators[J]. Chemical Reviews, 2014, 114(24): 12174-12277.
[7] ZHANG J, ZOU Q, TIAN H. Photochromic materials: more than meets the eye [J]. Advanced Materials, 2013, 25(3): 378-399.
[8] FUKAMINATO T. Single-molecule fluorescence photoswitching:design and synthesis of photoswitchable fluorescent molecules [J].Journal of Photochemistry and Photobiology C: Photochemistry Reviews, 2011, 12(3): 177-208.
[9] LIU H H, CHEN Y. Construction of multi-level fluorescent switch using photochromic diarylethene and fluorescent dye [J]. Dyes and Pigments, 2011, 89(3): 212-216.
[10] XU K, ZHAO J, CUI X, et al. Photoswitching of triplet-triplet annihilation upconversion showing large emission shifts using a photochromic fluorescent dithienylethene-Bodipy triad as a triplet acceptor/emitter [J]. Chemical Communications, 2015, 51(10): 1803-1806.
[11] YOKOYAMA Y, NAKATANI K. Photon-working switches [M]. [S.l.]:Springer, 2017.
[12] 朱世琴, 李文龙, 朱为宏. 新型烯桥二芳基乙烯光致变色体系[J]. 化学进展, 2016, 28: 975-992.
[13] FERINGA B L. Molecular switches [M]. Weinheim: Wiley-VCH,2001.
[14] 李旭, 韩杰, 庞美丽, 等. 有机光致变色自由基化合物研究进展[J].有机化学, 2007, 27(6): 696-702.
[15] IRIE M. Diarylethenes for memories and switches [J]. Chemical Reviews, 2000, 100(5): 1685-1716.
[16] 符定良, 孟庆华, 黄德音, 等. 变色树脂镜片及光致变色染料的筛选[J]. 染料与染色, 2007, 44(4): 13-18.
[17] 罗千福, 范曲立, 黄维, 等. 二芳基乙烯类光致变色材料的合成概述[J]. 有机化学, 2007, 27(2): 175-187.
[18] 张恒, 杨卓如, 韦宝卿, 等. 有机光致变色化合物光化学稳定性能研究[J]. 合成材料老化与应用, 2006, 35(4): 50-52.
[19] 刘学东, 石明, 张复实, 等. 有机光致变色材料的合成与多阶存储实验研究[J]. 功能材料与器件学报, 2006, 12(2): 117-119.
[20] 林坚, 柴文祥, 杨芸芸, 等. 有机-无机杂化光致变色材料的研究进展[J]. 中南大学学报(自然科学版), 2011, 42(10): 2977-2983.
[21] HU F, JIANG L, CAO M, et al. Cyanine-based dithienylethenes:synthesis, characterization, photochromism and biological imaging in living cells [J]. RSC Advances, 2015, 5(8): 5982-5987.
[22] NEVSKYI O, SYSOIEV D, OPPERMANN A, et al. Nanoscopicvisualization of soft matter using fluorescent diarylethene photoswitches [J]. Angewandte Chemie International Edition, 2016,55(41): 12698-12702.
[23] FAN C, PU S, LIU G. Effects of solvents on the growth of an asymmetrical photochromic diarylethene crystal [J]. Dyes and Pigments, 2015, 113: 61-69.
[24] LIU H, PU S, LIU G, et al. Photochromism of asymmetrical diarylethenes with a pyrimidine unit: Synthesis and substituent effects[J]. Dyes and Pigments, 2014, 102: 159-168.
[25] HU F, HU M, LIU W, et al. Synthesis and photochromic properties of triazole-bridged dithienylethene compounds with pyrene units [J].Tetrahedron Letters, 2015, 56(2): 452-457.
[26] TIAN H, CHEN B, TU H Y, et al. Novel bisthienylethene-based photochromic tetraazaporphyrin with photoregulating luminescence[J]. Advanced Materials, 2002, 14(12): 918-923.
[27] YAM V W W, KO C C, ZHU N. Photochromic and luminescence switching properties of a versatile diarylethene-containing 1, 10-phenanthroline ligand and its rhenium (I) complex [J]. Journal of the American Chemical Society, 2004, 126(40): 12734-12735.
[28] WU M W, NG M, LAM W H, et al. Photochromic heterocycle-fused thieno [3, 2-b] phosphole oxides as visible light switches without sacrificing photoswitching efficiency [J]. Journal of the American Chemical Society, 2017, 139 (42): 15142-15150.
[29] CHEN Y, ZENG D X, FAN M G. Synthesis and photochromic properties of functional diarylethene with a 2, 5-dihydrothiophene bridging unit [J]. Organic Letters, 2003, 5(9): 1435-1437.
[30] ZHU W, YANG Y, METIVIER R, et al. Unprecedented stability of a photochromic bisthienylethene based on benzobisthiadiazole as an ethene bridge [J]. Angewandte Chemie International Edition, 2011,50(46): 10986-10990.
[31] YANG Y, XIE Y, ZHANG Q, et al. Aromaticity-controlled thermal stability of photochromic systems based on a six-membered ring as ethene bridges: photochemical and kinetic studies [J]. Chemistry — A European Journal, 2012, 18(37): 11685-11694.
[32] WU Y, ZHU W, WAN W, et al. Reversible photoswitching specifically responds to mercury (II) ions: the gated photochromism of bis(dithiazole) ethene [J]. Chemical Communications, 2014, 50(91):14205-14208.
[33] WU Y, CHEN S, YANG Y, et al. A novel gated photochromic reactivity controlled by complexation/dissociation with BF3[J]. Chemical Communications, 2012, 48(4): 528-530.
[34] LIU K, WEN Y, SHI T, et al. DNA gated photochromism and fluorescent switch in a thiazole orange modified diarylethene [J].Chemical Communications, 2014, 50(65): 9141-9144.
[35] MASSAAD J, MICHEAU J C, COUDRET C, et al. Gated photochromism and acidity photomodulation of a diacid dithienylethene dye [J]. Chemistry — A European Journal, 2012,18(21): 6568-6575.
[36] NOURMOHAMMADIAN F, WU T, BRANDA N R. A ‘chemicallygated’ photoresponsive compound as a visible detector for organophosphorus nerve agents [J]. Chemical Communications, 2011,47(39): 10954-10956.
[37] POON C T, LAM W H, YAM V W W. Gated photochromism in triarylborane-containing dithienylethenes: a new approach to a “lockunlock” system [J]. Journal of the American Chemical Society, 2011,133(49): 19622-19625.
[38] MOROZOV D, GROENHOF G. Hydrogen bond fluctuations control photochromism in a reversibly photo-switchable fluorescent protein[J]. Angewandte Chemie International Edition, 2016, 55(2): 576-578.
[39] SHIOZAWA T, HOSSAIN M K, UBUKATA T, et al. Ultimate diastereoselectivity in the ring closure of photochromic diarylethene possessing facial chirality [J]. Chemical Communications, 2010,46(26): 4785-4787.
[40] YOKOYAMA Y, SHIOZAWA T, TANI Y, et al. A unified strategy for exceptionally high diastereoselectivity in the photochemical ring closure of chiral diarylethenes [J]. Angewandte Chemie International Edition, 2009, 48(25): 4521-4523.
[41] JIN-NOUCHI H, TAKESHITA M. Syntheses and fully diastereospecific photochromic reactions of thiophenophan-1-enes with chiral bridges [J]. Chemistry — A European Journal, 2012,18(31): 9638-9644.
[42] NAKASHIMA T, YAMAMOTO K, KIMURA Y, et al. Chiral photoresponsive tetrathiazoles that provide snapshots of folding states[J]. Chemistry — A European Journal, 2013, 19(50): 16972-16980.
[43] YAMAMOTO S, MATSUDA K, IRIE M. Absolute asymmetric photocyclization of a photochromic diarylethene derivative in single crystals [J]. Angewandte Chemie, 2003, 115(14): 1674-1677.
[44] KODANI T, MATSUDA K, YAMADA T, et al. Reversible diastereoselective photocyclization of a diarylethene in a singlecrystalline phase [J]. Journal of the American Chemical Society, 2000,122(40): 9631-9637.
[45] ICHIKAWA T, MORIMOTO M, IRIE M. Asymmetric photoreaction of a diarylethene in hydrogen-bonded cocrystals with chiral molecules[J]. Photochemical & Photobiological Sciences, 2014, 13(2): 199-204.
[46] MAEDA N, HIROSE T, MATSUDA K. Discrimination between conglomerates and pseudoracemates using surface coverage plots in 2D self-assemblies at the liquid-graphite interface [J]. Angewandte Chemie, 2017, 129(9): 2411-2415.
[47] DE JONG J J D, LUCAS L N, KELLOGG R M, et al. Reversible optical transcription of supramolecular chirality into molecular chirality [J]. Science, 2004, 304(5668): 278-281.
[48] VAN DIJKEN D J, BEIERLE J M, STUART M C A, et al.Autoamplification of molecular chirality through the induction of supramolecular chirality [J]. Angewandte Chemie International Edition, 2014, 53(20): 5073-5077.
[49] PACE T, MÜLLER V, LI S, et al. Enantioselective cyclization of photochromic dithienylethenes bound to DNA [J]. Angewandte Chemie International Edition, 2013, 52(16): 4393-4396.
[50] TAKESHITA M, YAMATO T. Enantioselective photochromic reaction of a [2.2] metacyclophan-1-ene [J]. Angewandte Chemie International Edition, 2002, 41(12): 2156-2157.
[51] WALKO M, FERINGA B L. The isolation and photochemistry of individual atropisomers of photochromic diarylethenes [J]. Chemical Communications, 2007 (17): 1745-1747.
[52] TAKESHITA M, YAMOTO T. Reversible optical rotation change according to the enantiospecific photochromic reaction of [2.2]metacyclophan-1-ene [J]. Chemistry Letters, 2004, 33(7): 844-845.
[53] NEILSON B M, BIELAWSKI C W. Photoswitchable organocatalysis:using light to modulate the catalytic activities of N-heterocyclic carbenes [J]. Journal of the American Chemical Society, 2012, 134(30):12693-12699.
[54] TEATOR A J, TIAN Y, CHEN M, et al. An isolable, photoswitchable N-heterocyclic carbene: on-demand reversible ammonia activation [J].Angewandte Chemie, 2015, 127(39): 11721-11725.
[55] SUD D, NORSTEN T B, BRANDA N R. Photoswitching of stereoselectivity in catalysis using a copper dithienylethene complex[J]. Angewandte Chemie, 2005, 117(13): 2055-2057.
[56] BABII O, AFONIN S, BERDITSCH M, et al. Controlling biological activity with light: diarylethene-containing cyclic peptidomimetics[J]. Angewandte Chemie International Edition, 2014, 53(13): 3392-3395.
[57] BABII O, AFONIN S, GARMANCHUK L V, et al. Direct photocontrol of peptidomimetics: an alternative to oxygen-dependent photodynamic cancer therapy [J]. Angewandte Chemie, 2016, 128(18):5583-5586.
[58] 黄刚, 陈玉贞, 江海龙, 等. 金属有机骨架材料在催化中的应用[J].Acta Chim Sinica, 2016, 74(2): 113-129.
[59] HARTLIEB K J, HOLCROFT J M, MOGHADAM P Z, et al. CDMOF: a versatile separation medium [J]. Journal of the American Chemical Society, 2016, 138(7): 2292-2301.
(编辑:沈美芳)
[60] ZHAO H, SEN S, UDAYABHASKARARAO T, et al. Reversible trapping and reaction acceleration within dynamically self-assembling nanoflasks [J]. Nature Nanotechnology, 2016, 11(1): 82-88.
[61] HECHT S. Nanoreactors: chemistry in and out of nanoflasks [J].Nature Nanotechnology, 2016, 11(1): 6-7.
[62] LUO F, FAN C B, LUO M B, et al. Photoswitching CO2capture and release in a photochromic diarylethene metal-organic framework [J].Angewandte Chemie International Edition, 2014, 53(35): 9298-9301.
[63] PARK J, FENG D, YUAN S, et al. Photochromic metal-organic frameworks: reversible control of singlet oxygen generation [J].Angewandte Chemie, 2015, 127(2): 440-445.
[64] MALLICK A, GARAI B, ADDICOAT M A, et al. Solid state organic amine detection in a photochromic porous metal organic framework[J]. Chemical Science, 2015, 6(2): 1420-1425.
[65] CHEN S, CHEN L J, YANG H B, et al. Light-triggered reversible supramolecular transformations of multi-bisthienylethene hexagons[J]. Journal of the American Chemical Society, 2012, 134(33): 13596-13599.
[66] VAN HERPT J T, AREEPHONG J, START M C A, et al. Lightcontrolled formation of vesicles and supramolecular organogels by a cholesterol-bearing amphiphilic molecular switch [J]. Chemistry — A European Journal, 2014, 20(6): 1737-1742.
[67] CAI Y, GUO Z, CHEN J, et al. Enabling light work in helical selfassembly for dynamic amplification of chirality with photoreversibility[J]. Journal of the American Chemical Society, 2016, 138(7): 2219-2224.
[68] UCHIDA K, NISHIKAWA N, IZUMI N, et al. Phototunable diarylethene microcrystalline surfaces: lotus and petal effects upon wetting [J]. Angewandte Chemie International Edition, 2010, 49(34):5942-5944.
[69] UYAMA A, YAMAZOE S, SHIGEMATSU S, et al. Reversible photocontrol of surface wettability between hydrophilic and superhydrophobic surfaces on an asymmetric diarylethene solid surface[J]. Langmuir, 2011, 27(10): 6395-6400.
[70] NISHIMURA R, HYODO K, SAWAGUCHI H, et al. Fractal surfaces of molecular crystals mimicking lotus leaf with phototunable double roughness structures [J]. Journal of the American Chemical Society,2016, 138(32): 10299-10303.
[71] TAKAMI S, KUROKI L, IRIE M. Photochromism of mixed crystals containing bisthienyl-, bisthiazolyl-, and bisoxazolylethene derivatives[J]. Journal of the American Chemical Society, 2007, 129(23): 7319-7326.
[72] ANDREW T L, TSAI H Y, MENON R. Confining light to deep subwavelength dimensions to enable optical nanopatterning [J].Science, 2009, 324(5929): 917-921.
[73] LI C, YAN H, ZHAO L X, et al. A trident dithienyletheneperylenemonoimide dyad with super fluorescence switching speed and ratio [J]. Nature Communications, 2014, 5: 5709.
[74] LI W, JIAO C, LI X, et al. Separation of photoactive conformers based on hindered diarylethenes: efficient modulation in photocyclization quantum yields [J]. Angewandte Chemie International Edition, 2014,53(18): 4603-4607.
[75] LI W, CAI Y, LI X, et al. Sterically hindered diarylethenes with a benzobis (thiadiazole) bridge: photochemical and kinetic studies [J].Journal of Materials Chemistry C, 2015, 3(33): 8665-8674.
[76] LI W, LI X, XIE Y, et al. Enantiospecific photoresponse of sterically hindered diarylethenes for chiroptical switches and photomemories [J].Scientific Reports, 2015, 5: 9186. doi: 10.1038/srep09186.
[77] 朱为宏, 孟宪乐, 张晓民, 等. 含2,1,3-苯并噻二唑单元的二噻吩乙烯类化合物: 中国, ZL200910047158.3[P]. 2009-08-05.
[78] HERDER M, SCHMIDT B M, GRUBERT L, et al. Improving the fatigue resistance of diarylethene switches [J]. Journal of the American Chemical Society, 2015, 137(7): 2738-2747.
[79] RUSSEW M M, HECHT S. Photoswitches: from molecules to materials [J]. Advanced Materials, 2010, 22(31): 3348-3360.

