一种利用体外转录制备dsRNA的方法介绍*
刘海涛 舒端阳
(1 淮南师范学院生物工程学院 安徽淮南 232038 2 广东省梅州市丰顺中学 广东梅州 514300)
RNAi(RNA interference)是由dsRNA(double strand RNA)在细胞内被切割成siRNA(small interference RNA),从而引起的同源mRNA 特异性降解,针对性地关闭某个基因的表达,为人们研究具体某个基因的功能打开一扇窗户,所以被广泛用于生物学、医学等众多领域。然而要对某个基因进行有效的沉默需要制备与此基因mRNA 同源的dsRNA,怎样才能获得此dsRNA? 目前应用比较广泛的方法有化学合成法、体外转录法、构建载体体内转录法等,本实验通过构建一个双启动子的表达载体,再体外转录制备dsRNA。
本实验以鳞翅目昆虫细胞色素c 基因片段为靶基因制备dsRNA,细胞色素c(cytochrome c,cyt c)是呼吸链中一种重要的蛋白质,正常细胞在受到凋亡因子(例如紫外线)刺激时cyt c 就会从线粒体中释放,激活caspase 家族蛋白酶,引起一系列的通讯级联,最终导致细胞凋亡。若将一个正常细胞的cyt c 的表达抑制后,用紫外线处理细胞还会发生凋亡,或者凋亡程度会不会减弱?这时即可用RNAi技术沉默cyt c 基因的表达。本实验以鳞翅目昆虫斜纹夜蛾(Spodoptera litura)的离体细胞株Sl-1 为研究材料[1],制备其cyt c 基因的一段dsRNA。
1 实验材料
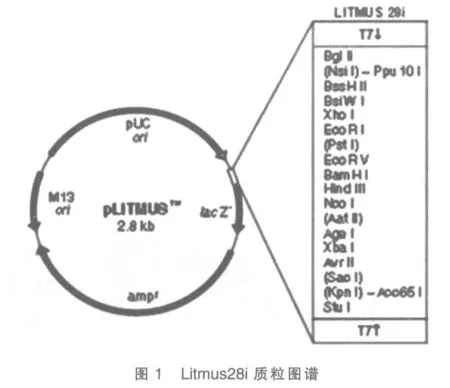
PBS缓冲液、Sl-1细胞株、提取总RNA 的Tri-zol 试剂盒、逆转录酶M-MLV、DNA 连接酶、限制酶BamH I 和EcoR I、Taq 酶、RNA聚合酶、PCR 仪、带有T7 双启动子的质粒Litmus28i(图1)、微量移液器、EP 管、培养皿、4 种核糖核苷酸(NTP)、4 种脱氧核苷酸(dNTP)、冷冻离心机、焦炭酸二乙酯(DEPC)。
2 实验方法
2.1 提取总RNA[2]
1)取1 瓶对数期细胞(细胞数量约1.5×106个),用PBS 洗涤后加入1 mL TRIzol;室温静置5 min 后移入1.5 mL 离心管中。
2)加入0.2 mL 氯仿,轻微振荡15 s,冰上静置2 min。
3)12000g/15 min,4℃离心后取上层水相,保留中间相和有机相(其中含有DNA 和蛋白质)。
4)加入0.5 mL 异丙醇,轻轻混匀,冰上静置10 min。
5)12000g/10 min,4℃离心,弃上清液。
6)加入1 mL 75%乙醇,轻轻洗涤沉淀;7 500 g/5 min,4℃离心后弃上清液。
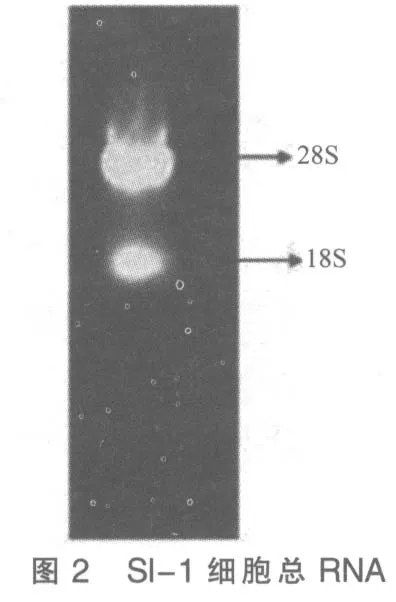
7)加入50 μL DEPC处理过的超纯水溶解沉淀后取10 μL 用于琼脂糖凝胶电泳,电泳结果显示所提取RNA样品中28S rRNA 亮度约为18S rRNA的2 倍,说明RNA 质量较好(如图2所示)。
2.2 体外转录载体的构建
1)用微量移液器取5 μL 总RNA 为模板,加入1 μL M-MLV 逆转录酶、1 mg dNTP,16℃条件下对总RNA 进行逆转录,制备cDNA。
2)以cDNA 为模板,设计cyt c 基因片段(长度为248 bp)的引物:
上游5′-GAATTCTGCCACACTGTTGAAGCCGGT3′
下游5′-GGATCCGATCTGCACGCTCGTTTGCCT3′
引物两头分别加上EcoR I 和BamH I 的酶切位点,PCR 反应(图3)。
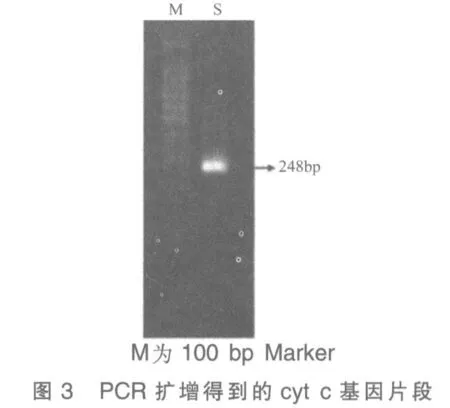
3)PCR 产物测序正确后,电泳切胶回收。
4)37℃条件下加入EcoRⅠ和BamH Ⅰ对纯化后的片段和质粒Litmus28i 同时进行酶切反应3 h。
5)分别将双酶切后的片段和质粒纯化后进行连接反应,4℃,10h 得到重组DNA 分子(图4)。
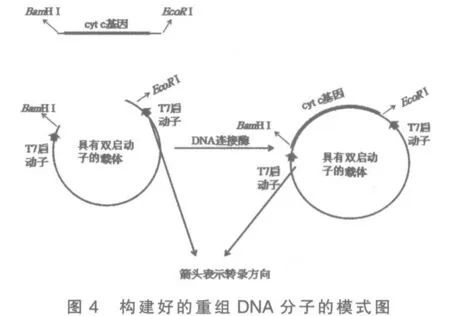
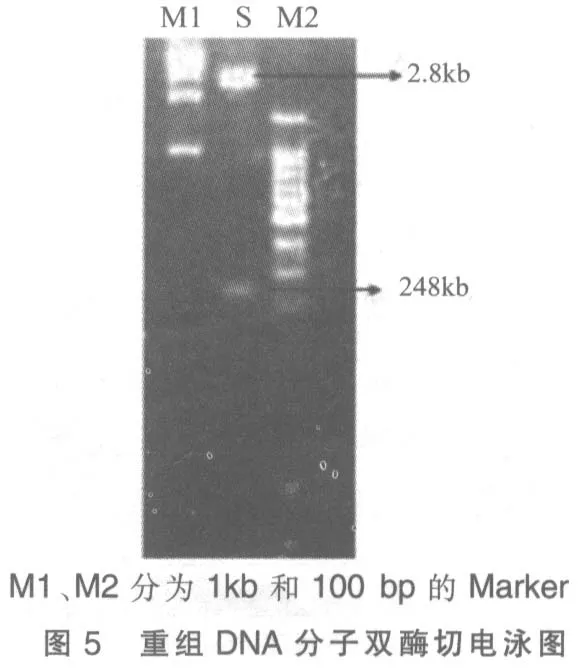
6)为保证重组DNA 分子插入正确,用EcoR Ⅰ和BamH Ⅰ同时进行双酶切验证,电泳检测插入正确(图5)。
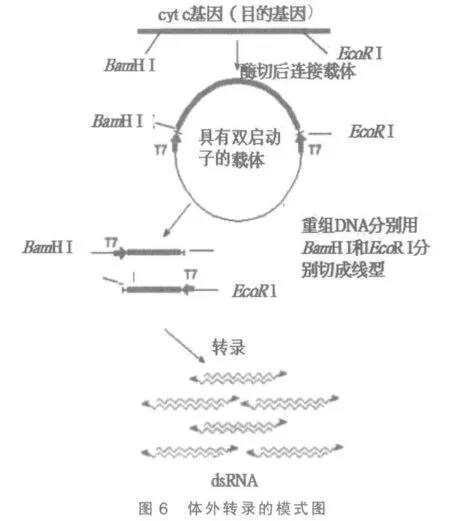
2.3 体外转录
1)将重组DNA 分子分为2 份,分别用BamHⅠ和EcoR Ⅰ进行酶切,作为体外转录模板(图6)。
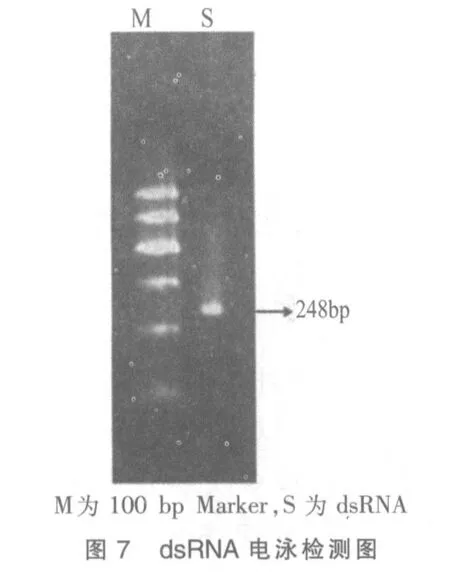
2)加入1 μL RNA 聚合酶、NTP 2 mg 及缓冲液,37℃水浴使转录持续进行4 h 后,65℃加热变性5 min 后迅速冰浴使2 种互补的单链RNA 退火形成dsRNA,电泳检测(图7)。
此时的dsRNA 序列与斜纹夜蛾cyt c 基因的一段是完全同源的,可以利用脂质体转染Sl-1 细胞,进行RNAi 的相关实验。
3 讨论及意义
体外转录实验能否成功主要取决于的限制酶选择,只有选择切口为5′-突出末端(5′-overhang)或平末端(blunt-end)限制酶才能成功进行体外转录,本实验选用的限制酶EcoR I 和BamH I 都属于5′-突出末端;若所采用的限制酶(如Pst I)切出的切口为3′-突出末端(3′-overhang),则RNA聚合酶在体外转录结束后无法与模板脱离,导致转录失败。
RNA 干扰现象广泛存在于多种生物,有效地组织外源病毒的侵染、参与机体发育、调节基因的表达等,因此研究RNAi 具有重要的意义。然而研究RNAi 的前提就是如何高效地制备相应的dsRNA。
最初研究人员是通过化学合成的方法直接合成siRNA 用于实验,这种方法最为简单,客户只要知道相应目的基因的碱基序列,生物公司就会根据其要求提供高质量的siRNA,不过价格十分昂贵,且需要在靶基因中事先筛选出一段最有效的序列再进行化学合成,因此定制周期较长。
2002年,Novina CD 等[3]开发出一种利用腺病毒感染的方法将靶基因带入受体细胞,达到了较高的转染率且能持续稳定地在细胞内转录出siRNA,因此利用病毒载体是目前唯一一种可以长期研究RNAi 的方法,而且相比于化学合成这种方法的成本低。但是病毒载体只能转染原代培养的哺乳动物细胞,对于果蝇、线虫和斑马鱼这类生物则无能为力。
然而,通过构建表达载体在体外进行转录合成dsRNA 的费用相比于化学合成法要低得多,也能较快地得到dsRNA。一旦得到靶基因的模板序列,只要48 h 就可以RNAi 实验,通常一次体外转录得到的dsRNA 可以进行上百次的RNAi 实验。利用脂质体可以将dsRNA 导入受体细胞,虽然转染效率略低于病毒载体,但是脂质体包裹着这些siRNA 可以与哺乳动物、线虫、鱼类、果蝇和各种植物的细胞发生融合,因此体外转录是目前进行RNAi 最有效的手段。

