自然河道中沉水植物苦草对水流的生理响应
张松贺,袁树东,韩 冰
(河海大学环境学院,江苏 南京 210098)
沉水植物是水生态系统中的重要组成部分[1],具有净化水体、固着悬浮颗粒物、稳定水体环境等功能[2]。在有沉水植物存在的水域,水体透明度通常明显增高,底泥营养盐的释放可以得到有效控制,水质有较明显的改善[3-7]。苦草(Vallisnerianatans)是湖泊中常见的沉水植物优势种,生命力强,在不同的底质中有广泛的适应能力,对湖泊生态系统的结构和功能起关键作用,常作为污染水体植被恢复工程的主要选用品种[8]。
水生态修复过程中仍然有许多问题需要解决,如沉水植物的分布特征与水质、水流及水位变化的影响等。水体环境对沉水植物的影响主要通过植物体内保护酶体系的响应、植物形态指标以及生物量的变化来反映[9-10]。目前关于沉水植物的研究很多,王谦等[11]总结了沉水植物在重金属水体污染修复中的应用,明确了沉水植物的作用;高海荣等[12]研究了铅对龙须眼子菜光合作用的影响。关于苦草的研究主要集中于富营养化水体中苦草的形态与生理响应。宋玉芝等[8]研究了苦草对富营养化水体中氮磷营养盐的生理响应;王永平等[13]对贫、富营养化水平湖泊中的苦草形态进行了比较;本课题组前期研究了氨氮对沉水植物的影响以及沉水植物附着微生物群落特征[14-16]。
水流是影响水体生态系统的重要因素之一。水流对水生植物的形态以及物质组成具有重要的影响[17]。在微观角度,Besemer等[18]认为水流作用有助于将营养物质和氧气输送到河床表面生物膜,影响生物膜的生长以及微生物群落的演替。Battin等[19]发现高流速水体中河床表面生物膜的厚度比低流速中的要小,低流速有利于提高生物膜生物量。目前,关于水流对沉水植物影响的研究较少。本研究以本土沉水植物苦草作为研究对象,通过野外现场试验,分析较强水流对苦草生长以及不同生长阶段的生理指标的影响。这些结果将为认识沉水植物在野外生长及繁殖情况提供试验数据,为水生生态系统的保护和持续利用提供基础资料。
1 材料和方法
1.1 实验设置
丁家山河位于江苏省南京市浦口区,上游为珍珠泉水库。珍珠泉为天然地下涌泉,水质良好,下游河道河底平整,水位落差小。在丁家山河上游河道(浦厂中学旁)选取一段作为实验区域(图1),种植苦草,种植时间为2016年6月。种植前对试验区河道进行平整,尽量保证水位及底质条件一致。在试验区域内,选取两个点位作为采样点(图1(a),1(b))。图1(a)为静水区域(流速小于2 cm/s),位于河道靠岸边位置,通过围堰使水流相对静止;图1(b)为动水区域(流速为30~40 cm/s),位于河道中部。
1.2 采样
水样以及植物样品(苦草叶片及植株)均采集自静水区和动水区两个采样点,采样时间为2016年8月、10月、12月以及2017年1月,共4次。每个采样点采集约30 g新鲜植物叶片样品,5株植株样本。采集后立即用冰袋保存,带回实验室后选取5 g样品来测定叶片相对电导率,剩余样品用液氮冷冻后放入超低温冰箱(-65℃保存),以便后续其他指标的测定。每个采样点采集约1 000 mL水样,带回实验室后4℃保存,并于24 h内完成水质指标检测。

(a) 静水区域

(b) 动水区域
1.3 测定项目及测定方法
1.3.1 水质指标测定
TN的测定采用GB11894—1989《碱性过硫酸钾消解紫外分光光度法》, TP的测定采用GB1183—1989《钼酸铵分光光度法》。
1.3.2 苦草生长指标的测定
叶长、叶宽的测定:将苦草植株采回后用水洗净,分别统计植株的叶长、叶宽,并进行数据分析。
附着生物量测定:将采集的植株放入500 mL聚氯乙烯瓶中,加入300 mL酒精,以180 r/min 震荡30 min,超声3 s之后,再以180 r/min 震荡30 min。弃去植物,将洗脱液以8 000 r/min离心10 min,弃去上清液后称重。
1.3.3 苦草叶绿素含量比测定
叶绿素含量测定采用95%乙醇-丙酮提取法[18],分别于665、643 nm波长下测定吸光度值,叶绿素a、叶绿素b和叶绿素的总含量计算公式分别为
Ca=12.7A663 nm-2.69A645 nm
(1)
Cb=22.9A645 nm-4.68A663 nm
(2)
C=Ca+Cb
(3)
式中:Ca为叶绿素a含量;Cb为叶绿素b含量;C为叶绿素总含量;A645 nm为645 nm波长下吸光度;A663nm为663 nm波长下吸光度。
1.3.4 苦草生理指标测定
相对电导率R的测定:取大小相当的植物叶片,用自来水洗净后再用蒸馏水冲洗3次,用滤纸吸干表面水分,将叶片剪成适宜长度的长条,快速称取鲜样3份,每份0.1 g,分别置于10 mL去离子水的刻度试管中,盖上玻璃塞置于室温下浸泡处理12 h,用电导仪(YSI EC300,美国)测定浸提液电导率(R1),然后沸水浴加热30 min,冷却至室温后摇匀,再次测定浸提液电导率(R2)。R=R1/R2×100%。
丙二醛(MDA)采用TBA法[21]测定,过氧化氢(H2O2)采用比色法测定,超氧化物歧化酶(SOD)采用羟胺法测定,过氧化氢酶(CAT)采用钼酸铵法测定[20],可溶性糖采用蒽酮比色法测定,可溶性蛋白采用考马斯亮蓝法[21]测定。将保存于超低温冰箱中的新鲜植物叶片取出,用自来水冲洗干净,然后用去离子水冲洗3次,再用滤纸将叶片表面的水分吸干。称取1 g苦草叶片,按1∶9的比例加入磷酸缓冲盐溶液(phosphate buffer saline,PBS),用匀浆器研磨成匀浆液。分别使用MDA、H2O2、SOD、CAT、可溶性蛋白和可溶性糖试剂盒测定相关生理指标。实验方法参考说明书,试剂盒购买于南京建成生物工程研究所(中国,南京)。
1.4 数据分析
所有数据的计算和处理使用Excel 2013,图形的绘制和处理在Excel 2013中完成。用SPSS19.0软件进行统计分析。
2 结 果
2.1 水质及苦草生长指标变化
根据GB3838—2002《地表水环境质量标准》,本研究区域内水质为V类水,且水质比较稳定(表1)。TN质量浓度保持在1.6~1.8 mg/L之间,TP质量浓度保持在0.020~0.035 mg/L之间,水体温度随季节变化较大,8月时最高,1月时最低。水体电导率、pH、DO无明显变化。且静水区与动水区相比较,在同一时期TN、TP、温度、pH、DO等水质指标均无明显差异。静水区流速常年处于0~2 cm/s,动水区流速大于30 cm/s。水位常年处于30~40 cm,由于暴雨原因,8—10月多次水位升高至60 cm,2~3 d后水位下降,水位下降后植物状态正常。
苦草的叶片长度在8月和10月有显著性差异(P<0.05),在水流中叶片长度较短,随着生长期的变化,叶片长度趋于一致(图2(a))。与静水区中苦草叶片相比,动水区苦草叶片在10月、12月时显著较窄(P<0.05),为静水区的90%~95%。苦草生物量在不同条件下有显著差异,静水区中苦草生物量更高。苦草刚种植时表面无生物膜,随着时间变化,两种水流条件下苦草叶片表面附着生物膜量有显著差异(P<0.05),静水区叶片表面更容易附着生物膜。
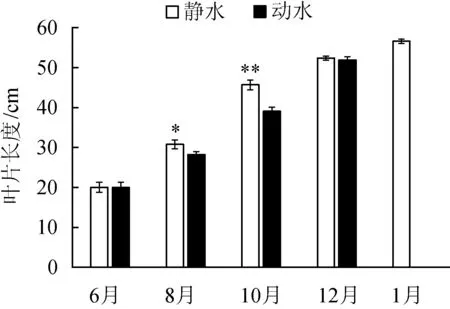
(a) 叶片长度

(b) 叶片宽度
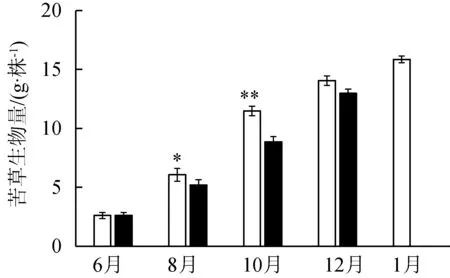
(c) 苦草生物量
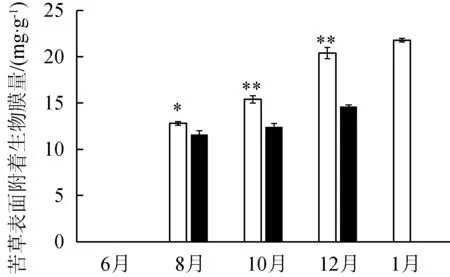
(d) 苦草表面附着生物膜量

表1 两种流速状态下水质指标与流速分布
2.2 叶绿素及过氧化氢(H2O2)含量变化
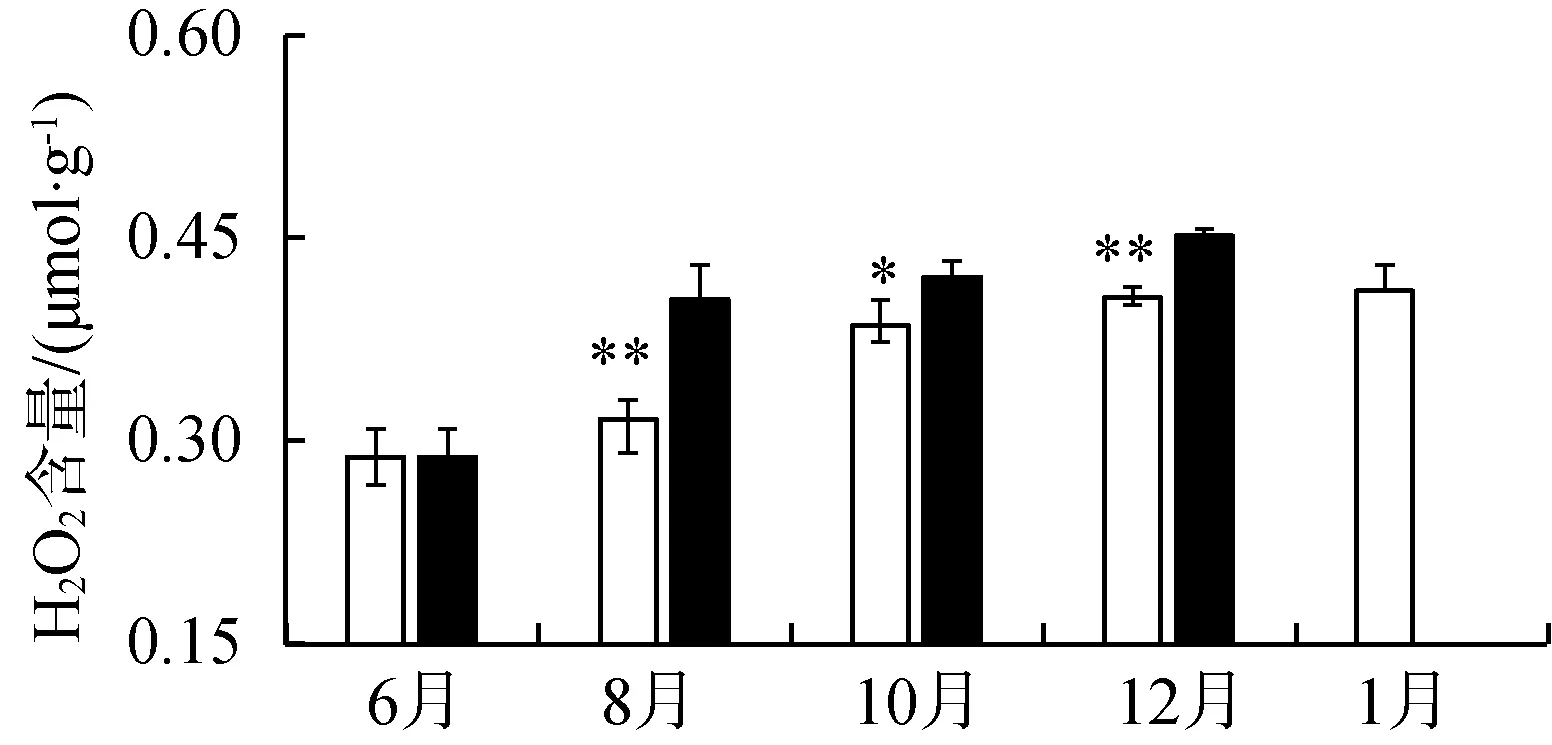
如图3所示,静水区苦草叶片叶绿素总含量8—10月升高,10月后降低,与动水区苦草叶片叶绿素总含量变化趋势一致。调查期间,动水区苦草叶片叶绿素总含量低于静水区苦草的苦草叶片叶绿素总含量(P<0.05,图3(a))。动水区苦草叶片过氧化氢(H2O2)含量显著高于静水区的苦草叶片过氧化氢含量(P<0.05,图3(b))。
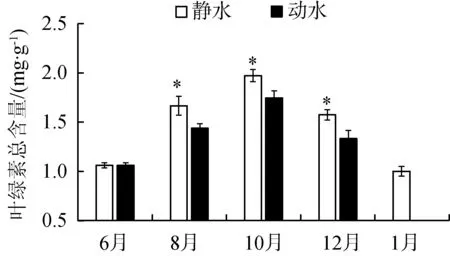
(a) 叶绿素
(b) H2O2
2.3 苦草叶片可溶性蛋白及可溶性糖变化
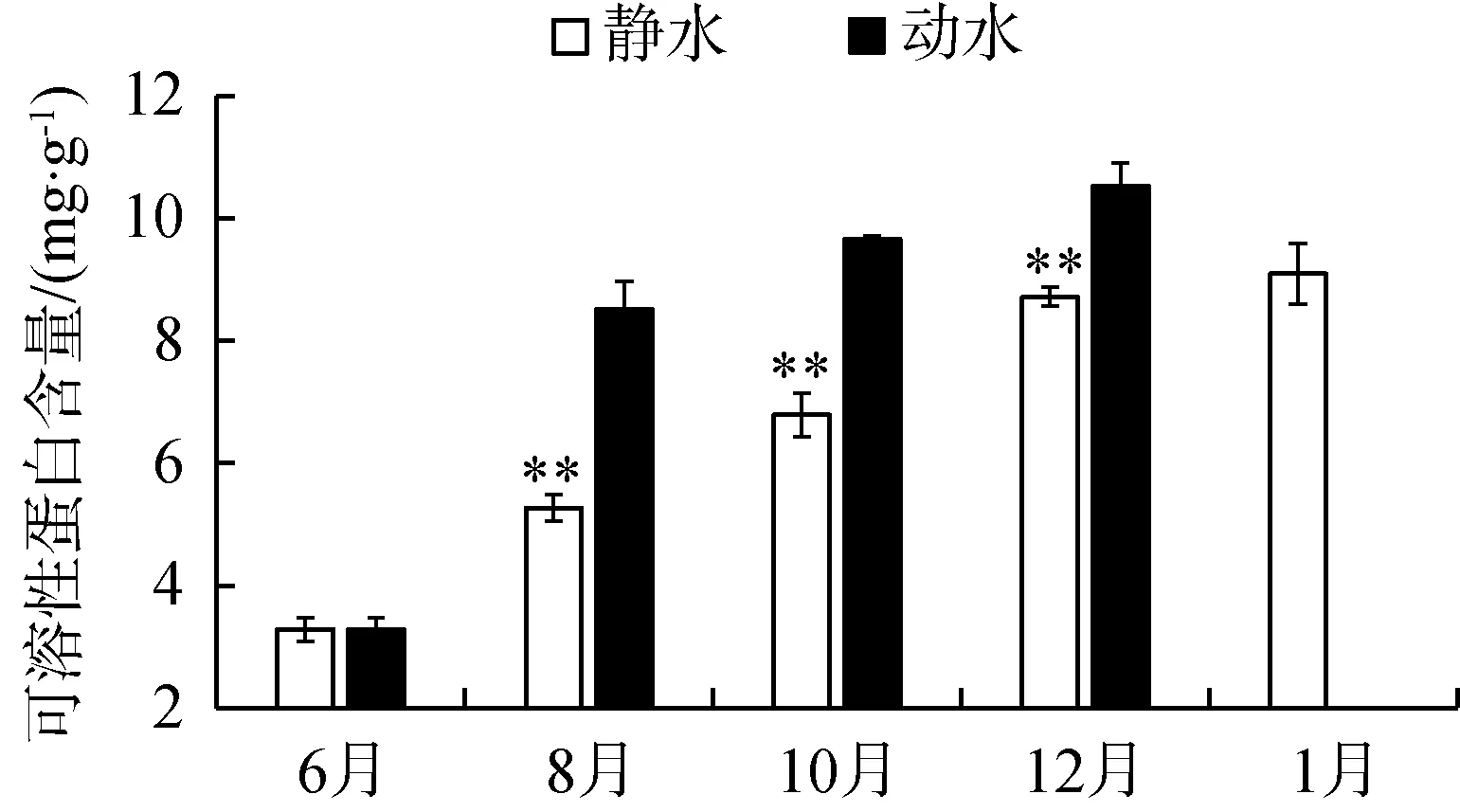
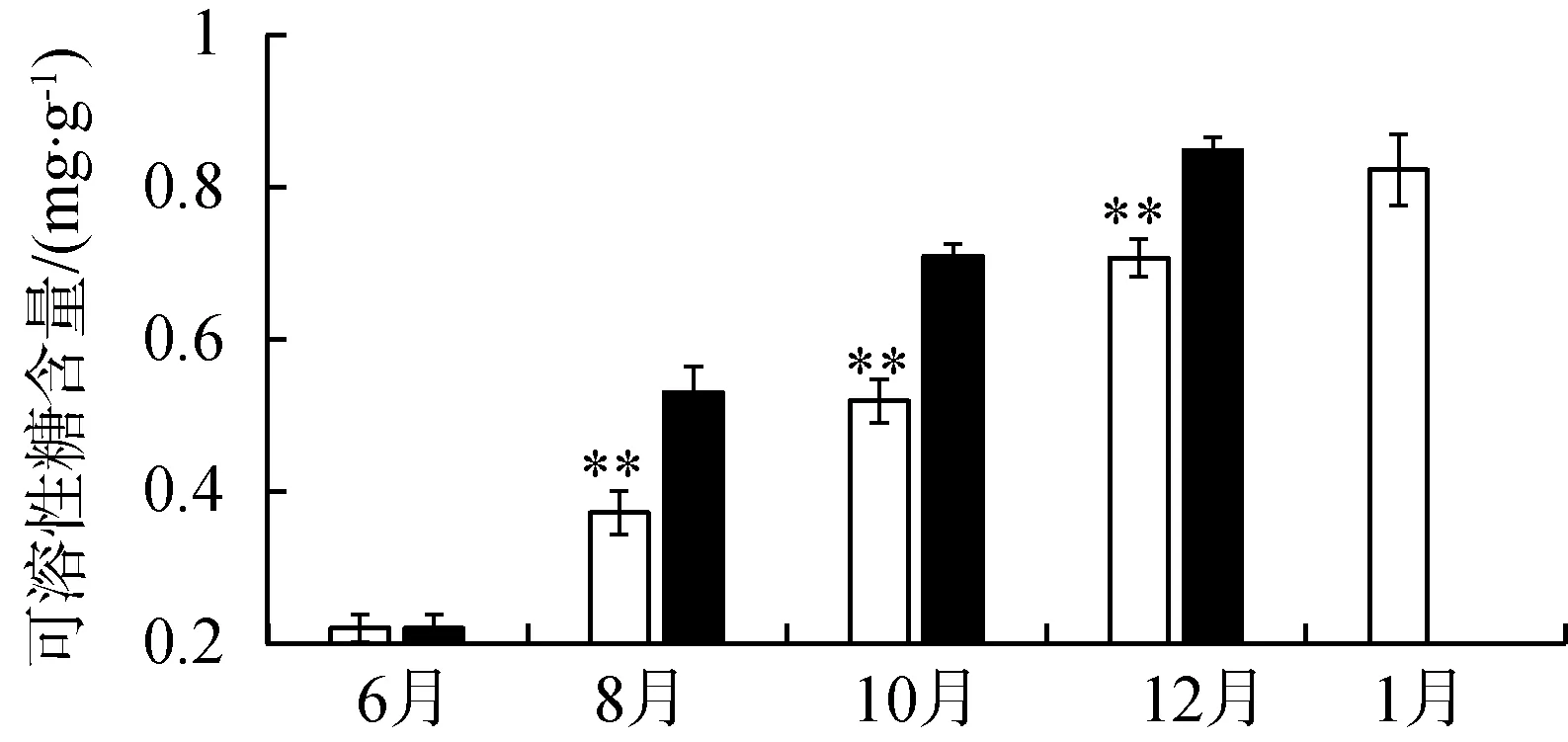
苦草叶片在不同水流条件下可溶性蛋白质含量变化趋势相似,试验后都逐渐上升。生长在静水区中的苦草,其叶片可溶性蛋白含量显著低于动水区的叶片可溶性蛋白含量(P<0.01),表明水流影响植物叶片蛋白质的合成(图4(a))。如图4(b)所示,可溶性还原糖在两种水流条件下皆持续升高,表明两种还原糖的产生与季节有相应的联系。同时水流对可溶性糖的合成有影响,静水区中苦草叶片可溶性糖含量显著低于动水区中苦草叶片可溶性糖含量(P<0.01)。
2.4 叶片相对电导率、MDA以及抗氧化酶活性变化
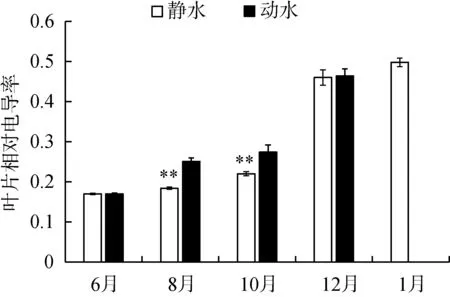
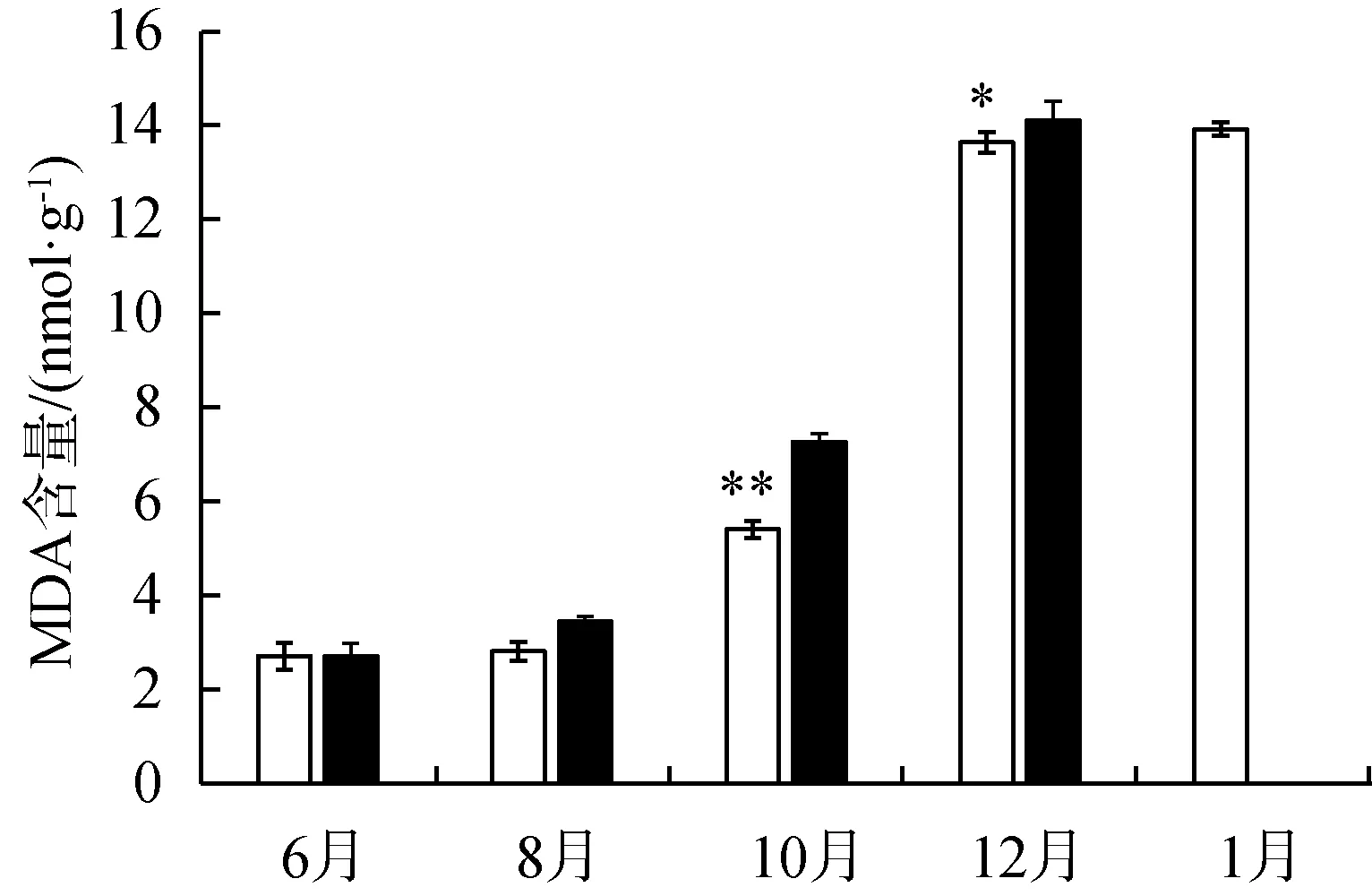
在静水区和动水区,苦草相对电导率变化趋势相同,随着时间的变化相对电导率逐渐升高。8月和10月,动水区中苦草叶片的相对电导率显著高于静水区(P<0.01)(图5(a))。随着时间的变化,
(a) 可溶性蛋白
(b) 可溶性糖
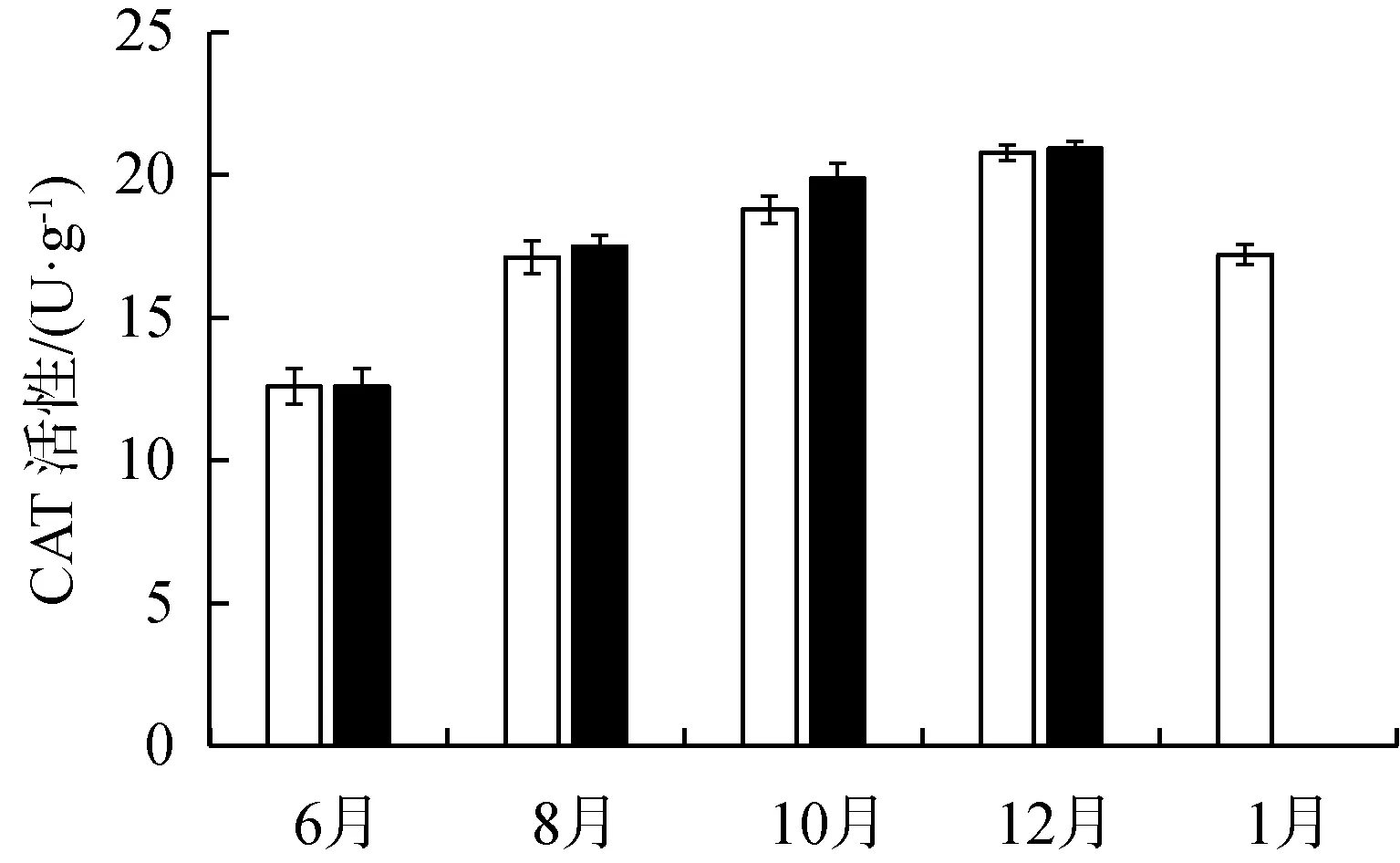
MDA的含量逐月升高,到12月时最高。10月和12月,动水区中苦草叶片MDA含量显著高于静水区中苦草叶片MDA含量(P<0.05)(图5(b))。在同一取样时间,动水中苦草叶片的SOD活性显著高于静水中的苦草叶片的SOD活性(P<0.01)(图5(c))。两种试验条件下植物叶片内CAT活性变化差异不显著(P>0.05)。两组试验条件下苦草叶片的CAT活性随时间有所增高(图5(d))。
3 讨 论
丁家山河的水源为珍珠泉,河道淤积较浅,水流和水质稳定,无明显污染源。在采取人工措施尽量保障动水与静水区域底泥性质、水质、水深、光照和温度等保持一致性前提下,利用单因素实验分析水流流速对对沉水植物的影响。与静水条件相比,动水条件下的植株叶片更加纤细,植株长度变短,说明苦草会调整自身形态以适应水流。苦草生长前期的叶片长度在静水中更长。这些形态的变化可能与水体流动对植物产生的剪切作用力有关,水流作用下植物形态会做出相应改变,产生明显的挠曲变形[24]。Zhu等[25]研究发现更短生物膜又称附着的体长有利于应对水流的冲击作用。随着时间变化,动水中的苦草的生长最终与静水中的趋于一致,表明水流会影响苦草的生长速率,但不影响最终长度。
(a) 相对电导率
(b) MDA

(c) SOD
(d) CAT
微生物,是由多种不同功能的微生物自身产生的胞外聚合物包围而形成,且附着在固体介质表面、具有代谢活性的群落[26]。沉水植物及其表面附着生物膜是水体自净体系的重要组成部分,在污染物质转化及维持生态平衡方面起到重要作用。Pang等[27]研究了沉水植物表面生物膜对氮的响应,表明生物膜能有效去除氨氮。本研究中,生长在静水区的苦草表面附着生物膜量明显比动水区中的高,表明静水区有利于生物膜的形成。但是,沉水植物叶片表面附着生物膜的过量生长会影响植物的光合作用[28],因此适当的流速对水体修复有重要意义。2017年1月,静水中的植物叶片生长有所衰老但尚无绿叶存在,而动水中的苦草此时已经完全腐败。这可能是因为动水区的沉水植物在受低温和水流的双重作用下加速腐败。
叶绿素是反映光合效率的重要指标[29]。在研究期间,静水条件下苦草叶绿素的含量普遍比动水条件下的高。黄婉媚等[30]研究发现,全缘马尾藻孢子体叶绿素a含量与水流速率密切相关,当水流速度在1~4 cm/s之间时叶绿素的含量最高,流速在低于1 cm/s或高于8 cm/s时叶绿素含量较少。Madsen等[31]研究发现,当水体流速从10 cm/s增加至86 cm/s时,多种沉水植物的净光合作用率均呈现显著下降趋势。在时间尺度上,进入12月以后植物进入衰败期,因此叶绿素的水平大幅度降低,表明光合能力降低。本研究发现当前水流促进了苦草的可溶性蛋白和可溶性糖合成。植物体内的可溶性蛋白包含多种重要代谢相关酶类,常用于指示植物体总代谢变化[32]。可溶性糖含量通常用来指示植物体内的碳素营养状况。为适应逆境条件,植物会主动积累一些可溶性还原糖,降低渗透势,以适应外界环境的变化[33]。总体来讲,水流抑制了苦草光合作用,降低了苦草的生物量,但促进了可溶性蛋白和可溶性糖含量以提高对外界胁迫的适应能力。
MDA是细胞原生质膜中的不饱和脂肪酸发生过氧化的产物,其含量常用来反映逆境或衰老过程中膜脂的破坏程度[33]。MDA含量变高,细胞膜的选择透性降低,细胞内电解质外渗量增加,膜损伤会导致相对电导率发生变化[34]。水流条件下植物体内MDA和相对电导率增加,说明植物受到伤害。动水条件下,水流是水体的主要运动方式[35],水体的快速流动会裹挟泥沙,对沉水植物叶片的损伤较大,同时水流的剪切力也会损伤细胞[36]。因此相对于静水,处在动水中的植物细胞膜损伤更加严重,叶片相对电导率上升。在时间梯度上,温度的降低使苦草受到环境胁迫以及衰老导致叶片破损加重,相对电导率逐月升高。
在逆境条件下,植物体内的活性氧代谢平衡被打破,产生多种活性氧物质,如H2O2,积累到一定程度之后会损伤细胞从而影响到植物的生长。SOD和CAT是植物抗氧化系统中的主要酶。在多种酶的共同作用下,共同维持活性氧在较低水平[37-39]。本研究中,苦草的CAT和SOD活性在动水中更高,表明水流的作用使叶片产生胁迫,打破了原有的代谢平衡,过量的活性氧如H2O2诱导了这些酶类的合成。处于静水区的植物由于生长不受胁迫,因此8—10月SOD活性提高不明显,12月份以后受温度胁迫明显,SOD活性显著提高。
总体上来讲,与静水区的苦草相比,本研究条件下水流降低了植物的叶绿素含量,这与植物形态变化相一致,说明植物光合系统受到抑制进而对生物合成产生了显著影响。另外,植物体内H2O2含量增加,说明水流诱导了植物体内活性氧合成。活性氧是植物体内的一种强氧化物质,过量的活性氧产生会导致核酸、蛋白和生物膜受损,进而影响植物的生长。本研究发现植物的MDA含量和电导率增加,进一步表明植物受到了胁迫。然而,在长期进化过程中,植物体内也形成了一套应对外界胁迫的机制。本研究发现水流条件下植物叶片可溶性还原糖和可溶性蛋白含量增加。可溶性糖的增加可以提高细胞内渗透压,降低低温胁迫及防止细胞溶质泄漏,进而对植物细胞起到一定保护作用。SOD的活性显著增加,说明水流诱导植物细胞积极合成了此类蛋白,这与可溶性蛋白含量的增加相一致。由于受到水流胁迫,苦草体内的活性氧代谢平衡被打破,活性氧物质含量升高,引起SOD的活性升高,将过量的活性氧转化成H2O2。H2O2可以在CAT酶的作用下分解成水和氧气。这些物质含量的增加,表明植物抗逆性的增加也会消耗大量的能量用于合成相关物质,进而对植物生长产生负面影响。然而,从总体来讲,水流对苦草生长有一定的影响,但在当前水流条件下并不影响其在河流生态修复中的应用。
4 结 论
30~40 cm/s的水流速度会影响苦草生长,同时对植株形态和表面附着生物膜产生影响。在植物生长期间,动水对植物叶片的可溶性蛋白和可溶性糖的合成有促进作用。水流的胁迫作用诱导H2O2等活性氧上升,使得SOD、CAT等抗氧化酶活性随之提高,以降低活性氧带来的伤害。总体来讲,动水、静水条件下沉水植物的生物量最终趋向一致,说明当前流速对苦草生长有一定的影响,但不影响其在河道生态修复中的应用。该结果通过植物生理指标与水流间的响应关系,可以更好地掌握沉水植物生长的适宜流速,这对苦草等沉水植物生态修复实践中水流的调控具有重要的指导意义。由于沉水植物类型较多,植物的根系和植株结构形态差异对水流的响应会有较大差异,在实际河道修复过程中应充分考虑水流流速对这些植物生长的影响。与植物的生理指标(如过氧化氢和酶类型)相比,植物的形态指标、叶绿素含量和叶片细胞电导率等指标相对容易分析,在实践过程中对快速判断植物健康状况具有重要意义。
参考文献:
[1]SACHSE R,PETZOLDT T,BLUMSTOCK M,et al.Extending one-dimensional models for deep lakes to simulate the impact of submerged macrophytes on water quality[J].Environmental Modelling and Software,2014,61(C):410-423.
[2]HILT S,KÖHLER J,KOZERSKI HP,et al.Abrupt regime shifts in space and time along rivers and connected lake systems[J].Oikos,2011,120(5):766-775.
[3]刘凯辉,张松贺,吕小央,等.南京花神湖3种沉水植物表面附着微生物群落特征[J].湖泊科学,2015,27(1):103-112.(LIU Kaihui,ZHANG Songhe,LYU Xiaoyang,The characteristics of epiphytic microbes of three submerged macrophytes in Lake Huashen[J].Journal of Lake Sciences,2015,27(1):103-112.(in Chinese))
[4]吕小央,张松贺,刘凯辉,等.水生植物-生物膜体系的生态功能与互作机制研究进展[J].水资源保护,2015,31(2):20-25.(LYU Xiaoyang,ZHANG Songhe,LIU Kaihui,et al.Advances in ecological function and interaction mechanism of aquatic macrophyte-biofilm system[J].Water Resources Protection,2015,31(2):20-25.(in Chinese))
[5]吴建强,黄沈发,丁玲.水生植物水体修复机理及其影响因素[J].水资源保护,2007,23(4):18-22.(WU Jianqiang,HUANG Shenfa,DING Ling.Mechanisms of water restoration by aquatic plants and its influencing factors[J].Water Resources Protection,2007,23(4):18-22.(in Chinese))
[6]王寿兵,徐紫然,张洁.滇池高等沉水植物50年变迁状况对生态修复的启示[J].水资源保护,2016,32(6):1-5.( WANG Shoubing,XU Ziran,ZHANG Jie.Dynamic changes of higher submerged macrophytes in Dianchi Lake in recent 50 years and implication for ecological restoration[J].Water Resources Protection,2016,32(6):1-5.(in Chinese))
[7]王琪,周兴东,罗菊花,等.近30年太湖沉水植物优势种遥感监测及变化分析[J].水资源保护,2016,32(5):123-129.( WANG Qi,ZHOU Xingdong,LUO Juhua,et al.Remote sensing monitoring and analysis of dominant species of submerged vegetation in Taihu Lake over last 30 years[J].Water Resources Protection,2016,32(5):123-129.(in Chinese))
[8]宋玉芝,杨美玖,秦伯强.苦草对富营养化水体中氮磷营养盐的生理响应[J].环境科学,2011,32(9):2569-2575.(SONG Yuzhi,YANG Meijiu,QIN Boqiang.Physiological pesponse ofvallisnerianatansto nitrogen and phosphorus contents in eutrophic waterbody[J].Environmental Science,2011,32(9):2569-2575.(in Chinese))

[10]WANG Chao,ZHANG Songhe,WANG Peifang,et al.Metabolic adaptations to ammonia-induced oxidative stress in leaves of the submerged macrophyteVallisnerianatans(Lour.) Hara[J].Aquatic Toxicology,2008,87(2):88-98.
[11]王谦,成水平.大型水生植物修复重金属污染水体研究进展[J].环境科学与技术,2010,33(5):96-102.(WANG Qian,CHENG Shuiping.Review on phytoremediation of heavy metal polluted water by Macrophytes[J].Environmental Science and Technology,2010,33(5):96-102.(in Chinese))
[12]高海荣,黄振旭,卫世乾.铅对沉水植物龙须眼子菜光合作用的影响[J].信阳师范学院学报(自然科学版),2014(2):239-242.(GAO Hairong,HUANG Zhenxu,WEI Shiqian.The effect of Pb2+to the photosynthesis of aquatic macrophytepotamogetonpectinatus[J].Journal of Xinyang Normal University (Natural Science Edition),2014(2):239-242.(in Chinese))
[13]王永平,秦伯强.贫、富营养湖泊中苦草的形态解剖结构比较[J].湖泊科学,2011,23(1):56-60.(WANG Yongping,QIN Boqian.A comparison on morphology and anatomy ofvallisnerianatansfrom oligotrophic and eutrophic lakes[J].Journal of Lake Sciences,2011,23(1):56-60.(in Chinese))
[14]GONG Lixue,ZHANG Songhe,CHEN Deqiang,et al.Response of biofilms-leaves of two submerged macrophytes to high ammonium[J].Chemosphere,2018,192:152-160.
[15]ZHANG Songhe,PANG Si,WANG Peifang,et al.Responses of bacterial community structure and denitrifying bacteria in biofilm to submerged macrophytes and nitrate[J].Scientific Reports,2016,6:361-378.
[16]PANG Si,ZHANG Songhe,LYU Xiaoyang,et al.Characterization of bacterial community in biofilm and sediments of wetlands dominated by aquatic macrophytes[J].Ecological Engineering,2016,97:242-250.
[17]ELLAWALA C,ASAEDA T,KAWAMURA K.Water movement induced variations in growth regulation and metabolism of freshwater macrophytevallisneriaspiralisL.in early growth stages[J].Hydrobiologia,2013,709(1):173-182.
[18]BESEMER K,SINGER G,LIMBERGER R,et al.Biophysical controls on community succession in stream biofilms[J].Applied and Environmental Microbiology,2007,73(15):4966-4974.
[19]BATTIN T J,KAPLAN L A,DENIS N J,et al.Contributions of microbial biofilms to ecosystem processes in stream mesocosms[J].Nature,2003,426:439-442.
[20]TONG Yuxin,HE Dongxian.A photoautotrophic in vitro system for evaluating salt tolerance of soybean (GlycinemaxL.) plants[J].Journal of Tropical Agriculture,2010,48(1/2):40-44.
[21]LIU Lei,LIU Yan,CUI Jie,et al.Oxidative stress induces gastric submucosal arteriolar dysfunction in the elderly[J].World Journal of Gastroenterology,2013,19(48):9439-9446.
[22]ZHANG Yong,TANG Haoru,LUO Ya.Variation in antioxidant enzyme activities of two strawberry cultivars with short-term low temperature stress[J].World Journal of Agricultural Sciences,2008,4(4):458-462.
[23]DENG Yan,WANG Wei,YU Pingfeng,et al.Comparison of taurine,GABA,glu,and asp as scavengers of malondialdehyde in vitro and in vivo[J].Nanoscale Research Letters,2013,8(1):190.
[24]魏华,成水平,吴振斌.水文特征对水生植物的影响[J].现代农业科技,2010(7):13-16.(WEI Hua,CHENG Shuiping,WU Zhenbin.Effects of hydrological characteristics on aquatic plants[J].Modern Agricultural Sciences and Technology,2010(7):13-16.(in Chinese))
[25]ZHU Guorong,ZHANG Meng,CAO Te,et al.Associations between the morphology and biomechanical properties of submerged macrophytes:implications for its survival and distribution in Lake Erhai[J].Environmental Earth Sciences,2015,74(5):3907-3916.
[26]DAVEY M E,O’TOOLE G A.Microbial biofilms:from ecology to molecular genetics[J].Microbiology and Molecular Biology Reviews,2000,64(4):847-67.
[27]ZHANG Songhe,PANG Si,WANG Peifang,et al.Responses of bacterial community structure and denitrifying bacteria in biofilm to submerged macrophytes and nitrate[J].Scientific Reports,2016,6:36178.
[28]宋玉芝,黄瑾,秦伯强.附着生物对太湖常见的两种沉水植物快速光曲线的影响[J].湖泊科学,2010,22(6):935-940.(SONG Yuzhi,HUANG Jin,QIN Boqiang.Effects of epiphyteon the rapid light curves of two submerged macrophytes in Lake Taihu[J].Journal of Lake Sciences,2010,22(6):935-940.(in Chinese))
[29]GADALLAH M A A.Effects of cadmium and kinetin on chlorophyll content,saccharides and dry matter accumulation in sunflower plants[J].Biologia Plantarum,1995,37(2):233.
[30]黄苑媚,刘志刚,谢恩义,等.水流速率对全缘马尾藻幼孢子体生长和生理活性的影响[J].广东海洋大学学报,2014,34(6):45-50.(HUANG Yuanmei,LIU Zhigang,XIE Enyi,et al.The effects of water velocity on the growth and physiological activitiesof juvenile sporophyte ofsargassumintegerrimum[J].Journal of Guangdong Ocean University,2014,34(6):45-50.(in Chinese))
[31]MADSEN J D,CHAMBERS P A,JAMES W F,et al.The interaction between water movement,sediment dynamics and submersed macrophyte[J].Hydrobiologia,2001,444:71-84.
[32]WANG Jun,XU Qinsong,WEI Shuli,et al.Zinc accumulation and its effects on physiological dynamics and calcium distribution in submerged macrophyte,potamogetoncrispusL.[J].Acta Botanica Boreali-Occidentalia Sinica,2009,29(11):2249-2255
[33]刑雅囡,阮晓红.硫化物胁迫对马来眼子菜生理生化指标的影响[J].水资源保护,2010,26(4):46-48.(XING Yanan,RUAN Xiaohong.Effects of sulfide (S2-)on physiological and biochemical indicators ofpotamogetonmalaianus[J].Journal of Soil and Water Conservation,2010,26(4):46-48.(in Chinese))
[34]覃晓艳,林萍,马佳,等.五种水生植物对生活污水的生理响应[J].湖北农业科学,2013,52(17):4058-4062.(QIN Xiaoyan,LIN Ping,MA Jia,et al.Physiological responses of 5 kinds of hydrophytes to domestic sewage[J].Hubei Agricultural Sciences,2013,52(17):4058-4062.(in Chinese))
[35]WETZEL R G.Limnology:lake and river ecosystems[J].Eos Transactions American Geophysical Union,2001,21(2):1-9.
[36]燕文明,刘凌,赵倩维,等.小型浅水湖泊表层沉积物氨氧化古菌群落结构特征[J].河海大学学报(自然科学版),2016,44(5):449-453.(YAN Wenming,LIU Ling,ZHAO Qianwei,et al.Characteristics of community structure of AOA in surface sediments of small shallow lakes[J].Journal of Hohai University (Natural Sciences),2016,44(5):449-453.(in Chinese))
[37]郑世英,商学芳,王景平.可见分光光度法测定盐胁迫下玉米幼苗抗氧化酶活性及丙二醛含量[J].生物技术通报,2010(7):106-109.(ZHENG Shiying,SHANG Xuefang,WANG Jingping.Determination of antioxidant Enzyme activity and contents of MDA in maize seedlings under salt stress with visible spectrophotometry[J].Biotechnology Bulletin,2010(7):106-109.(in Chinese))
[38]李婉路,张光生,成小英.Cd2+、Cu2+、Zn2+、Pb2+对菹草生长胁迫影响及其应答机制[J].食品与生物技术学报,2016,35(9):1001-1007.(LI Wanlu,ZHANG Guangsheng,CHENG Xiaoying.Stress effect and response mechanism of Cd2+,Cu2+,Zn2+and Pb2+onPotamogetoncrispusL.growth[J].Journal of Food Science and Biotechnology,2016,35(9):1001-1007.(in Chinese))
[39]李轶,殷亚远,王超,等.纳米二氧化钛和铜对大型溞的联合毒性[J].河海大学学报(自然科学版),2016,44(2):95-100.(LI Yi,YIN Yayuan,WANG Chao,et al.Joint toxicity of titanium dioxide nanoparticles and copper on daphnia magna[J].Journal of Hohai University (Natural Sciences),2016,44(2):95-100.(in Chinese))
——以武汉紫阳湖为例

