酶解离心法提取鹅肥肝油工艺及其品质评价
李承颖,王宝维,,*,秦鹏飞,葛文华,张名爱,,岳斌,陈海华
(1.青岛农业大学食品科学与工程学院,山东青岛266109;2.国家水禽产业技术体系营养与饲料功能研究室,山东青岛266109)
鹅肥肝有着较多人体需要的卵磷脂、三酰甘油、不饱和脂肪酸和各类微量元素,其中人体所需不饱和脂肪酸占其总脂肪酸含量的65%~68%[1-3],可以起到降血脂、延缓衰老、软化血管的效果。鹅油中75.7%[4]为必需脂肪酸,包括无法由自身合成的亚油酸[5],与植物油相似,熔点低、易吸收,不仅与普通食用油在口感、外观等方面有相似性状[6],且具有减少体内脂肪堆积、预防高血脂等相关疾病的功能[7-8],王伟伟等[9]研究发现鹅肥肝对大鼠高脂血症具有修复作用。所以,研究鹅肥肝油的提取方法与产品性质意义非凡。当前,针对鹅油进行的研究屈指可数。张佰帅等[10]研究表明粗鹅油的最佳提取温度为60℃。侯杰等[11]采用超声波辅助法提取鹅肥肝油,最佳条件下鹅肥肝油收率为67.44%。隋明等[12]采用5种方法对鹅油进行提取,结果表明:烘箱提取法最佳工艺下所提取的鹅油无杂质、色泽佳、稳定性好、出油率较高。目前,国内外对鹅油提取方法、性质报道研究较少,传统化学提取法有溶剂残留、提取率低、时间长、操作复杂等缺点。为此,创建一种省时、低耗、低成本、低排放的鹅油提取方法迫在眉睫。本研究将酶解、离心两种技术有机结合用于鹅肥肝油的提取,酶解法是利用酶对蛋白质水解,使蛋白质不与脂肪结合,从而分离出油脂的一种提取方法,本试验利用响应面法优化工艺,旨在创建一种效率快、高品质、提油率高的新工艺,为鹅肥肝深度开发提供技术支撑。
1 材料与方法
1.1 材料与试剂
鹅肥肝:山东潍坊银河润雁鹅业有限公司;柠檬酸(分析纯):天津惠瑞化工科技有限公司;磷酸氢二钾(分析纯):天津市巴斯夫化工有限公司;酸性蛋白酶(≥50 u/mg)、中性蛋白酶(100 u/mg)、碱性蛋白酶(200 u/mg)、木瓜蛋白酶(≥800 u/mg)、菠萝蛋白酶(≥300 u/mg):上海瑞永生物科技有限公司。
1.2 仪器与设备
DS-1型高速组织捣碎机:上海标本模型厂;多参数测试仪:梅特勒-托利多仪器(上海)有限公司;H2050R型冷冻离心机:长沙高新技术产业开发区湘仪离心机仪器有限公司;SY-1000E超声波提取仪:北京弘祥隆生物技术股份有限公司;E-52AA旋转蒸发仪:上海亚荣生化仪器厂;500MHz超导核磁共振波谱仪:瑞士布鲁克公司。
1.3 方法与设计
1.3.1 酶解离心法提取鹅肥肝油
1.3.1.1 鹅肥肝匀浆液
将鹅肥肝斩拌,用组织捣碎机完全捣碎呈浆状,再用保鲜袋分装,并置于-18℃以下的冰箱或冷库内保存待用。
1.3.1.2 蛋白酶缓冲液
把蛋白酶溶于pH 3.5~8.5的0.1 mol/L~0.2 mol/L磷酸氢二钾-柠檬酸缓冲液中。
1.3.1.3 酶解
把蛋白酶缓冲液与鹅肥肝匀浆液混合,在40℃~65℃进行酶解3.5 h~5.5 h。
1.3.1.4 离心取油
把酶解液于7 500 r/min~14 500 r/min速率下离心10 min~30 min,上层清油即为鹅肥肝油。
1.3.2 鹅肥肝油提取率计算公式

1.3.3 酶解离心法提取鹅肥肝油的单因素试验设计
以鹅肥肝油提取率为考察指标,确定酶解工艺条件,分别对蛋白酶种类、缓冲液pH值、酶解温度、酶解时间、离心速率、离心时间6个影响因素进行研究,分别针对蛋白酶种类:酸性蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、菠萝蛋白酶5种类型;缓冲液pH值(6.5、7.0、7.5、8.0、8.5,5 个水平)。酶解温度(45、50、55、60、65 ℃,5 个水平);酶解时间(3.5、4、4.5、5、5.5 h,5个水平);离心速率(8 500、10 000、11 500、13 000、14 500 r/min,5 个水平);离心时间(10、15、20、25、30 min,5个水平)进行单因素试验,确定各影响因素的适宜值。
1.3.4 酶解离心法提取鹅肥肝油的响应面试验设计
根据Box-Behnken中心组合试验设计原理,以鹅肥肝油提取率为考察指标,综合单因素试验结果选择离心速率、时间、缓冲液pH值设计三因素三水平响应面试验,获得酶解离心法提取鹅肥肝油的最适工艺条件,响应面因素水平编码表如表1。

表1 响应面因素水平编码表Table 1 Factor level table of response surface
1.3.5 鹅肥肝油脂肪酸含量的测定
前处理方法:称取鹅肥肝油样品2 mg,加入1.5 mL正己烷、40 μL 乙酸乙酯、100 μL NaOCH3/CH3OH 后室温条件下甲基化20 min,静置10 min于冷冻箱,取出后迅速加入60 μL草酸,离心去沉淀,为吸附其中水分将溶液通过无水Na2SO4层。使用FID检测器、CPSi188熔融石英毛细管柱气相色谱柱进行Agilent 7890A气相色谱分析。
测定条件:进样口温度250℃,进样量1.0 μL,压力128.226 kPa,不分流。载气为氮气,柱压128.22 kPa。采用程序升温,起始温度50℃,保持此温度1 min;以25℃/min升至200℃,保持0 min;再以3℃/min升至230℃,保持6 min。FID检测器280℃,燃气为氢气、空气,流速分别为40、450 mL/min;助燃气为空气,流速为30 mL/min。
1.3.6 不同鹅肥肝油提取方法的比较
1.3.6.1 鹅肥肝油提取方法
1)酶解离心法:按照本试验中响应面所得最佳工艺条件提取鹅肥肝油。
2)溶剂浸提法:用脱脂棉包好准确称量的鹅肥肝,石油醚作为提取剂,提取时间为5 h;提取温度为35℃,利用索氏提取装置抽提,完成后将接收瓶中石油醚-油脂混合物进行旋转蒸发除去石油醚,获得鹅肥肝油。
3)超声波提取法:根据 1 ∶5(g/mL)料液比将鹅肥肝和提取剂放在超声波提取仪处理杯中并搅拌均匀,然后在超声波功率400 W、提取时间11 min、提取温度35℃下进行超声波提取[11],结束后将提取液离心取上清液过滤,再进行旋转蒸发除去提取剂,干燥得到鹅肥肝油。
1.3.6.2 鹅肥肝油的理化性质测定
酸价、过氧化值、皂化值、碘值分别参考GB 5009.229-2016《食品安全国家标准食品中酸价的测定》、GB 5009.227-2016《食品安全国家标准食品中过氧化值的测定》、GB/T 5534-2008《动植物油脂皂化值的测定》、GB/T 5532-2008《动植物油脂碘值的测定》。
1.3.6.3 鹅肥肝油的1H-NMR分析
1H-NMR分析使用500 MHz超导核磁共振波谱仪,将油脂溶解在CDCl3中进行氢谱分析。
1.3.7 数据分析
各项指标均重复3次并取均值,Excel建立数据库,SPSS 22.0进行数理统计,通过多重比较(LSD)检验各处理平均数之间的差异显著性,Design expert 7.0软件进行响应面分析。
2 结果与分析
2.1 酶解离心法提取鹅肥肝油单因素试验结果
各因素对酶解离心提取鹅肥肝油率的影响见图1。

图1 各因素对酶解离心提取鹅肥肝油率的影响Fig.1 Effect of various factors on enzymatic extraction of fatty liver oil in goose
由图(a)可知,酸性蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、菠萝蛋白酶5种蛋白酶(各种酶的最佳酶解条件下)对鹅肥肝油的提取率均高于63%,且使用碱性蛋白酶提取鹅肥肝油得率最高。因此,选择碱性蛋白酶。
由图(b)可知,随着缓冲液pH值逐渐增大,鹅肥肝油提取率先显著增加(P<0.05)后减小。当pH值为9.0时,鹅肥肝油提取率最大。这可能是因为碱性蛋白酶在pH 9.0时酶活最高,使得其与底物的结合程度最好,提取率最高。因此,最佳缓冲液pH值选择9.0。
由图(c)可知,鹅肥肝油提取率随酶解温度的增加先升高后略有下降,当温度达到60℃时,提取率最大。说明酶解温度的升高可加大酶活,使鹅肥肝中的脂类复合物更多的降解,提高提取率,但过高的温度会使酶活降低甚至失活,影响酶解反应。因此,最佳酶解温度选择60℃。
由图(d)可知,在3 h~3.5 h提取过程中,随着酶解时间的延长,鹅肥肝细胞逐渐被破坏,酶与底物充分反应,油脂提取率不断提高,在3.5 h之后,随着时间延长提取率变化不显著(P>0.05)。这可能是因为酶与底物作用时间的延长会增加酶解的充分性,当底物被酶解完全时,提取率将不再随着酶解时间的延长而显著增长[13]。因此,最佳酶解时间选择3.5 h。
由图(e)可知,加快离心速率鹅肥肝油提取率也随之提高,当离心速率达到11 500 r/min时,提取率随着离心速率的升高而趋于平稳。这可能是由于增大离心速率,利于鹅肥肝中蛋白质等大分子物质发生沉淀,使得较多油脂得以分离。因此,最佳离心速率选择11 500 r/min。
由图(f)可知,随着离心时间的延长,鹅肥肝油提取率不断提高,当离心20 min时,再延长时间提取率也处于平稳状态。这可能是因为随着时间延长大分子物质的沉淀数量也随之增加,当沉淀完全时,提取率将不再随离心时间的延长而增加。因此,最佳离心时间选择20 min。
通过单因素初步筛选得到酶解离心提取工艺的优选参数为:①蛋白酶种类为碱性蛋白酶;②缓冲液pH值为9.0;③酶解过程:酶解温度60℃、时间3.5 h;④离心过程:离心速率11 500 r/min、时间20 min。
2.2 方差分析酶解离心法提取鹅肥肝油单因素试验结果
2.2.1 蛋白酶种类对鹅肥肝油提取率的影响结果
蛋白酶种类对鹅肥肝油提取率单因素方差分析结果见表2。
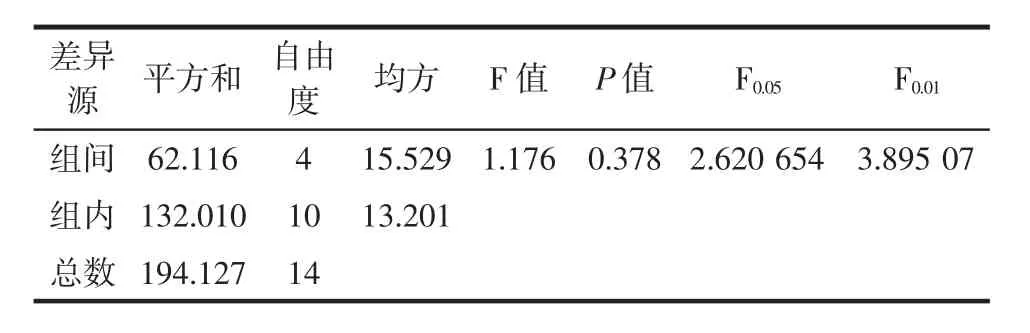
表2 蛋白酶种类对鹅肥肝油提取率的影响Table 2 Effect of protease type on extraction rate of goose liver oil
根据表2 的方差分析结果,F<F0.05,即 P>0.05,表明蛋白酶种类对鹅肥肝油提取率的影响不显著。
2.2.2 缓冲液pH值对鹅肥肝油提取率的影响结果
缓冲液pH值对鹅肥肝油提取率单因素方差分析结果见表3。

表3 缓冲液pH值对鹅肥肝油提取率单因素方差分析Table 3 Single factor analysis of variance in extraction rate of goose liver oil by buffer pH
根据表3 的方差分析结果,F>F0.01,即 P<0.01,表明缓冲液pH值对鹅肥肝油提取率的影响极显著。为了比较各水平间影响的差异程度,进行(LSD)检验,结果见表4。

表4 Fisher LSD多重比较结果Table 4 Fisher LSD multiple comparison results
根据表4多重比较结果,缓冲液pH 7.5和9.0、9.5之间以及pH 8.0和9.0之间对鹅肥肝油提取率的影响差异极显著;pH 8.0和9.5之间以及pH 8.5和9.0之间对鹅肥肝油提取率的影响差异显著。
2.2.3 酶解温度对鹅肥肝油提取率的影响结果
酶解温度对鹅肥肝油提取率单因素方差分析结果见表5。
根据表5 的方差分析结果,F<F0.05,即 P>0.05,表明酶解温度对鹅肥肝油提取率的影响不显著。
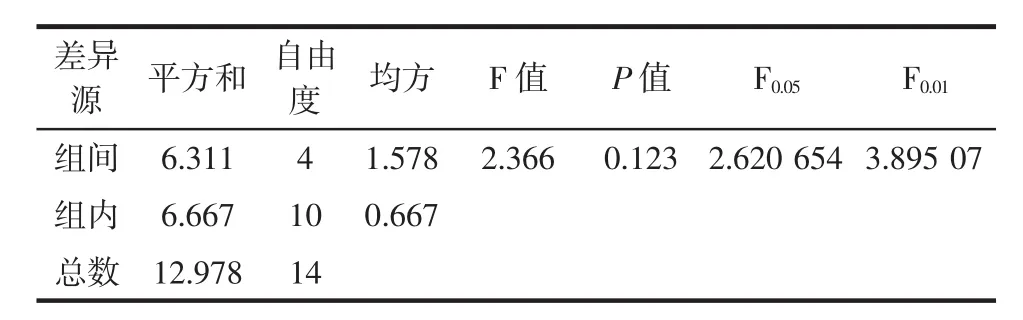
表5 酶解温度对鹅肥肝油提取率单因素方差分析Table 5 Single factor analysis of variance in extraction rate of goose liver oil by enzymolysis temperature
2.2.4 酶解时间对鹅肥肝油提取率的影响结果
酶解时间对鹅肥肝油提取率单因素方差分析结果见表6。

表6 酶解时间对鹅肥肝油提取率单因素方差分析Table 6 Single factor analysis of variance in extraction rate of goose liver oil by enzymolysis time
根据表6 的方差分析结果,F<F0.05,即 P>0.05,表明酶解时间对鹅肥肝油提取率的影响不显著。
2.2.5 离心速率对鹅肥肝油提取率的影响结果
离心速率对鹅肥肝油提取率单因素方差分析结果见表7。

表7 离心速率对鹅肥肝油提取率单因素方差分析Table 7 Single factor analysis of variance in extraction rate of goose liver oil by centrifugal speed rate
根据表7 的方差分析结果,F>F0.01,即 P<0.01,表明离心速率对鹅肥肝油提取率的影响极显著。为了比较各水平之间影响的差异程度,进行LSD检验,结果见表8。

表8 Fisher LSD多重比较结果Table 8 Fisher LSD multiple comparison results
根据表8多重比较结果,离心速率8 500 r/min和 10 000 r/min之间、10 000 r/min和 11 500 r/min、10000r/min和 13 000 r/min、10 000 r/min和 14 500 r/min之间对鹅肥肝油提取率的影响差异显著;离心速率8 500 r/min和 11 500 r/min、8 500 r/min和 13 000 r/min、8 500 r/min和14 500 r/min之间对鹅肥肝油提取率的影响差异极显著。
2.2.6 离心时间对鹅肥肝油提取率的影响结果
离心时间对鹅肥肝油提取率单因素方差分析结果见表9。

表9 离心时间对鹅肥肝油提取率单因素方差分析速率Table 9 Single factor analysis of variance in extraction rate of goose liver oil by centrifugal time
根据表9 的方差分析结果,F0.05<F<F0.01,即 0.01<P<0.05,表明离心速率对鹅肥肝油提取率的影响显著。为了比较各水平之间影响的差异程度,进行(LSD)检验,结果见表10。

表10 Fisher LSD多重比较结果Table 10 Fisher LSD multiple comparison results
根据表10多重比较结果,离心时间10 min和30 min之间对鹅肥肝油提取率的影响差异极显著;离心时间15 min和30 min之间对鹅肥肝油提取率的影响差异显著。
2.3 酶解离心法提取鹅肥肝油响应面试验结果
2.3.1 响应面试验结果
响应面试验结果见表11。

表11 响应面试验设计及其结果Table 11 Response surface test design and its results

续表11 响应面试验设计及其结果Continue table 11 Response surface test design and its results
2.3.2 响应面回归模型的建立与分析
以离心时间、速率、pH值为影响因素,鹅肥肝油提取率为响应值的线性回归方程如下:Y=53.76+1.59A+5.60B+2.66C+1.59AB-0.29AC+3.30BC-1.08A2-6.54B2-2.28C2。
2.3.3 方差分析响应面试验结果
以上响应面试验回归方程的方差分析结果见表12。

表12 响应面试验回归方程方差分析Table 12 Response surface test regression equation variance analysis
由表可知,方差分析模型Pr(P)>F值<0.01时模型极显著,拟合精度好意味着可使用该响应面近似模型做近一步优化设计;失拟项Pr>F值>0.05意味着不显著,换言之此模型在被研究的整个回归区域内拟合较好。
一次项对试验影响排序为B>C>A,即离心时间>缓冲液pH值>离心速率,其中离心时间对试验影响极显著(P<0.01),缓冲液pH值和离心速率对试验影响显著(P<0.05)。交互项中AB和BC显著性较好,说明离心速率和离心时间,离心时间和缓冲液pH值的相互作用对鹅肥肝油的提取率影响较大。
经Design-Expert软件分析,酶解离心提取工艺的优选参数为:蛋白酶种类为碱性蛋白酶;缓冲液pH值为8.5;酶解温度60℃、时间3.5 h;离心速率14 500 r/min、时间30 min。此条件下,鹅肥肝油提取率为58.57%,按照GB 5009.6-2016《食品安全国家标准食品中脂肪的测定》中酸水解法测定鹅肥肝中总脂肪,其占比为59.01%,即鹅肥肝油实际提取率为99.25%。
2.3.4 响应面试验的响应曲面和等高线图
利用二次方程模型分别做出试验因素间交互作用的三维立体响应曲面和等高线图,分析某个因素固定在中心值不变情况下,其他两个因素的交互作用对鹅肥肝油提取率的影响(见图2~图4),等高线形状为椭圆形表示因素的交互作用显著,圆形则表示交互作用不显著。

图2 离心速率和离心时间对鹅肥肝油提取率的交互影响Fig.2 Interaction of centrifugal rate and centrifugal time on extraction rate of goose fat liver oil

图3 离心速率和缓冲液pH值对鹅肥肝油提取率的交互影响Fig.3 Effects of centrifugation rate and buffer pH on the extraction rate of goose fat liver oil

图4 离心时间和缓冲液pH值对鹅肥肝油提取率的交互影响Fig.4 Effect of centrifugal time and buffer pH on the extraction rate of goose fat liver oil
从图2等高线图可以看出,在缓冲液pH值不变条件下,离心速率与离心时间交互作用显著。从三维立体图中看出,鹅肥肝油提取率在合适的离心速率和离心时间下,具有最大值,该极大值出现在较高的离心速率(13 625 r/min~14 500 r/min)范围内,较高的离心时间(25 min~30 min)范围内。
从图3等高线图可以看出,在离心时间不变条件下,离心速率与缓冲液pH值交互作用显著,从三维立体图中看出,增大离心速率与缓冲液pH值有助于提高鹅肥肝油提取率,鹅肥肝油提取率存在极大点,该极点出现在较高的离心速率(13 625 r/min~14 500 r/min)范围内,较高的缓冲液pH(8.00~8.50)范围内。
从图4等高线图可以看出,离心速率不变的情况下,离心时间与缓冲液pH值两者交互作用显著。由三维立体图可见,鹅肥肝油提取率存在极大点,离心时间在25 min至30 min范围内、缓冲液pH值从8.00提高至8.50时,鹅肥肝油提取率增加。
2.4 鹅肥肝油中脂肪酸含量测定结果
标准品脂肪酸图见图5,鹅肥肝油脂脂肪酸图见图6,鹅肥肝油中脂肪酸成分见表13。

图5 标准品脂肪酸图Fig.5 Standard fatty acid diagram

图6 鹅肥肝油脂脂肪酸图Fig.6 Fatty acid diagram of goose liver fatty acid
由图5、图6和表13得出,鹅肥肝油不饱和脂肪酸居多,高于71%,其中肉豆蔻酸(C14:0)0.83%、亚油酸(C18:2)1.50%、棕榈烯酸(C16:1)4.25%、棕榈酸(C16:0)25.08%、油酸(C18:1)56.28%;饱和脂肪酸以11.78%的硬脂酸为主。

表13 鹅肥肝油中脂肪酸成分Table 13 Fatty acid composition in goose liver oil
2.5 不同鹅肥肝油提取方法的比较
2.5.1 鹅肥肝油的理化性质比较
不同的提取方法对鹅肥肝油的理化性质存在着影响,鹅肥肝油中脂肪酸成分见表14。
从表14中可以看出,提取的鹅肥肝油酸价、过氧化值、皂化值以及碘值的大小顺序为:溶剂浸提法>超声波提取法>酶解离心提取法。这可能是由于溶剂浸提法和超声波法均需较长时间高温浸提回流,使所获得的鹅肥肝油发生了氧化。由此得出,酶解离心法提油条件温和,未经长时间有机溶剂处理,较完整保留了鹅肥肝油本身天然活性成分,并在保证油脂安全性的同时获得更高的品质。

表14 鹅肥肝油中脂肪酸成分Table 14 Fatty acid composition in goose liver oil
2.5.2 鹅肥肝油的1H-NMR的比较结果与分析
鹅肥肝油1H-NMR波谱中各信号峰的归属见表15,不同方法提取鹅肥肝油的核磁共振氢谱分析见表16,鹅肥肝油的核磁共振氢谱见图7。

表15 鹅肥肝油1H-NMR波谱中各信号峰的归属Table 15 The signal peak of goose liver oil1H-NMR spectroscopy in attribution
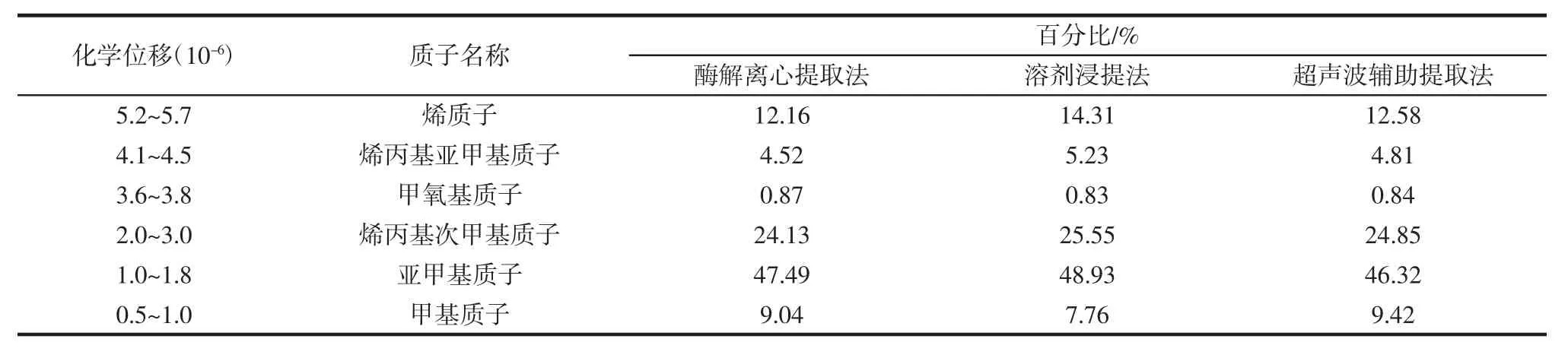
表16 不同方法提取鹅肥肝油的核磁共振氢谱分析Table 16 Nuclear magnetic resonance spectroscopy analysis of goose liver oil by different methods
由图(a)表明,在 0~5.5(1/106)处出现了 9 个信号峰,图(b)和(c)中出现了 10个信号峰,7.26×10-6处为氘代氯仿的溶剂峰,这些信号峰主要由鹅肥肝油中的甘油三酯的不同结构中的H质子产生,其峰值的高低与相应化学环境下H质子的含量有关。油脂在热氧化过程中产生诸如醛类化合物、过氧化物、芳香烃等氧化产物直接影响了信号峰的高低。
在溶剂浸提法和超声波提取法的高温提取过程中,由于所提鹅肥肝油发生了热氧化反应,结果显示:烯族类(不饱和双键)、二烯丙基、烯丙基的信号峰幅值比酶解离心法低;饱和脂肪酸所连的甲基峰值比酶解离心法高;油脂中烯质子、烯丙基亚甲基质子和烯丙基次甲基质子的百分含量的顺序为溶剂浸提>超声波提取>酶解离心;并且随着油脂氧化程度的加剧,脂肪酸组成也发生了一定变化。表明,酶解离心法提取工艺未经过高温浸提,有效避免了所提取的鹅肥肝油发生热氧化反应,所提取的鹅肥肝油质量更优。

图7 鹅肥肝油的核磁共振氢谱Fig.7 Nuclear magnetic resonance spectroscopy of goose fat liver oil
3 讨论
3.1 蛋白酶种类对酶解离心提取鹅肥肝油的影响
黄万有等[14]研究了胰蛋白酶、碱性蛋白酶、中性蛋白酶、木瓜蛋白酶4种蛋白酶对军曹鱼内脏鱼油提取的影响,胰蛋白酶作用下提取率高于其他酶的作用,胰蛋白酶属于中性蛋白酶,但价格较贵。此外各种蛋白酶都有用于提取其他动物油脂的研究报道,且根据原料的不同所采用的蛋白酶各有差异,油脂的提取率也不同。本文考虑到成本、工艺条件及操作难易程度,选用碱性蛋白酶进行提取研究。
3.2 酶解温度对酶解离心提取鹅肥肝油的影响
酶是特定的蛋白质,温度过高,会使得酶失活而使反应不能正常进行;温度过低会导致酶活降低,酶解反应不充分,因此只有在特定温度下,才能保持其最佳活性。华娣[15]采用水酶法从花生中提取油和水解蛋白进行了研究,结果表明,确定的碱性蛋白酶最佳酶解温度为60℃,与本试验酶解温度单因素筛选结果一致。但范东方[16]以油莎豆为原料,对水酶法提取油莎豆油进行工艺优化研究时,碱性蛋白酶最佳酶解温度为50℃。由此得出,蛋白酶最佳反应温度的不同,可能与结合的底物种类有关。
3.3 不同鹅肥肝油提取方法效果比较
侯杰等[11]使用石油醚对鹅肥肝油进行超声波提取,最优提取率为67.44%;使用传统的溶剂法提取率为99.05%;本研究使用碱性蛋白酶进行酶解提油,获得99.25%的提取率,高于前两种提取方法,且以酶解离心法所获得的鹅肥肝油品质最好。
本研究结果显示,溶剂浸提法获得的鹅肥肝油酸值最高,原因是长时间加热,使得油脂中产生的过氧化物进一步分解成酸、醛等小分子物质,导致油脂酸值增加、过氧化值较小;且此方法容易造成溶剂残留,不仅破坏油脂风味,同时存在安全风险。超声波法是将有机溶剂与超声波仪有机结合的一种方法,此方法在提取鹅肥肝油成本较高,不利于鹅肥肝油的工业化生产。酶解离心法通过使用蛋白酶对鹅肥肝中蛋白质进行水解并破坏蛋白质和脂肪的结合,使细胞内油脂等细胞内容物充分快速释放,此工艺温度较低,有效防止不饱和脂肪酸的氧化,能够最大程度保持油脂的原有性质与活性,并且采用了高速离心将油脂快速析出,大大提高了生产效率,降低了能量消耗;此外,酶解过程中适宜的温度和时间又使鹅肝油得到了巴氏消毒,符合鹅肝油高端保健食品卫生要求。
4 结论
由于酶解离心法能够有效防止不饱和脂肪酸的氧化,较好保持油脂的活性,效率高,能耗低,所以符合产品卫生要求。
酶解离心法提取鹅肝油最佳工艺为:蛋白酶种类为碱性蛋白酶;缓冲液pH 8.5;酶解温度60℃、时间3.5 h;离心速率14 500 r/min、时间30 min。此条件下,鹅肥肝油提取率为99.25%,大大提高了产品得率。
[1]孙振国,刘文青.鹅肥肝产量和品质的影响因素[J].养殖与饲料,2010(11):15-18
[2]郑建,林松毅,徐彩娜,等.鹅肥肝中重要物质测定及卵磷脂提取[J].食品科学,2007,28(11):267-270
[3]张凤清,徐永苗.复配天然抗氧化剂对鹅肥肝抗氧化活性的研究[J].食品工业科技,2009,30(3):111-112
[4]Christie W W.Lipid Analysis Oxford[M].Oxford:Pergamon Press,1998
[5]张磊,徐桂花,杜志明,等.浅议江西发展鹅肥肝产业的对策[J].江西畜牧兽医杂志,2010(1):7-9
[6]Morita O,Soni MG.Safety assessment of diacylglycerol oil as an edible oil:a review of the published literature[J].Food and Chemical Toxicology,2009,47(1):9-21
[7]Taguchi H,Watanabe H,Onizawa K.et al.Energy value and digestibility of dietary oil containing mainly 1,3-diacylglycerol are similar to those of triacylglycerol[J].Lipids,2001,36(4):379-382
[8]Meng XH,Zou DY,Shi ZP,et al.Dietary diacylglycerol prevents high-fat diet-induced lipid accumulation in rat liver and abdominal adipose tissue[J].Lipids,2004,39(1):37-41
[9]王伟伟,王宝维,耿欣,等.富硒鹅肥肝对大鼠高脂血症的修复研究[J].中国农业科学,2011,44(5):1029-1039
[10]张佰帅.鹅油精炼加工工艺及功能性研究[D].青岛:青岛农业大学,2012
[11]侯杰.超声波辅助法提取鹅肥肝油工艺的研究[J].中国粮油学报,2013,28(9):75-81
[12]隋明.鹅油提取及理化指标分析[J].粮食与油脂,2016,29(3):42-45
[13]石迪,郝剑君,杨小克,等.微碱条件生物酶法提取鱿鱼油工艺研究[J].食品工业科技,2012,33(2):277-281
[14]黄万有,李德涛,屈小娟,等.人工神经网络优化军曹鱼内脏鱼油酶法提取工艺参数[J].食品工业科技,2013(7):173-177
[15]华娣.水酶法从花生中提取油与水解蛋白的研究[D].无锡:江南大学,2007
[16]范东方.超声波辅助水酶法提取油莎豆油的研究[D].福州:福建农林大学,2013

