高效液相色谱法同时测定方便面中16种多环芳烃
高慧,汪洋,王敏,王勤
(淄博市疾病预防控制中心,山东淄博255026)
多环芳烃是(Polycyclic aromatic hydrocarbons,PAHs)指两个或两个以上苯环[1]以稠环形式相连的化合物有4个或少于4个苯环的属于轻质多环芳烃,多于4个苯环的属于重质多环芳烃[2]。在目前环境中存在广泛,食物在高温时会分解出大量的多环芳烃,多环芳烃可通过皮肤、呼吸道和被污染的食物进入人体,在体内代谢活化为多环芳烃环氧化物,与DNA、RNA和蛋白质等生物大分子结合而诱发突变和肿瘤[3],其暴露的最大毒性为致癌性[4]。植物油中多环芳烃的检测方法有色谱-质谱法[5]、高效液相色谱法[6-8]、超高效液相色谱法[9-10]。目前方便面中多环芳烃的检测方法,报道较少。由于方便面样品基质复杂,因此建立一种灵敏,高效的检测方法是发展的必然趋势。本研究通过对色谱条件、样品前处理条件等的优化,建立了一种快速、准确测定方便面中16种多环芳烃的高效液相色谱方法。
1 材料与方法
1.1 仪器与试剂
Waters e2695高效液相色谱仪(带荧光检测器和二极管阵列检测器):美国沃特世公司;12位固相萃取仪:美国色谱科公司;N-EVAP 112氮吹浓缩仪:美国OA-SYS;CP-225D电子天平:德国赛多利斯;ST-16R高速离心机:美国赛默飞世尔科技有限公司;KS-500D型超声波清洗器:宁波科生仪器厂。
Milli-Q超纯水系统:美国密理博公司;Oasis HLB固相萃取柱(6mL/200 mg)、Sep-Park Florsil固相萃取柱(6 mL/1 g):美国沃特世公司;石油醚、乙腈、丙酮、二氯甲烷、甲醇、正己烷、甲苯(均为HPLC级):德国默克公司;16种PAHs标准溶液(200 μg/mL,甲醇溶剂),编号:Z-013-17:美国AccuStandard公司。精确取16种PAHs有证标准溶液(200 μg/mL)50 μL,加 2 mL 甲苯,用乙腈定容至10 mL,制得标准溶液中间液(1 000 ng/mL)。
1.2 试验方法
1.2.1 色谱条件
色谱柱(WatersPAHC18analytical column,4.6mm×250 mm,5 μm);柱温:30 ℃;进样体积:10 μL;流动相:水+乙腈;流速:1.0 mL/min。流动相梯度见表1。
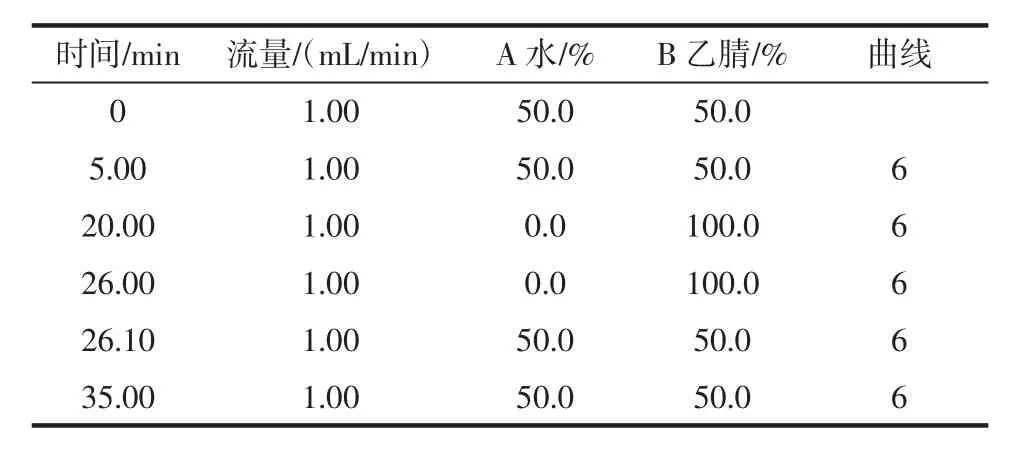
表1 流动相梯度表Table 1 Mobile phase gradient table
苊烯在荧光没有响应,所以用二极管阵列检测器检测,其他15种PAHs用荧光检测器检测。两个检测器流动相梯度相同,检测波长苊烯:230 nm,其他15种PAHs的检测激发波长和发射波长见表2。

表2 15种PAHs的检测激发波长和发射波长Table 2 Detection excitation wavelength and emission wavelength of 15 PAHs
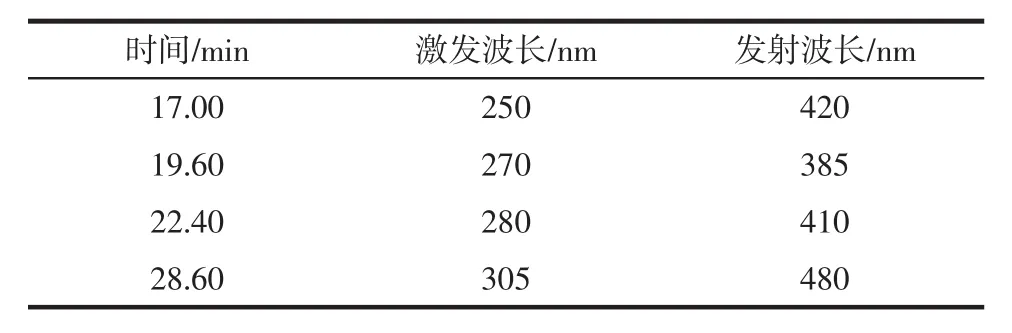
续表2 15种PAHs的检测激发波长和发射波长Continue table 2 Detection excitation wavelength and emission wavelength of 15 PAHs
1.2.2 样品前处理
称取方便面样品20.0 g,以石油醚进行油脂提取,提取液加热挥发除去石油醚,制备得到油脂,称重,备用。称取2.0 g油脂于15 mL塑料离心管中,加入5 mL乙腈:丙酮(1∶1,体积比)混合提取液,涡旋 30 s,超声5 min,8 000 r/min下离心5 min。小心提取上层液体于另一10 mL离心管中,重复加提取液提取两次,合并提取液,35℃水浴下氮吹至3.0 mL左右,等待过柱净化。
第一次净化:采用Waters Oasis HLB柱进行净化,依次10 mL二氯甲烷、10 mL甲醇、10 mL乙腈对柱子进行活化;将上述提取液过柱,同时用玻璃离心管进行收集;再用5 mL乙腈 ∶丙酮(1∶1,体积比)进行清洗,5 mL二氯甲烷进行洗脱两次,洗脱液均收集于玻璃离心管中,收集的洗脱液于35℃水浴下氮吹至0.2 mL左右,加入正己烷定容至2.0 mL(等待后续第二次净化用)。
第二次净化:采用Sep-Pak Florsil柱进行净化,依次15 mL二氯甲烷、15 mL正己烷对柱子进行活化;将第一次净化后收集液过柱,同时用玻璃离心管进行收集;再分别用5 mL正己烷清洗,5 mL正己烷∶二氯甲烷(2∶1,体积比)洗脱两次,洗脱液收集于同一玻璃离心管。
浓缩:将第二次净化后的洗脱液在35℃下氮吹浓缩至近干,加入甲苯0.2 mL,加入乙腈定容至1.0 mL,过0.22 μm的有机过滤膜后供HPLC上机测定。
1.2.3 标准曲线绘制
用1.1标准溶液中间液(1 000 ng/mL)稀释出1.0、2.5、5.0、10.0、25.0、50.0、100.0 ng/mL 标准系列溶液,分别进样10 μL,记录色谱图,根据标准溶液的浓度和峰面积进行回归,绘制标准曲线,以保留时间定性。
2 结果与讨论
2.1 色谱条件的选择和优化
2.1.1 检测器的选择
检测的16种PAHs在紫外区都有吸收,二极管阵列检测器能同时测定,但灵敏度比较低,对16种PAHs的检出限约为1 μg/mL;而选择用荧光检测器灵敏度更高,除苊烯在荧光没有响应,其余15种PAHs检出限可达到0.7 ng/mL;所以选择了苊烯用二极管阵列检测器进行检测,其余15种PAHs用荧光检测器进行检测。
2.1.2 色谱柱的选择
选用了PAHs的专用色谱柱Waters PAH C18,分离度明显优于普通C18色谱柱,且只需采用乙腈-水的梯度洗脱即可实现完全分离。配制浓度为50ng/mL的15种PAHs的分离色谱图见图1。
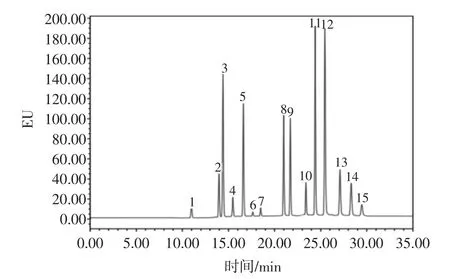
图1 15种PAHs标准色谱图Fig.1 Standard chromatogram of 15 PAHs
按照上述前处理方法提取后的方便面样品图谱见图2,除苯并(g,h,i)芘未检出外,其它 14 种 PAHs均有不同浓度的检出。

图2 样品的液相色谱图Fig.2 The liquid chromatogram of the sample
2.1.3 流动相的选择
因15种PAHs中有许多是同分异构体,要使这些同分异构体在适宜的时间内有效分离并峰形良好,采用了不同比例的乙腈和水进行梯度洗脱,结果表明:乙腈比例高时,目标峰保留时间短,出峰快,峰行尖锐,但苊和芴分离不到基线;乙腈比例低时,分离效果好,但峰形拖尾严重;根据流动相对不同PAHs的洗脱能力以及色谱柱和梯度泵的最大承受压力,反复调整,最后选择了最优化的梯度洗脱程序(表1)。苊烯用该梯度洗脱程序也分离良好。
2.1.4 检测波长的选择
荧光检测器中化合物的激发波长和发射波长决定了该化合物的检出限和灵敏度,故根据15种PAHs在不同波长下的响应值及出峰时间,选择了最佳的检测波长程序。在该最佳波长程序下进行检测,15种PAHs的灵敏度高,检出限低,完全可以满足方便面中PAHs的检测。苊烯在紫外230 nm下相应最高,因此选择了230 nm进行测定。
2.2 固相萃取条件优化
2.2.1 固相萃取柱的选择
影响方便面中PAHs测定的主要因素是方便面中的极性脂类和脂肪等,GB5009.265-2016[11]《食品安全国家标准食品中多环芳烃的测定》选用溶剂提取的方法,回收率和精密度均不理想。本方法选用了水可浸润的反相吸附柱Oasis HLB,该柱由亲水性的N-乙烯吡咯烷酮和亲脂性的二乙烯基苯按特定比例聚合而成。它以特别的“极性钩”为增强极性物的保留提供了优异的反相保留容量,也由于这个“极性钩”的存在而能保持很好的润湿性,避免了意外干涸导致的回收率不高问题。与传统的C18小柱相比,Oasis HLB具有更高的吸附容量,更高的保留能力,更宽的pH值适用范围,更高的稳定性,提高了样品的回收率和精密度。
由于方便面基质复杂,又选用了Sep-Pak Florsil正向吸附柱进行二次净化,Sep-Pak Florsil的吸附剂是弗罗里硅土,是一种极性、高活性、弱碱性吸附剂,可以从非水相样品溶液中吸附中等极性分析物,因此既可吸附多余的脂肪和色素等杂质[12],也可完全吸附待测物,再分别用不同极性溶剂进行洗脱,达到净化待测物的目的。
2.2.2 萃取条件优化
反相吸附柱Oasis HLB富集PAHs后,需要一种极性合适的溶剂能够清洗杂质并保留待测物,再选择一种溶剂洗脱待测物,乙腈能够清洗杂质但洗脱不完全,丙酮的溶解性太强能够完全清洗杂质但会使少许待测物进入液相,二氯甲烷能够对待测物有最大溶解度。因此选择先用乙腈∶丙酮(1∶1)进行清洗,能够保持待测物的最大保留,再选用二氯甲烷洗脱,保证了杂质的最大清洗和待测物的最大洗脱。
正向吸附柱Sep-Pak Florsil进行净化时,需要一种极性较弱的有机溶剂才能保证待测物的最大保留和杂质的最大洗脱,再用极性较强溶液洗脱待测物进行检测。因此选用了正己烷清洗残留的杂质,正己烷∶二氯甲烷(2∶1)洗脱待测物。
2.3 线性范围及检出限
在本试验条件下,按照1.2.1色谱条件进行测定,以峰面积对相应的多环芳烃化合物质量浓度作图,所得的16种PAHs的线性方程,根据3倍信噪比的计算方法求得方法的最低检出限,10倍信噪比的浓度为最低定量浓度。以取样20 g样品可制备4.0 g油脂,取2.0 g油脂进行净化、浓缩最后定容至1.0 mL计,分别得到最低检出限和最低定量限见表3。

表3 16种PAHs的高效液相色谱测定法的线性范围、检出限和定量限Table 3 The linear range,detection limit and quantitative limit of 16 PAHs for HPLC
2.4 加标回收率和精密度
称取20.0 g未检出PAHs的方便面样品于聚四氟乙烯离心管中,分别添加质量浓度为1.0、5.0、10.0 ng/mL的标准溶液,每个水平6份,充分混匀,放置2 h后按照最佳前处理和色谱分析条件进行测定,回收率在75.8%~95.3%之间,RSD为2.87%~5.23%,结果见表4。

表4 16种PAHs的加标回收率和相对标准偏差Table 4 The recoveries and relative standard deviations of 16 PAHs
2.5 样品测定
淄博市2016年共监测随机采集的山东省在售170份方便面样品,本次检测样品覆盖所有市场销售的方便面品牌。其中苯并(a)芘检出17份,检出率10.0%,合格率100.0%;萘、菲检出率最高达到98.8%,只有2份未检出;蒽、荧蒽检出率也较高在90.0%以上;苯并(g,h,i)芘、苊烯均未检出,检出率为 0。油炸型方便面的轻质PAHs和重质PAHs污染程度均高于非油炸型方便面;油炸型方便面的萘污染程度最高,高达65.9 μg/kg;非油炸型方便面的荧蒽污染程度最高,达到 37.5 μg/kg。
3 结论
通过对方便面样品固相微萃取条件和色谱条件的优化,选择了最佳检测条件,实现了对方便面中16种PAHs的同时测定,达到了很好的分离效果。该方法具有操作简便、灵敏度高、检出限低、线性范围宽、杂质干扰少及结果准确可靠等优点。因方便面中干扰物复杂,选用Oasis HLB和Sep-Pak Florsil两种固相萃取柱净化,既能实现方便面中复杂干扰物的去除又能实现待测物的完全保留和洗脱,实现了HPLC对16种PAHs的完全分离检测,满足了方便面中PAHs的分析测试要求。
[1]何燕,王淑惠,解彦平,等.高效液相色谱法测定空气中的16种多环芳烃[J].现代预防医学,2015,42(8):1475-1478,1500
[2]董峰光,王朝霞,宫春波.食用植物油中多环芳烃的来源和处理[J].现代预防医学,2014,41(11):1993-1995,1998
[3]孙长颢.营养与食品卫生学[M].6版.北京:人民卫生出版社,2007:312-313
[4]贾鸿宁,戴红.多环芳烃的致癌性及其机制研究进展[J].大连医科大学学报,2009,31(5):604-607
[5]中华人民共和国国家质量监督检验检疫总局.GB/T23213-2008植物油中多环芳烃的测定气相色谱-质谱法[S].北京:中国标准出版社,2008
[6]中华人民共和国国家质量监督检验检疫总局.GB/T24893-2010/ISO 15753:2006动植物油脂多环芳烃的测定[S].北京:中国标准出版社,2006
[7]乔海鸥,王敏娟,胡佳薇,等.高效液相色谱法同时测定植物油中的15种多环芳烃[J].中国食品卫生杂志,2013,25(5):434-437
[8]曹小丽,杨晓倩,刘素华.荧光检测法测定植物油中15种多环芳烃[J].中国卫生检验杂志,2013,23(12):2580-2629
[9]倪进治,王军,李小燕,等.超高效液相色谱荧光检测器测定土壤中多环芳烃[J].分析试验室,2010,29(5):25-28
[10]那广水,刘春阳,张琳,等.固相膜萃取-超高效液相色谱-荧光法测定基地水体中多环芳烃[J].分析试验室,2011,30(1):29-31
[11]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB5009.265-2016食品安全国家标准食品中多环芳烃的测定[S].北京:中国标准出版社,2016
[12]董桂贤,王朝霞,周晓歌,等.超高效液相色谱法同时测定植物油中15种多环芳烃[J].卫生研究,2014,43(4):620-623

