何首乌致大鼠肾损伤及对肾细胞凋亡的调控作用
李贺芝,段思明,王 茜*,刘 阳(.河北女子职业技术学院,石家庄 05009; .河北中医学院,石家庄 05000)
何首乌是蓼科植物何首乌的干燥块根,分为生首乌和制首乌两个炮制品种,其中制首乌具有补肝肾、益精血、乌须发、强筋骨、化浊降脂的功效;生何首乌则能解毒、消痈、截疟、润肠通便[1]。近年来何首乌致不良反应的事件时有报道,因此中医药工作者就其安全性开展了一系列研究工作,现已确定何首乌应用不当有一定的肝毒性。但也有研究发现何首乌大剂量使用还可以损伤肾脏,并推测其对肾脏的毒害作用可能是通过引起肾小球和(或)肾小管损伤后,造成肾小球滤过率减少,肾小管重吸收功能受损所致[2]。基于何首乌致肾损伤鲜有报道,作为排泄器官,长期使用不能确保安全性,且炮制品种和提取溶剂不同会影响化学成分变化,势必对药物生物活性或毒性有所影响。因此,考虑到何首乌作为乌发的养生保健物品,用量较小,用药时间较长,课题选择2015版《中华人民共和国药典》中制首乌的最低剂量[生药6 g/(kg·d)],连续给药30 d,观察何首乌对肾功能的损伤情况,同时结合目前中药配方颗粒应用广泛,为了探讨其安全性,本研究设置了生首乌及制首乌配方颗粒组与水提、醇提首乌组进行比较,并从细胞凋亡的角度,通过检测抗细胞凋亡因子Bcl-2蛋白水平、促细胞凋亡因子BAX蛋白水平的变化,揭示肾损伤的机制,为保证临床合理安全应用何首乌提供科学依据,完善何首乌的药性理论。
1 材料和方法
1.1 实验动物
6周龄SD大鼠,清洁级,雌雄各半,体重(160±20) g,共70只,由河北医科大学实验动物中心提供[SCXK (冀) 2013-1-003]。实验动物饲养于河北省中药配方颗粒工程技术研究中心动物室(万级洁净屏障系统),每笼饲养5只大鼠,恒温恒湿[温度:(23±2)℃,相对湿度:60%~70%],12 h明/暗交替,动物自由进食水[SYXK (冀) 2016-0047]。
1.2 主要试剂与仪器
生、制何首乌饮片,由山东百味堂有限公司提供(产品批号:150601检64);生、制何首乌配方颗粒剂,由四川新绿色药业科技发展股份有限公司提供(生首乌0.5 g相当于10 g生药,产品批号:15040043;制首乌1 g相当于10 g生药,产品批号:15070108)。何首乌水提药液的制备:按照中药化学水提法的制备工艺,取何首乌药材165 g第一次加10倍量水,第二次加8倍量水,然后将煎煮的两次药液合并浓缩至所需浓度(每毫升0.06 g生药)。何首乌醇提取药液的制备:按照中药化学醇提法的制备工艺,取何首乌药材165 g用70%的乙醇回流提取2次,合并两次药液浓缩至所需浓度(每毫升0.06 g生药)。何首乌配方颗粒药液的制备:称取16.5 g制首乌,8.25 g生何首乌配方颗粒,分别用沸水溶解,配成制首乌浓度为每毫升0.006 g配方颗粒的药液,生首乌浓度为每毫升0.003 g配方颗粒的药液,供实验使用。
BAX抗体(BAX antibody,批号:sc-526),Bcl-2抗体(Bcl-2 antibody,批号:sc-783),由Santa Cruz Biotechnology, Inc.提供;3, 3-二氨基联苯胺盐酸盐(DAB,批号:D5905),由Sigma-Aldrich提供;免疫组化试剂盒(Vectastain ABC Kit,批号:PK-4001),由Vector Laboratories, Inc.提供;TUNEL试剂盒(IHC,批号:11684817910),由Roche提供;肌酐试剂盒(Crea,批号:AUZ3562),尿素氮试剂盒(BUN,批号:AUZ3611),尿酸试剂盒(UA,批号:AUZ3654),均由贝克曼库尔特实验系统有限公司提供;β2-微球蛋白试剂盒(β2-MG,批号:L160330919),由武汉华美生物技术有限公司提供。
Humalyzer 2000半自动生化仪(德国豪迈);DP73数码显微镜(Olympus);HMIAS-2000显微图像分析系统(武汉同济医科大学);756MC型紫外-可见分光光度计(上海精密科学仪器有限公司);酶标仪(Bio-Tek,ELx800);电热恒温水箱(余姚市东方电工仪器厂,HH·W21·600型);超低温保存箱(MDF-382E,日本Sanyo);高速冷冻离心机(1-15K,美国Sigma);石蜡切片机(Leica);等。
1.3 实验方法
1.3.1 分组给药
SD大鼠,雌雄各半,分别按体重随机分成7组,即生何首乌水提取药液组(生药0.6 g/kg,SW组),制何首乌水提取药液组(生药0.6 g/kg,ZW组),生何首乌醇提取药液组(生药0.6 g/kg,SA组),制何首乌醇提取药液组(生药0.6 g/kg,ZA组),生首乌配方颗粒组(生药0.6 g/kg,SK组),制首乌配方颗粒组(生药0.6 g/kg,ZK组),正常对照组,每组10只,雌雄各半。何首乌各组大鼠的给药剂量按照人与大鼠体表系数法进行换算,大约相当于成人用药量的0.1倍,故何首乌各给药组按照生药0.6 g/kg的剂量进行配制,给予相应药液灌胃,正常组给予生理盐水灌胃,给药体积均为1 mL/100 g,连续给药30 d。给药后观察大鼠精神状态、行为活动、饮食情况、二便情况、皮肤毛色。每隔7 d给大鼠称重一次,自由进食水。实验期间,按照动物实验的3R原则给予人道主义关怀。
1.3.2 样本采集
给药30 d后,禁食不禁水16 h,10%水合氯醛麻醉(3.5 mL/kg),腹主动脉取血,4℃,3500 r/min,离心20 min,分离血清,分装后置于-70℃冰箱保存,待检测血清尿素氮(BUN)、肌酐(Crea)、尿酸(UA)、β2-微球蛋白(β2-MG)指标变化。取血后迅速取大鼠左侧肾脏置于4%多聚甲醛溶液中固定保存,待观察肾组织病理形态、细胞凋亡状况以及Bcl-2蛋白水平、BAX蛋白水平。因麻醉时,由于动物个体差异有过度麻醉致死的情况,故检测血液和组织相关指标时,每组均选择了8个标本进行检测。
1.3.3 指标检测
采用半自动生化分析仪检测血清尿素氮、肌酐、尿酸水平,采用酶标仪检测β2-微球蛋白指标变化;将多聚甲醛溶液固定的左侧肾脏,石蜡包埋,切片,HE染色,采用HE染色观察肾脏病理组织形态的变化;将多聚甲醛溶液固定的左侧肾脏,石蜡包埋,切片,采用TUNEL法,按照试剂盒说明书检测各组动物肾组织的细胞凋亡;采用免疫组化SP(streptavidin-perosidase)法,即链霉菌抗生物素蛋白-过氧化物酶连结法,按照试剂盒说明检测抗细胞凋亡因子Bcl-2蛋白水平、促细胞凋亡因子BAX蛋白水平。免疫组化指标采用平均光密度值来计算,分析时每组观察8个样本,每个样本观察10个视野取平均值。
1.4 统计学方法
2 结果
2.1 何首乌不同提取物对大鼠体重的影响
与正常对照组相比,各给药组大鼠体重给药前及给药后无明显变化(P> 0.05);各给药组之间体重差异亦无显著性(P> 0.05)。见表1。
2.2 何首乌不同提取物对大鼠肾功能的影响
肌酐含量:各给药组较正常对照组均有升高趋势,但差异无显著性(P> 0.05);尿素氮含量:各给药组尿素氮含量较正常对照组均有所降低(P< 0.05,P< 0.01),但各给药组之间差异无显著性(P> 0.05);尿酸含量:各给药组较正常对照组均有升高趋势,但差异无显著性(P> 0.05);β2-微球蛋白含量:各给药组较正常对照组均有升高趋势,其中以SA组和ZA组升高较为明显,ZA组差异有显著性(P> 0.05)。见表2。
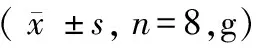
表1 何首乌不同提取物对大鼠体重的影响Tab.1 Effects of Polygonum multiflorum extracts prepared with different processing methods and extraction solvents on the body weight of SD rats

表2 何首乌不同提取物对大鼠肾功能的影响Tab.2 Effects of Polygonum multiflorum extracts prepared with different processing methods and extraction solvents on the renal function of SD rats
注:与正常对照组比较,*P< 0.05,**P< 0.01;与生首乌水提组比较,▲P< 0.05,▲▲P< 0.01。
Note.Compared with the normal control group,*P< 0.05,**P< 0.01. Compared with the SW group,▲P< 0.05,▲▲P< 0.01.
2.3 何首乌不同提取物对大鼠肾脏病理组织形态的影响
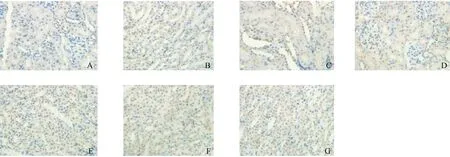
正常对照组大鼠肾皮、髓质分界清楚。肾皮质内肾小球未见萎缩、纤维化及肥大,肾近曲小管、远曲小管及集合管的上皮细胞均未见颗粒样变性、空泡变性及坏死改变,管腔内未见细胞管型和蛋白管型。其中以生首乌醇提药液组和配方颗粒组最为严重,出现大面积细胞空泡变性(损伤面积3/4以上);其次为生首乌水提药液组,制首乌醇提药液组,出现局灶性细胞空泡变性(损伤面积1/2~3/4之间);而制首乌水提药液组病变最轻,偶见细胞空泡变性。见图1。

注:A:正常对照组;B:生首乌水提组;C:制首乌水提组;D、E:生首乌醇提组;F:制首乌醇提组;G:生首乌免煎组;H:制首乌免煎组。图1 何首乌不同提取物对肾组织病理形态的影响(HE染色,× 400)Note.A: Normal control group. B: Traditional water extract of raw Polygonum multiflorum group (SW group). C: Traditional water extract of prepared Polygonum multiflorum group (ZW group). D and E: 70% alcohol extract of raw Polygonum multiflorum group (SA group). F: 70% alcohol extract of prepared Polygonum multiflorum group (ZA group). G: Raw Polygonum multiflorum without decoction group (SK group). H: Prepared Polygonum multiflorum without water decoction group (ZK group).Fig.1 Effects of Polygonum multiflorum extracts prepared with different processing methods and extraction solvents on the histopathology of renal tissues in SD rats. HE staining
2.4 何首乌不同提取物对大鼠肾细胞凋亡的影响
细胞凋亡程度:各给药组相对于正常对照组细胞凋亡程度均有显著升高(P< 0.01),SW组和SK组升高最明显;与SW组相比,其他各实验组平均光密度值均降低,其中SA组和ZK组降低最明显,差异有显著性(P< 0.01)。BAX蛋白表达:与正常对照组比较,SA组升高最明显,差异有显著性(P< 0.01);与SW组相比,其他给药组蛋白表达均升高,其中SA组和ZK组升高最明显,差异有显著性(P< 0.01)。Bcl-2蛋白表达:各组之间差异无显著性(P> 0.05)。见表3、图2~4。

表3 何首乌不同提取物对大鼠肾细胞凋亡及Bcl-2、BAX表达的影响Tab.3 Effects of Polygonum multiflorum extract prepared with different processing methods and extraction solvents on cell apoptosis and expression of Bcl-2 and BAX in renal tissues of the SD rats
注:与正常对照组比较,*P< 0.05,**P< 0.01;与生首乌水提组比较,▲P< 0.05,▲▲P< 0.01。
Note.Compared with the normal control group,*P< 0.05,**P< 0.01. Compared with the SW group,▲P< 0.05,▲▲P< 0.01.
注:A:正常对照组;B:生首乌水提组;C:制首乌水提组;D:生首乌醇提组;E:制首乌醇提组;F:生首乌免煎组;G:制首乌免煎组。图2 何首乌不同提取物对肾组织细胞凋亡的影响(SP法,× 400)Note.A: Normal control group. B: Traditional water extract of raw Polygonum multiflorum group (SW group). C: Traditional water extract of prepared Polygonum multiflorum group (ZW group). D: 70% alcohol extract of raw Polygonum multiflorum group (SA group). E: 70% alcohol extract of prepared Polygonum multiflorum group (ZA group). F: Raw Polygonum multiflorum granules without water decocting extraction group (SK group), and G: Prepared Polygonum multiflorum granules without water decocting extraction group (ZK group).Fig.2 Effects of Polygonum multiflorum extract prepared with different processing methods and extraction solvents on cell apoptosis in renal tissues of the SD rats. SP method

注:A:正常对照组;B:生首乌水提组;C:制首乌水提组;D:生首乌醇提组;E:制首乌醇提组;F:生首乌免煎组;G:制首乌免煎组。图3 何首乌不同提取物对肾组织细胞Bcl-2表达的影响(SP法,× 400)Note.A: Normal control group. B: Traditional water extract of raw Polygonum multiflorum group (SW group). C: Traditional water extract of prepared Polygonum multiflorum group (ZW group). D: 70% alcohol extract of raw Polygonum multiflorum group (SA group). E: 70% alcohol extract of prepared Polygonum multiflorum group (ZA group). F: Raw Polygonum multiflorum granules without water decocting extraction group (SK group). G: Prepared Polygonum multiflorum granules without water decocting extraction group (ZK group).Fig.3 Effects of Polygonum multiflorum extract prepared with different processing methods and extraction solvents on the expression of Bcl-2 in renal tissues of SD rats. SP method

注:A:正常对照组;B:生首乌水提组;C:制首乌水提组;D:生首乌醇提组;E:制首乌醇提组;F:生首乌免煎组;G:制首乌免煎组。图4 何首乌不同提取物对肾组织细胞BAX表达的影响(SP法,× 400)Note.A: Normal control group. B: Traditional water extract of raw Polygonum multiflorum group (SW group). C: Traditional water extract of prepared Polygonum multiflorum group (ZW group). D: 70% alcohol extract of raw Polygonum multiflorum group (SA group). E: 70% alcohol extract of prepared Polygonum multiflorum group (ZA group). F: Raw Polygonum multiflorum granules without water decocting extraction group (SK group). G: Prepared Polygonum multiflorum granules without water decocting extraction group (ZK group).Fig.4 Effects of Polygonum multiflorum extract prepared with different processing methods and extraction solvents on the expression of BAX in renal tissues of the SD rats. SP method
3 讨论
血清肌酐和尿素氮是临床常用的内源性肾功能评价指标。尿酸是嘌呤代谢的终末产物,机体产生的尿酸通过肾小球滤过,经肾小管重吸收,约有10%排出体外,若肾功能异常则尿酸水平升高[3 - 4]。β2-微球蛋白可自由通过肾小球毛细血管壁,经过肾小球过滤后,几乎全部由肾小管重吸收,并迅速分解。正常人β2-微球蛋白的合成和释放相当恒定,体内含量极其微小,故血β2-微球蛋白可用于评估肾小球的滤过功能,且在一定程度上甚至较肌酐、尿素氮更敏感[5]。本实验结果显示,何首乌不同提取方法、不同炮制品种均能影响大鼠肾功能指标,其中肌酐、尿酸、β2-微球蛋白水平均较正常对照组有升高趋势,制首乌醇提药液组β2-微球蛋白水平升高明显,差异有显著性;而血清尿素氮各给药组水平较正常对照组显著降低,提示机体可能处于代偿阶段。
细胞凋亡是细胞在生理或病理条件下,通过一些因子的调控自动结束生命的过程。生理情况下,老化细胞通过细胞凋亡得以清除;病理状态下细胞凋亡参与多种疾病的发生发展[6 - 7]。若毒性药物致脏器损伤,组织细胞会发生变性或坏死,对细胞凋亡有诱导作用。已有研究显示,何首乌对人L02细胞有一定的诱导凋亡作用[8 - 11]。本实验TUNEL染色显示,各给药组的平均光密度值均较正常对照组显著提高,提示何首乌有助于诱导细胞的程序性死亡,但不同炮制品种和提取方法对凋亡的诱导作用无明显差异。在细胞凋亡的调控方面,Bcl-2家族成员主要调控线粒体途径,该家族成员包括抗凋亡因子和促凋亡因子。其中存在于线粒体外膜的Bcl-2是抗凋亡因子,存在于细胞质或线粒体膜中的BAX是促凋亡因子,在细胞凋亡过程中,首先促凋亡因子被激活,通过线粒体途径引起细胞凋亡,此时凋亡因子保护细胞不进入凋亡程序[12]。本实验中各给药组抗凋亡因子Bcl-2的平均光密度值与正常对照组比较有一定的上升趋势,但无明显差异,而促凋亡因子BAX的平均光密度值除生首乌醇提药液组和制首乌配方颗粒组显著升高外,其他给药组有一定的降低趋势,以水提药液组降低最明显,提示生首乌醇提取物和制首乌配方颗粒有一定的诱导细胞凋亡的作用,可能是其导致肾脏损伤的作用机制。
另一方面,化学成分是药物发挥作用或产生毒性的物质基础,而炮制方法及提取溶剂不同,会导致药材所含化学成分有所变化。已有化学研究表明,生首乌主要含二苯乙烯类、蒽醌类、类磷脂类、多糖、鞣质、无机元素等化学成分;而制首乌二苯乙烯苷、结合型蒽醌类物质、卵磷脂、鞣制含量降低,多糖含量增加,并产生新的物质;就提取溶剂而言,何首乌水提取液中水溶性成分较多,主要以鞣质及多糖为主;醇提取液中主要是溶于乙醇的物质,本研究中用70%的乙醇提取,而70%醇部分主要以结合蒽醌为主;配方颗粒是现代制剂,经检测以二苯乙烯苷及蒽醌类成分为主[13 - 16]。本研究中何首乌醇提组毒性最大,提示结合型蒽醌类物质可能是何首乌肾毒性表达的物质基础。
综合以上结果,可以得出以下结论:何首乌长期使用对肾脏产生一定的损伤,主要表现为肾小管功能受损,而炮制方法和提取溶剂的不同对肾脏损伤有所不同。生首乌对肾脏的损伤大于制首乌,用乙醇提取何首乌对肾脏的损伤最大。因此,使用何首乌时需结合患者病情体质根据医嘱用药,建议肾
功能不全者需谨慎用药,严重者应禁用。当日常保健时不宜泡药酒,建议用制首乌水煎服,且服用时最好定时监测肾功能,尤其是β2-微球蛋白含量,避免长期使用出现不可逆的肾损伤。本研究仅对何首乌致肾损伤做了初步探讨,该损伤是否可逆,还有待结合给药剂量、时间的不同以及药物洗脱时间的不同进一步探讨,且针对醇提液对肾脏损伤程度较重,还需设计系统试验,筛选精确指标,深入研究其损伤情况及机制。
参考文献:
[1] 钟赣生. 中药学 [M]. 第九版. 北京: 中国中医药出版社, 2012: 404.
[2] 杨德全. 何首乌致重症肝损伤 [J]. 药物不良反应杂志, 2005, 7(6): 449.
[3] Mount DB, Kwon CY, Zandi-Nejad K. Renal urate transport [J]. Rheum Dis Clin North Am, 2006, 32(2): 313-331.
[4] 张云静, 邹作君, 于龙丽. 早期肾功能损害患者肾脏排泄尿酸各指标的比较与分析 [J]. 中国中西医结合肾病杂志, 2012, 13(1): 54-56.
[5] 黄翠瑶, 杨汉勤, 张松权. 老年高血压肾病血、尿微球蛋白的改变及其意义 [J]. 实用老年医学, 1993, 7(1): 40.
[6] Thompson CB. Apoptosis in the pathogenesis and treatment of disease [J]. Science, 1995, 267(5203): 1456-1462.
[7] 皇甫冰, 高继萍, 杨霞, 等. 氧化应激与肾脏细胞凋亡 [J]. 中国比较医学杂志, 2015, 25(2): 54-60.
[8] 贾歌刘畅, 庞晶瑶, 柏兆方, 等. 何首乌及其成分对人正常肝细胞凋亡的影响 [J]. 中国中医药信息杂志, 2015, 22(11): 46-49.
[9] 卫培峰, 党艳丽, 焦晨莉, 等. 何首乌不同成分与肝细胞凋亡的相关性研究 [J]. 陕西中医, 2009, 30(2): 238-239.
[10] 孙雪东, 严一核, 刘芳, 等. 血必净对脓毒性急性肾损伤大鼠肾小管细胞凋亡和相关蛋白表达的影响 [J]. 中华危重症医学杂志(电子版), 2016, 9(5): 315-320.
[11] 罗康, 朴尚国, 金英顺, 等. 细胞凋亡和细胞自噬在慢性环孢素A肾毒性中的作用 [J]. 中国老年学杂志, 2014, 34(11): 3051-3053.
[12] Su E, Han X, Jiang G. The transforming growth factor beta 1/SMAD signaling pathway involved in human chronic myeloid leukemia [J]. Tumori, 2010, 96(5): 659-666.
[13] 王亭, 龚千锋. 何首乌炮制后化学成分及药理作用的研究进展 [J]. 中国实验方剂学杂志, 2017, 23(2): 220-226.
[14] 龚彦胜, 张亚囡, 黄伟, 等. 与功效、毒性相关的何首乌化学成分研究进展 [J]. 中国药物警戒, 2012, 9(8): 472-475.
[15] 胥爱丽, 董玉娟, 江洁怡, 等. 何首乌配方颗粒的UPLC指纹图谱及化学成分归属 [J]. 中国实验方剂学杂志, 2016, 22(2): 47-50.
[16] 林龙飞. 何首乌致肝损伤成分及作用机制研究 [D]. 北京中医药大学, 2016: Ⅰ.

