樟树叶木脂素大孔吸附树脂纯化工艺优化
伍平香WU Ping-xiang 李忠海 -
(1. 中南林业科技大学,湖南 长沙 410004;2. 稻谷及副产物深加工国家工程实验室,湖南 长沙 410004)
樟树(Cinnamomumcamphora)是一种广布于中国长江以南及西南地区的樟科(Lauraceae) 樟属(Cinnamomum)植物,生长快,材质优良,是江南四大名木之一,被誉为江南宝树[1]。樟树作为传统中药材,具有抑菌、消炎、止痛、抗癌、抗氧化及提高人体免疫力等功效[2-3]。目前,大量研究表明樟树叶中木脂素类化合物含量较高[4],该类化合物作为一种天然植物雌激素,可分为木脂素(lignan)和新木脂素(neolignan)两大类[5],广泛分布于植物的茎、叶、花、种子、果实等部位[6]。木脂素又称木脂体或木酚素,由苯丙素单位(C6—C3)聚合而成[7],多数呈游离态,少数与糖结合成苷。研究[8-10]表明,木脂素具有抑菌、抗炎、抗氧化、抗肿瘤、保护肝脏以及调节胆固醇等多重功效。
近年来,大孔吸附树脂被广泛应用于天然产物的分离纯化,只因其具有比表面积大、吸附容量大、理化性质稳定、吸附速度快、选择性较好、解吸条件温和、强度好、使用周期长、节省费用等优势[11-12]。陈晓宇等[13]通过静态和动态试验对5种大孔树脂进行筛选,确定AB-8大孔树脂对五味子木脂素纯化效果较好,并在最佳纯化条件下用50% 和70% 乙醇进行洗脱,最终测得五味子木脂素的含量由11.68% 提高到41.48%。雷燕萍[14]考察了大孔吸附树脂对雪松松针木脂素纯化效果,在最佳纯化工艺条件下进行动态吸附、解吸,最终得到平均含量为57.77% 的雪松松针木脂素提取物。目前,对樟树叶中木脂素的研究主要是提取工艺,而对于其纯化工艺条件的研究还不够系统、全面。因此,本研究首先选择6种不同类型大孔树脂进行吸附解吸性能考察,综合考虑后选择其中最优的大孔树脂进行考察以确定樟树叶中木脂素最佳纯化工艺条件,为樟树叶中木脂素类化合物进一步分离纯化提供试验依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
樟树叶:小叶樟,于2016年3月采自中南林业科技大学校区;
无水乙醇、甲醇、氯仿、乙酸乙酯、正丁醇:分析纯,天津市恒兴化学试剂制造有限公司;
变色酸:分析纯,上海源叶生物科技有限公司;
芝麻素标准品、五味子酯甲标准品:色谱纯,上海源叶生物科技有限公司;
浓硫酸:分析纯,国药集团化学试剂有限公司;
大孔树脂:AB-8、X-5、D101型,安徽三星树脂科技有限公司;
大孔树脂:HPD450、HPD722、HPD600型,东鸿化工有限公司。
1.1.2 主要仪器设备
电子天平:FA1104型,上海舜宇恒平科学仪器有限公司;
旋转蒸发仪:Hei-VAP Precision型,德国Heidolph公司;
分光光度计:721G型,天恒科学仪器设备有限公司;
电热鼓风干燥箱:101-2AB型,天津市泰斯特仪器有限公司;
真空干燥箱:DZF-6050型,上海博讯实业有限公司;
高速万能粉碎机:FW200型,北京科伟永兴仪器有限公司;
超声波清洗机:SB25-12D型,宁波新芝生物科技股份有限公司;
电脑全自动收集器:DBS-100型,上海沪西仪器厂有限公司;
玻璃层析柱:Φ15 mm×200 mm,上海五相仪器仪表有限公司。
1.2 方法
1.2.1 样品溶液制备 樟树叶清洗、晾干,105 ℃烘箱内杀青30 min、再将烘箱调至70 ℃将樟树叶烘干,粉碎过60目筛,热回流提取3次,过滤合并滤液,浓缩,依次经石油醚、乙酸乙酯、正丁醇萃取3次,取乙酸乙酯层进行浓缩,乙醇溶解浸膏得粗提液、备用。
1.2.2 标准曲线绘制 根据文献[15],以五味子酯甲为标准品,测得标准曲线方程为:y=11.327 5x+0.022 77,相关系数R2=0.999 5。
1.2.3 大孔吸附树脂筛选
(1) 大孔吸附树脂预处理:先用95% 乙醇将大孔树脂浸泡24 h,使其充分溶胀,湿法装柱,再依次用 95% 乙醇、适量蒸馏水冲洗柱子,并观察流出液,当流出液中无白色浑浊现象且树脂柱无醇味后停止冲柱,然后用5% NaOH溶液浸泡3 h,纯水洗至pH值为中性,最后用4% HCl溶液浸泡3 h,纯水洗至流出液为中性,放置阴凉处晾干备用[16]。不同大孔树脂的物理结构参数见表1。

表1 不同大孔树脂的物理结构参数Table 1 Physical properties of different macroporous resins
(2) 不同大孔吸附树脂对木脂素静态吸附与解吸试验:精密称取已处理好的6种不同类型大孔树脂各5.0 g于锥形瓶中,加入质量浓度为2.65 mg/mL木脂素粗提液 30 mL,密封,置于25 ℃恒温摇床中振摇24 h,速度为60 r/min,待吸附完全后,过滤,测定滤液中木脂素的质量浓度。吸附完全的6种树脂用100 mL蒸馏水冲洗至表面无提取液残留及其他杂质,用滤纸吸干表面水分,加入50 mL体积分数为90% 的乙醇,密封置于25 ℃ 恒温摇床中, 60 r/min转速振摇24 h,充分解吸后,过滤,测定滤液中木脂素的质量浓度,按式(1)~(4)计算各树脂的比吸附量、吸附率、比解吸量与解吸率[17]。
(1)
(2)
(3)
(4)
式中:
Q1——比吸附量,mg/g;
W1——吸附率,%;
Q2——比解吸量,mg/g;
W2——解吸率,%;
C0——吸附前样品中木脂素质量浓度,mg/mL;
C1——吸附后滤液中木脂素质量浓度,mg/mL;
V1——粗提液体积,mL;
M——树脂质量,g;
C2——解吸液中木脂素质量浓度,mg/mL;
V2——解吸液体积,mL。
(3) 大孔吸附树脂的动态吸附-解吸试验:精密称取处理过的3种大孔树脂(X-5、AB-8、D101型)各5.0 g,湿法装柱,准确量取2.65 mg/mL樟树叶木脂素粗提液30 mL 进样,控制上样速度为1.5 mL/min,收集流出液,再用100 mL纯水冲洗树脂柱,最后用50 mL体积分数为 90% 的乙醇进行解析,收集解吸液。测定流出液及解吸液中木脂素的含量,并分别按式(2)、(4)计算其吸附率及解吸附率。
1.2.4 大孔吸附树脂(AB-8型)静态吸附-解吸试验
(1) 大孔树脂吸附-解吸动力学曲线:精密称取预处理过的大孔树脂5.0 g于锥形瓶中,加入 2.65 mg/mL 木脂素粗提液30 mL,密封于25 ℃恒温摇床中以60 r/min振摇。分别吸附 2,4,6,8,10,12,24 h 后从锥形瓶中精密吸取0.05 mL 上清液,测定其中木脂素粗提液质量浓度,绘制静态吸附动力学曲线;按照1.2.3中解吸方法,分别解吸2,4,6,8,10,12,24 h后从锥形瓶中精密吸取0.05 mL解吸液,测定其中木脂素质量浓度,计算解吸液中木脂素含量,绘制静态解吸动力学曲线[18]。
(2) 上样质量浓度对吸附效果的影响:精密称取预处理过的大孔树脂5.0 g于锥形瓶中,加入50 mL质量浓度分别为0.53,1.06,1.59,2.12,2.65 mg/mL的木脂素粗提液,密封置于25 ℃恒温摇床中,以60 r/min振摇8 h,充分吸附后,过滤,测定滤液中木脂素的质量浓度,计算吸附率。
(3) 乙醇体积分数对解吸效果的影响:精密称取预处理过的大孔树脂7份各5.0 g于锥形瓶中,加入30 mL 质量浓度为2.12 mg/mL 的木脂素粗提液,密封置于25 ℃ 恒温摇床中,以60 r/min 振摇8 h,充分吸附后,过滤,测定滤液中木脂素的质量浓度,用100 mL 蒸馏水冲洗滤出的树脂至其表面无提取液残留,滤纸吸干水分后,加入50 mL 体积分数分别为10%,30%,50%,70%,80%,90%,95% 的乙醇溶液,密封置于25 ℃恒温摇床上进行振摇,在60 r/min 条件下振摇10 h,充分解吸后,过滤,测定滤液中木脂素的质量浓度,计算解吸液中木脂素含量。
1.2.5 最适大孔树脂动态吸附-解吸的正交试验优化 根据大孔树脂静态吸附-解吸试验结果选择2.12 mg/mL 样品为上样液、80%乙醇为洗脱剂进行动态吸附-解吸条件考察。以下试验均采用湿法装柱于Φ15 mm×200 mm玻璃层析柱中。
(1) 上样量:精密量取浓度为2.12 mg/mL的樟叶木脂素提取液8 BV,以1 mL/min 的上样速率经过树脂柱,以1 BV 为单位分段收集流出液。按照1.2.2中方法测定流出液中木脂素浓度,绘制泄露曲线。其中,横坐标为流出液体积,纵坐标为木脂素质量浓度,由泄露点[19]来确定其最大上样量。
(2) 上样流速:精密量取6 BV 浓度为2.12 mg/mL 的樟叶木脂素粗提液5份,分别以0.5,1.0,1.5,2.0,2.5 mL/min 上样速率进行动态吸附,待吸附完全,以10 mL 为单位收集流出液,按照1.2.2中方法测定流出液中木脂素浓度,计算树脂的吸附量。
(3) 洗脱速率及洗脱剂用量:将质量浓度为 2.12 mg/mL 樟树叶木脂素粗提液以1.5 mL/min的速率上样,待吸附完全,先用7 BV 去离子水洗脱,再用体积分数为 80%乙醇溶液分别以1,2,3,4,5 BV/h速度进行解吸附洗脱,以1 BV 为单位分段收集解吸附液,按照1.2.2中方法测定解吸液中木脂素质量浓度,以洗脱体积为横坐标,洗脱速率为纵坐标绘制洗脱曲线。
(4) 正交试验:由于动态试验更能真实地反映大孔树脂对木脂素的吸附-解吸过程,因此在单因素试验的基础上,采用正交试验优化大孔树脂动态吸附-解吸过程。
1.2.6 木脂素得率及纯度测定 参照文献[20],根据式(5)计算样品中木脂素得率。
(5)
式中:
P1——木脂素得率,%;
C2——解吸液中木脂素质量浓度,mg/mL;
V2——解吸液体积,mL;
C0——吸附前溶液中木脂素质量浓度,mg/mL;
V0——吸附前溶液体积,mL。
2 结果与分析
2.1 大孔吸附树脂筛选
2.1.1 不同大孔吸附树脂静态吸附与解吸性能 由表2可知,X-5、AB-8、D101型3种大孔树脂的吸附及解吸性能均优于其他3种,但是从X-5、AB-8、D101型3种大孔树脂的吸附及解吸情况来看,3种树脂的静态吸附及解吸性能比较相近,因此,需要进一步考察3种树脂动态吸附及解吸性能,从而选出最适合纯化樟树叶木脂素的大孔树脂。
2.1.2 大孔吸附树脂(X-5、AB-8、D101)动态吸附-解吸性能 由图1可知,X-5、AB-8、D101型3种大孔树脂的吸附率差异不显著,但是AB-8型大孔树脂的解吸率明显高于其他2种,可能是该树脂的极性与木脂素分子极性更相近,综合考虑,大孔树脂AB-8型为最优纯化材料。
2.2 大孔吸附树脂(AB-8型)静态吸附-解吸试验结果分析
2.2.1 大孔吸附树脂静态吸附-解吸动力学曲线 由图2可知,樟树叶中木脂素吸附量和解吸量分别在8,10 h 后增加缓慢,基本达到平衡,说明该大孔树脂吸附、解吸时间较长。
2.2.2 上样液质量浓度对吸附性能的影响 图3表示上样浓度对大孔树脂吸附率的影响。由图3可知,随着样品浓度的增加,大孔树脂的吸附率呈现上升趋势,可能是浓度较低时,樟树叶提取液中木脂素分子可以与树脂充分接触,使其快速扩散至树脂内部而被吸附;当上样液的浓度为2.12 mg/mL时,吸附性能最好,吸附率最大,之后随浓度增加大孔树脂对木脂素的吸附能力略有下降,可能是上样液质量浓度太高时使得树脂内部的提取液中分子扩散受到抑制,导致树脂的吸附量缓慢下降,也有可能随上样液浓度增加其中所含杂质也增多,树脂吸附杂质的量也增加使其吸附性能下降[21]。故选择浓度为2.12 mg/mL 的木脂素溶液进行上样。
表2 6种树脂吸附及解吸性能†
Table 2 Adsorption and desorption capacity of six macroporous resins towards lignans (n=3)

树脂型号比吸附量/(mg·g-1)吸附率/%比解析量/(mg·g-1)解吸率/%X-512.04±2.62ac74.10±4.7ab8.41±0.68b71.35±1.87ac AB-813.23±1.94a77.09±3.62a11.06±1.61a74.45±1.97a D10112.34±2.44ac70.81±2.32b9.24±0.96b70.37±2.13ac NKA-96.72±1.14d38.61±2.78d3.87±1.17c50.37±3.63d HPD7207.28±1.21bd45.49±3.03c4.23±0.48c54.26±2.69bd HPD6004.24±0.76d21.45±1.79e1.30±0.33d31.26±2.75f
† 同列中不同字母代表差异性显著(P<0.05)。
2.2.3 乙醇体积分数对解吸性能的影响 由图4可知,乙醇体积分数较低时,大孔树脂的解吸率也很低,随乙醇体积分数增大,解吸率逐渐上升即解吸液中木脂素的含量随之增大,当乙醇体积分数为80% 时,解吸液中木脂素含量最高,继续增加乙醇浓度,木脂素含量呈下降趋势。这可能是由于木脂素分子利用氢键作用力吸附在大孔树脂上,乙醇体积分数的提高加大了对氢键的破坏,所以解吸率随着升高[22]。当乙醇体积分数超过80% 后,由于乙醇溶液与木脂素极性差异导致吸附在树脂上的木脂素得不到充分溶解,所以解吸率呈下降趋势。因此,选择体积分数为80% 的乙醇溶液进行洗脱。
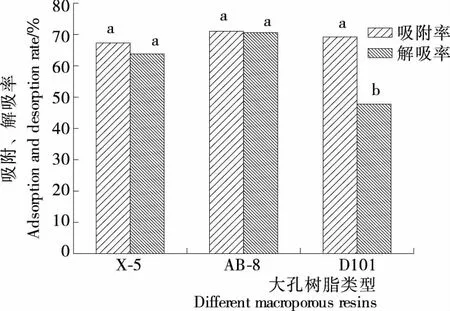
不同字母代表差异性显著(P<0.05)图1 X-5、AB-8、D101型大孔树脂动态吸附、解吸性能
Figure 1 The capacity of dynamic adsorption and desorption of X-5, AB-8 and D101 macroporous resins towards lignans (n=3)

图2 AB-8型大孔树脂静态吸附-解吸动力学曲线
Figure 2 The kinetic curve of static adsorption and desorption of AB-8 macroporous resin (n=3)
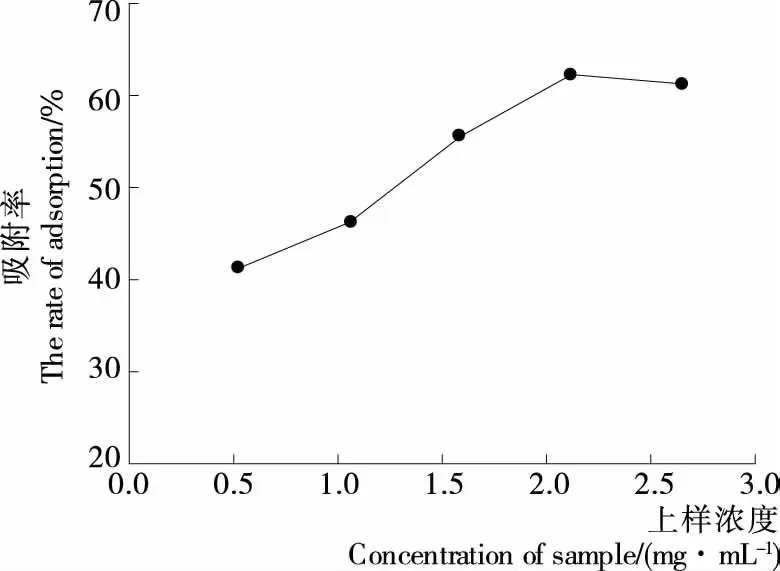
图3 上样液质量浓度对吸附性能的影响Figure 3 Inuence of sample concentration on the adsorption efficiency (n=3)
2.3 大孔吸附树脂(AB-8型)动态吸附及解吸优化结果
2.3.1 上样量的考察 由图 5可知,当对提取液进行上样吸附时,随着上样量的增加,收集的流出液中木脂素浓度随之增大,当流出液体积达到 6 BV 时,木脂素浓度达到 0.21 mg/mL,约为上样液浓度的10%,即达到泄露点[23],因此确定最大上样量为 6 BV左右最适。
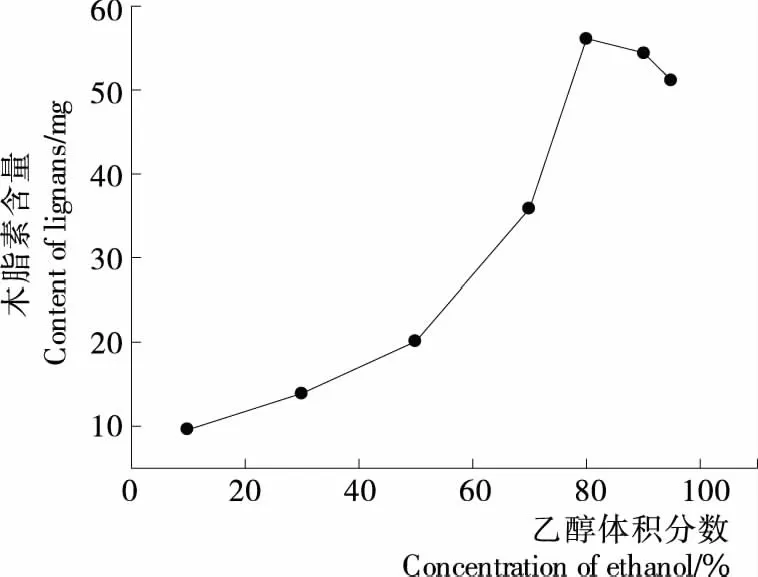
图4 乙醇体积分数对解吸效果的影响Figure 4 Inuence of ethanol concentration on the adsorption efficiency (n=3)
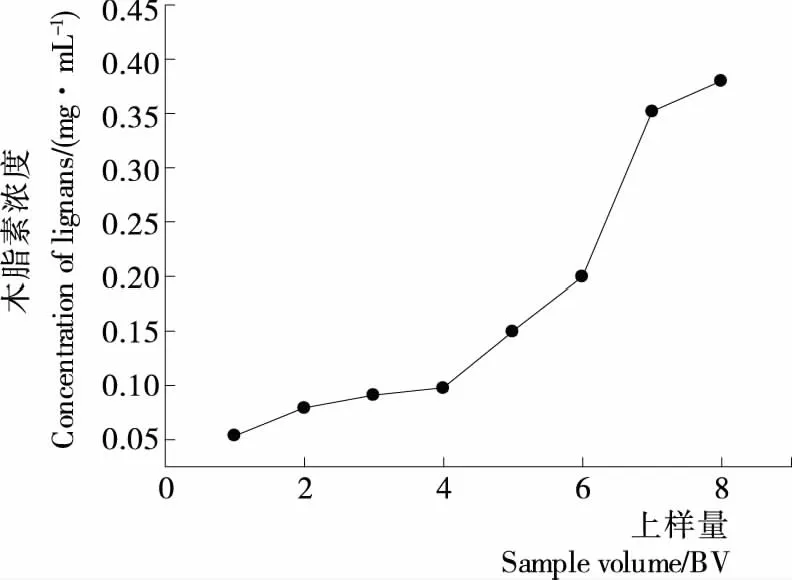
图5 泄露曲线Figure 5 The divulge curve (n=3)
2.3.2 上样速率考察 由图6可知,流出液中木脂素浓度随上样速度增加而上升。原因是流速主要影响提取液中溶质分子向树脂表面扩散,当流速过大时,粗提液中的分子还没来得及被树脂吸附,就已经流出层析柱;而流速较慢时,溶液中的木脂素分子可以和树脂充分接触,吸附率较高,但如果流速过慢,会使过柱时间过长[24]。综合考虑,以1.5 mL/min 速率进行上样。
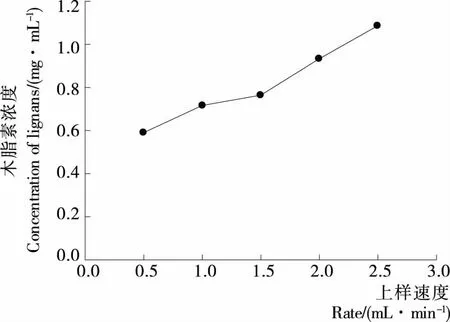
图6 上样速度对吸附性能影响Figure 6 Inuence of sample loading ow rate on the adsorption efficiency (n=3)
2.3.3 洗脱速率及洗脱剂用量考察 由图7可以看出,洗脱流速对大孔树脂洗脱效果影响较明显,流速较慢时,樟树叶木脂素洗脱峰相对集中;流速越快,洗脱峰越宽,拖尾现象越明显,导致洗脱剂体积增加[25]。而实际应用中洗脱流速过慢会延长解吸时间,综合考虑,选择2 BV/h左右进行后续试验考察。由此流速条件下洗脱曲线图可以确定洗脱体积在8 BV 比较合理。
2.3.4 正交试验优化结果分析 根据单因素试验结果,选取上样量、上样速率、洗脱速率及洗脱剂用量4 个因素,每个因素考察4 个水平,进行L16(45)正交试验,以80% 乙醇溶液洗脱木脂素得率以及纯度作为评价标准,正交试验因素水平见表3。
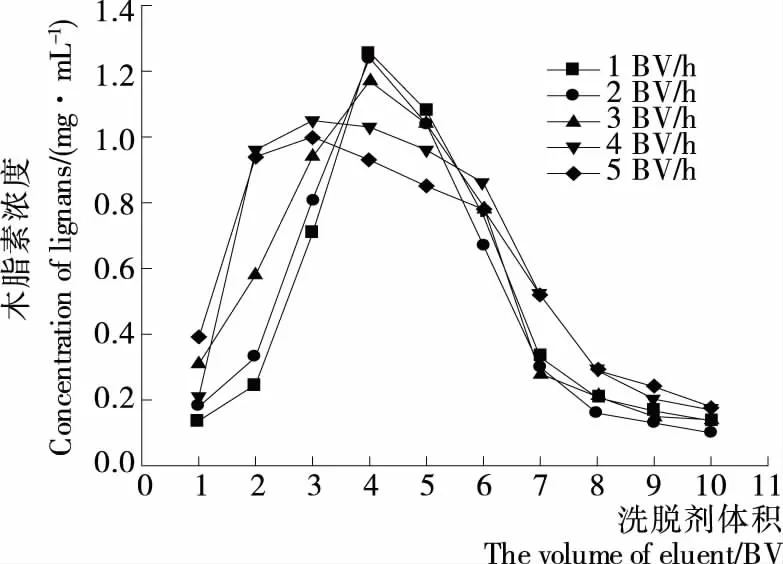
图7 解吸流速对洗脱效果的影响Figure 7 The effect of different desorption velocity on desorption efficiency (n=3)
由表4可知,各因素对木脂素得率影响程度为:上样量>洗脱剂用量>上样流速>洗脱流速。AB-8型大孔树脂纯化过程中影响木脂素纯度的因素为:上样量>洗脱流速>洗脱剂用量>上样流速,通过测定木脂素得率及纯度发现各因素对AB-8型大孔树脂的吸附-解析能力影响程度不同,其中,上样量对其纯化效果影响较大。
以木脂素纯度为指标考察各因素对AB-8型大孔树脂纯化效果,通过比较各影响因素的均值可知,A因素的第4水平较好,B、C和D 因素分别是第1、2、3 水平较好,得出AB-8型大孔树脂的动态吸附-解吸最佳纯化工艺条件为A4B1C2D3;而以木脂素得率为指标考察各因素对AB-8型大孔树脂纯化效果可以得出最佳纯化工艺条件为A4B2C1D3。高纯度的木脂素产品市场应用范围更广,获得的经济效益更高,而高得率木脂素可减少其在提取纯化过程中的损失量,降低成本。综合考虑木脂素得率和纯度,选择纯化工艺最优条件为A4B1C2D3,即上样量7 BV、上样速率1.0 mL/min、洗脱流速2 BV/h,洗脱剂用量8 BV。
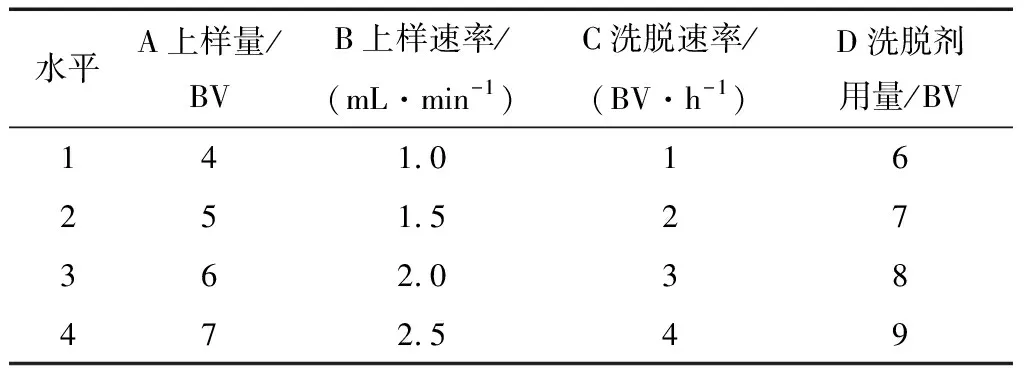
表3 正交试验因素水平表Table 3 Factors and levels of the experiment
表4木脂素动态吸附-解吸正交试验设计及结果
Table 4 Orthogonal array design and results for optimization of dynamic adsorption and desorption of lignans

序号ABCDE空列P1得率/%P2纯度/%11233262.5011.07 22412259.289.11 33434353.117.86 44211365.8215.65 51314451.119.02 62131457.699.83 73113167.1315.85 84332161.5411.56 91142358.2910.97 102323356.3412.67 113341254.3811.42 124124266.4116.82 131421158.2811.43 142244152.239.65 153222457.6811.33 164443467.3315.29 纯度K110.6213.3712.4112.0812.12K210.3211.9313.0610.7412.11K311.6211.1710.0613.7211.79K414.8310.9211.8310.8411.37R14.212.453.002.980.75 得率K157.5562.3860.8459.0459.80K256.3859.5759.6859.2060.65K358.0855.8458.7263.3358.39K465.2859.5058.0655.7258.45R28.906.542.187.162.26
2.3.5 树脂最佳工艺条件验证实验 通过静态吸附、解吸试验以及正交优化AB-8型大孔树脂动态吸附、解吸条件,得到最佳纯化工艺条件为:上样量7 BV,上样浓度2.12 mg/mL,上样流速1.0 mL/min,洗脱剂乙醇体积分数80%,洗脱流速2 BV/h,洗脱剂用量8 BV,在此条件下进行3次平行实验,得木脂素得率分别为69.79%,67.68%,62.58%,平均得率为66.68%;纯度分别为15.89%,18.57%,13.28%,平均纯度为15.91%。结果表明该工艺条件可靠。
3 结论
本试验首先对 6种大孔吸附树脂进行比较,最终确定 AB-8型大孔吸附树脂为樟树叶中木脂素纯化的最佳材料。然后,通过静态吸附-解吸、动态吸附-解吸单因素试验以及正交试验得到该工艺的最佳纯化条件,并在最优条件下测得木脂素得率和纯度分别为66.68%,15.91%,较纯化前木脂素含量明显提高,说明优化确定的工艺参数可行,为樟树叶中木脂素的工业化生产以及研究提供一定理论依据。
目前,虽然大孔吸附树脂技术应用广泛,但是在工业化生产中,单独使用此技术可能使得分离纯化效果不理想,因此将大孔吸附树脂与其他新技术如超临界流体萃取、微滤法等相结合成为今后分离纯化技术发展的一种重要趋势。另外,由于大多数树脂为人工合成,在使用过程中会将一些有机残留物混入到产物中,影响产物的安全性[26],因此,有必要开发一些安全高效的新型树脂。
[1] SINGH R, JAWAID T. Cinnamomum camphora, (Kapur): Review[J]. Pharmacognosy Journal, 2012, 4(28): 1-5.
[2] 良武, 赵振东. 樟树植物资源分布及化学成分研究进展[J]. 天然产物研究与开发, 2017(3): 517-531.
[3] MO Jian-guang, YANG Yi-lin, HUANG Zhi-biao, et al. Study on variations of content and main constituent of essential oil from stem and leaf of linalool-type Cinnamomum camphora (Linn.) Presl in Guangxi Province[J]. Chemistry & Industry of Forest Products, 2010, 30(2): 72-76.
[4] HSIEH T J, CHEN Chung-yi. Lignans from the stem of Cinnamomum camphora[J]. Natural Product Communications, 2006, 1(1): 21-25.
[5] 张国良, 李娜, 林黎琳, 等. 木脂素类化合物生物活性研究进展[J]. 中国中药杂志, 2007, 32(20): 2 089-2 094.
[6] TSOPMO A, AWAH F M, KUETE V. 12-Lignans and stilbenes from african medicinal plants[J]. Medicinal Plant Research in Africa, 2013: 435-478.
[7] 程丽姣, 丁羽佳, 翟永功, 等. 119植物中新的木脂素类化合物及其生物活性[J]. 现代药物与临床, 2006, 21(3): 93-100.
[8] SALEEM M, KIM H J, ALI M S, et al. An update on bioactive plant lignans[J]. Natural Product Reports, 2005, 22(6):696-716.
[9] MACRAE W D, TOWERS G H N. Biological activities of lignans[J]. Phytochemistry, 1984, 23(6): 1 207-1 220.
[10] 高春花, 钟海雁, 孙昌波. 五味子木脂素提取分离纯化和含量测定的研究进展[J]. 食品与机械, 2007, 23(1): 151-155.
[11] 罗艳玲, 欧仕益. 大孔树脂在食品活性成分分离中的应用[J]. 食品与机械, 2005, 21(5): 81-83.
[12] 樊勇勇, 郑琦, 顾金凤, 等. 大孔树脂吸附技术及其应用[J]. 化工设计通讯, 2017, 43(3): 147-148.
[13] 陈晓宇, 田振坤, 高翔, 等. 大孔树脂纯化五味子木脂素及其体外还原能力研究[J]. 辽宁中医药大学学报, 2017(4): 39-42.
[14] 雷艳萍. 雪松松针木脂素的提取纯化及其体外抗肿瘤活性研究[D]. 兰州: 甘肃中医药大学, 2016: 20-26.
[15] 夏云麒. 樟叶中木脂素的提取及活性研究[D]. 福州: 福建农林大学, 2011: 18-29.
[16] 马艺丹, 刘红, 马思聪, 等. 神秘果种子多酚大孔树脂纯化工艺研究[J]. 食品与机械, 2016, 32(2): 139-144.
[17] 邵晶, 郭玫, 任远, 等. 大孔树脂富集纯化牛蒡子中木脂素的工艺研究[J]. 中药材, 2016, 39(10): 2 306-2 309.
[18] 郑晓珂, 郭永慧, 王彦志, 等. 正交设计优选马尾松松针中总木脂素提取工艺[J]. 中药材, 2010, 33(3): 467-469.
[19] 袁英姿, 曹清明, 钟海雁, 等. 大孔吸附树脂纯化油茶籽多酚的研究[J]. 食品与机械, 2009, 25(1): 61-63.
[20] 李适, 岳明珠, 李银花, 等. 正交试验优化葛根素的大孔树脂纯化工艺[J]. 食品科学, 2013, 34(16): 89-92.
[21] 刘硕谦, 刘仲华, 黄建安, 等. 大孔吸附树脂分离富集水皂角多酚[J]. 食品科学, 2004, 25(3): 55-60.
[22] 沈佩仪, 徐金龙, 李俶, 等. 菠萝皮中总多酚的纯化工艺研究[J]. 食品与机械, 2012, 28(2): 139-141.
[23] 王明鉴, 张凌, 乔雪童, 等. 大孔树脂法纯化姜黄素的工艺优化[J]. 中国调味品, 2015, 40(5): 39-45.
[24] 宫江宁, 饶玉, 杨义菊, 等. 大孔树脂吸附纯化黔产龙胆草多糖工艺优化[J]. 食品与机械, 2017, 33(5): 178-181.
[25] 李斌, 高凝轩, 刘辉, 等. 大孔树脂纯化黑果腺肋花楸多酚的工艺优化[J]. 食品科学, 2016, 37(16): 69-74.
[26] MIN Hui-zhong, MENG Shu-xian, FENG Ya-qing, et al. Determination of organic residues in macroreticular resin[J]. Chemical Industry and Engineering, 2010, 27(3): 229-232.

