PI3k/AKT信号通路在宫内发育迟缓新生大鼠海马组织中的表达及意义
,,
(长沙市妇幼保健院儿科,湖南 长沙 410000)
宫内发育迟缓(Intrauterine growth restriction,IUGR)指新生儿出生体重低于同胎龄同性别平均出生体重的两个标准差。美国每年IUGR 新生儿出生率在5%~7% 左右[1]。IUGR不仅可导致围产期死亡率增加,且患儿易罹患神经功能障碍、胰岛素抵抗、肾病等疾病[2]。对于IUGR 的神经发育障碍的原因,内分泌异常为其研究热点[3]。磷脂酰肌醇3-激酶(Phosphatidylinositol 3 kinase,PI3K)/ 蛋白激酶B(protein kinase B,又称AKT)信号通路是机体内最重要信号传导通路之一,PI3K/AKT途径在中枢神经系统可参与神经元增殖、迁移、凋亡等多种生理功能的调节[4-5]。HU等[6]证实PI3K的p110δ亚基失活模型母鼠其胎儿可表现为IUGR,PI3K-AKT信号途径在IUGR发病机制中起着重要作用。本实验采用低蛋白营养不良法制作IUGR新生大鼠模型,以探索PI3K/AKT信号通路在IUGR神经系统发育过程中的作用。
1 材料与方法
1.1实验分组及模型的建立取健康2月龄Sprague-Dawley(SD)大鼠24 只,雌雄各半,体重250 g 左右,按照雌雄1∶1 的比例置于同一笼中交配,次日清晨检测出阴栓者定为受孕成功。根据随机数字表,将12只孕鼠随机分配到正常蛋白饲料对照组(对照组)、低蛋白饲料组(IUGR组),每组6只孕鼠。对照组母鼠自受孕后第1天开始给予21%正常蛋白饲料喂养,建立正常出生体重仔鼠模型,所生仔鼠纳入对照组。IUGR组母鼠自孕后给予10% 低蛋白饲料喂养,建立IUGR仔鼠模型,所生仔鼠为IUGR模型组。两组仔鼠出生后母鼠均给予21%正常蛋白饲料及正常饮用水喂养。
1.2标本留取两组新生大鼠分别于生后24 h内及出生后1周时处死,用10% 水合氯醛(0.35 mL/0.1 kg)腹腔注射麻醉后处死。迅速断头,剖颅取大脑组织,分离左侧脑组织,用于苏木精-伊红(Hematoxylin-eosin,HE)染色。另一部分同上法开颅取脑,用于Western blot 和RT-PCR检测。
1.3 HE染色在海马层面(冠状位的视交叉的前后1 mm)取材,每个动物取3 张切片,间隔取片,切片厚5 μm,经常规脱蜡水化后,苏木素染色5 min,盐酸酒精分化,自来水冲洗,伊红染色2 min。脱水、透明、封片。
1.4 Western blot 取海马组织用RIPA 细胞裂解液研磨裂解并离心,取上清液测蛋白浓度。样本经 SDS-PAGE电泳分离后转移至硝酸纤维素滤膜上,经5%脱脂奶粉PBST 溶液室温下封闭2 h后分别加入一抗(PI3K,AKT抗体均购于CST公司,美国)、二抗孵育。洗膜后加ECL 发光试剂曝光、显色。应用β-actin 作为内参照,结果以目的蛋白与内参蛋白表达比值表示。
1.5实时定量PCR 利用Trizol 萃取液(Invitrogen 公司,美国)对出生24 h内及出生7 天的海马RNA 组织进行分离。使用逆转录试剂盒(Takara 公司,日本)进行逆转录反应。该反应首先在37 ℃孵育60 min,然后再85 ℃ 5 s(变性、退火反应)。实时聚合酶链反应在以下条件下进行两次:95 ℃30 s,然后 95 ℃ 5 s,60 ℃ 30 s,共40 个周期循环。β-actin作为阴性对照。使用2-ΔΔCT法计算倍数变化。
1.6统计学分析统计分析使用SPSS 17.0软件。计量资料以均数±标准差表示,两组均值的比较使用两独立样本t检验,P<0.05为差异有统计学意义。
2 结 果
2.1两组仔鼠出生体重、生后脑重的比较给予限制性蛋白饮食孕鼠所生产的仔鼠出生体重(IUGR组) 符合IUGR 的诊断标准(IUGR组仔鼠vs 对照组仔鼠出生体重:5.33±0.47 gvs6.85±0.62 g)(图1A)。在出生24 h内,IUGR 组仔鼠平均脑质量较对照组仔鼠低19%左右(0.21±0.04 gvs0.27±0.06 g,P<0.05);而在7天时,IUGR组仔鼠脑质量较对照组仔鼠低12%左右(0.64±0.09 gvs0.73±0.11g,P<0.05)(图1B)。而在出生21天(3周)及56天(8周)时两组无明显区别。
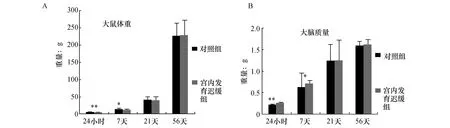
图1 两组大鼠出生不同时间点体重及大脑质量(n=8)与宫内发育迟缓组比较,*P<0.05,**P<0.01
2.2两组仔鼠海马HE 染色结果比较 在出生24 h内,对照组仔鼠海马锥体细胞层较厚,细胞密度紧密,排列整齐;IUGR 组仔鼠海马锥体细胞层较薄,细胞间隙大,排列疏松(图2A、B)。在出生7天时,两组差异无显著性(图2C和D)。

图2 出生24h及7天对照组及IUGR组仔鼠海马HE染色结果 (200×) 箭头指示锥体细胞层A:出生24h时对照组仔鼠,海马锥体细胞层厚,细胞密度大,排列整齐;B:出生24h时IUGR组仔鼠,海马锥体细胞层变薄,细胞间隙大,排列疏松;C,D:出生7天对照组及IUGR组仔鼠海马HE染色结果
2.3 Western blot和RT-PCR法检测各组大鼠海马PI3K, AKT的表达水平在新生大鼠出生24 h内,与对照组相比较,IUGR组大脑海马的 AKT和PI3K mRNA的表达水平明显升高(均P<0.05)。IUGR组的 Akt和PI3K 蛋白表达水平明显高于对照组(均P<0.05)(图3A,C和D)。
在仔鼠出生7天时,与对照组相比较,IUGR组的 AKT的蛋白和mRNA的表达水平明显升高(均P<0.05)。IUGR组的 PI3k 的mRNA表达水平明显高于对照组(均P<0.05),但蛋白表达水平在两组间无明显区别(图3E和F)。
3 讨 论
近年来,对于IUGR患儿的神经发育异常越来越受到人们的关注。LAURA等[7]通过对8个月到4岁之间的3 922名IUGR患儿和29 369名的正常儿童进行随访发现,IUGR患儿的神经发育障碍的几率明显增加。BELLIDO-GONZLEZ等[8]对5 720名6~8岁的儿童研究发现,IUGR患儿的认知能力及学习成绩明显低于正常儿童。对IUGR患儿的神经发育异常,在头颅影像上最直观表现为IUGR患儿大脑体积及神经细胞数量较正常儿童的减少。在猪,大鼠等动物模型中已证实IUGR模型大脑神经细胞数量明显减少,利用MRI三维成像等技术研究人IUGR大脑发育发现,IUGR患儿的大脑皮质较正常儿童减少10%左右,其中灰质减少更加明显,海马、丘脑及基底节等部位也明显减少[9]。同时SAMUELSEN等[10]研究发现 IUGR人类胎儿大脑皮质细胞总数小于正常胎儿。在本实验中,IUGR仔鼠大脑的重量及海马锥体细胞密度较对照组明显减少,与上述研究结果相符。
内分泌信号通路异常参与IUGR发病的具体机制为通过控制机体内代谢产物或代谢状态导致目的物质的合成发生改变,并导致机体功能改变,最终导致IUGR的产生[11]。目前研究表明在IUGR患儿体内胰岛素抵抗(Insulin resistance,IR )是这些异常的内分泌信号通路共同的病理生理基础[12]。在人体内许多信号通路可诱发IR,尤以胰岛素作用相关的信号通路PI3K/AKT通路分子最为重要。PI3K不仅具有脂类激酶活性,而且拥有蛋白激酶的活性。PI3K 激活后可以使细胞膜上的肌醇发生磷酸化,继而产生第二信使,AKT是 PI3K 信号通路主要下游分子。AKT磷酸化激活后参与多条信号转导途径,最终产生促进细胞增殖和阻止细胞凋亡发生等一系列生理功能[13]。PI3K/AKT信号途径紊乱已经在IUGR动物模型及临床实验中已被证实。动物模型已经证实PI3K/AKT在IUGR机体肝脏及肾脏内的异常表达[14]。PI3K、AKT及其受体在脑内表达相当丰富,大脑海马、大脑皮质及小脑内的神经元及星形胶质细胞内均有大量表达;PI3K/AKT信号通路已被证实在正常的大脑发育及人神经系统疾病中发挥着至关重要的作用,PI3K/AKT信号途径异常可影响神经元及胶质细胞的增殖、分化等过程[15]。在本实验中海马出生1天时及7天时PI3K、AKT蛋白表达明显升高,推测其可能机制为:机体在摄入蛋白质减少时,同时也会影响葡萄糖等代谢;由于机体存在大脑保护机制,此时PI3K/AKT通路过度激活,进而促进了葡萄糖转运蛋白2 向膜的转运,使神经细胞对葡萄糖的摄取增多,最终保护大脑神经细胞受损。这同时使神经细胞对胰岛素刺激的反应能力增加,从而促进IR的发生。由于出生24 h及7天后PI3K,AKT在两组的表达量与大脑体重、大脑形态有相对应的关系,同时基于以前研究PI3K/AKT在脑发育的作用,可以推出PI3K/AKT信号传导途径在IUGR患儿神经发育过程中起着一定的作用。

图3 PI3K及AKT在两组大鼠海马中的表达水平比较(n=8) 与对照组比较,*P<0.05,**P<0.01A,B:出生24 h和7天两组大鼠PI3K和AKT mRNA的表达结果;C,D:出生24 h内两组大鼠PI3k和AKT蛋白表达;E,F:出生7天时两组大鼠PI3K和AKT蛋白表达
综上所述,本实验证实IUGR新生大鼠大脑质量和海马形态学情况发生了改变;同时实验证实在出生24 h内和出生7天IUGR海马组织中,PI3K和AKT的表达明显上升,推测PI3k/AKT信号传导途径在IUGR患儿神经发育过程中起着一定的作用。
参考文献:
[1] SUHAG A,BERGHELLA V.Intrauterine growth restriction (IUGR):etiology and diagnosis [J].Curr Obstet Gynecol Rep,2013,2(2):102-11.
[2] SPIROSKI AM,OLIVER MH,HARDING JE,et al.Intrauterine intervention for the treatment of fetal growth restriction[J].Curr Pediatr Rev,2016,12(3):168-78.
[3] NAWATHE AR,CHRISTIAN M,KIM SH,et al.Insulin-like growth factor axis in pregnancies affected by fetal growth disorders[J].Clin Epigenetics,2016,8:11.
[4] LIU SQ,ZhANG ML,ZHANG HJ,et al.Matrine promotes oligodendrocyte development in CNS autoimmunity through the PI3K/Akt signaling pathway[J].Life Sci,2017,180:36-41.
[5] CHEN CM,LIU KT,WANG YH,et al.Andrographolide inhibits PI3K/AKT-dependent NOX2 and iNOS expression protecting mice against hypoxia/ischemia-induced oxidative brain injury[J].Planta Med,2011,77(15):1669-79.
[6] HU X,LI J,ZHANG Q,et al.Phosphoinositide 3-kinase (PI3K) subunit p110δ is essential for trophoblast cell differentiation and placental development in mouse[J].Sci Rep,2016,6:28201.
[7] LAURA L,PAWLOWSK IJ,HANSE NR.Neurodevelopmental outcome at 8 months and 4 years amongInfants born full-term small-for-gestational-age[J].J Perinatol,2004,24(8):505-14.
[8] BELLIDO-GONZALEZ M,DIAZ-LOPEZ M,LOPEZ-CRIADO S,et al.Cognitive functioning and academic achievement in children aged 6-8 years,born at term after intrauterine growth restriction and fetal cerebral redistribution[J].J PediatrPsychol,2017,42(3):345-54.
[9] PADILLA N,FALCON C,SANZ-CORTES M,et al.Differential effects of intrauterine growth restriction on brain structure and development in preterm infants:a magnetic resonance imaging study [J].Brain Res,2011,1382(25):98-108.
[10] SAMUELSEN GB,PAKKENBERG B,BOGDANOVIC N,et al.Severe cell reduction inthe future brain cortex in human growth-restricted fetuses and infants[J].Am J Obstet Gynecol,2007,197(1):56e1-e7.
[11] SHARMA D,SHARMA P,SHASTRI S.Genetic,metabolic and endocrine aspect of intrauterine growth restriction:an update[J].J Matern Fetal Neonatal Med,2017,30(19):2263-75.
[12] XIE X,LIN T,ZHANG M,et al.IUGR with infantile overnutrition programs an insulin-resistant phenotype through DNA methylation of peroxisome proliferator-activated receptor-γ coactivator-1α in rats[J].Pediatr Res,2015,77(5):625-32.
[13] RICE GB,WADHWANI NR.PI3K/AKT pathway and brain malformations[J].Pediatr Neurol Briefs,2015,29(7):52
[14] WANG Y,ZHANG L,ZHOU G,et al.Dietary L-arginine supplementation improves the intestinal development through increasing mucosal Akt and mammalian target of rapamycin signals in intra-uterine growth retarded piglets[J].Br J Nutr,2012,108(8):1371-81.
[15] 杨湘怡,陶润知,聂亚雄.mTOR依赖的自噬通路与神经变性疾病[J].中南医学科学杂志,2014(2):191-5.

