银杏花粉黄酮组分分离纯化及其清除DPPH自由基能力
裘纪莹,陈相艳,闫慧娇,王岱杰,陈蕾蕾※
(1. 山东省农业科学院农产品研究所/山东省农产品精深加工技术重点实验室/农业部新食品资源加工重点实验室,济南 250100;2. 山东省分析测试中心/山东省中药质量控制技术重点实验室,济南 250014)
0 引 言
银杏花粉是银杏(Ginkgo biloba L.)雄株的花粉,富含蛋白质、维生素和矿物质等营养成分,最新研究显示,银杏花粉中24种游离氨基酸的质量分数为62.316 mg/g,钾离子的质量分数高达 26.301 mg/g[1]。同时,银杏花粉含有黄酮、萜内酯、多糖等活性成分[2-3],黄酮类化合物的质量分数约为 21.4 mg/g[4]。而且,银杏花粉对小鼠没有急性毒性作用,安全性高并且具有潜在的免疫增强作用[5]。所以,银杏花粉具有广阔的开发利用价值。
目前对银杏花粉的研究主要参考银杏叶的研究成果。银杏叶的主要药效成分为黄酮类和萜内酯类化合物[6-7],故学者对银杏花粉的黄酮和内酯含量进行了检测,检测方法和指标也参考了银杏叶的方法[8]。银杏花粉的总黄酮含量高,黄酮苷元主要为山奈酚,而银杏叶黄酮苷元主要为槲皮素,这意味着银杏花粉的黄酮成分和银杏叶有较大差异。然而,由于目前银杏花粉的化学成分研究还处于起步阶段,在分析银杏花粉黄酮组分时往往参考银杏叶的研究成果,如文献报道芦丁在银杏叶中的质量分数高达2 200 μg/g[9],所以徐澄梅等[10]对银杏花粉的芦丁进行了测定,结果显示芦丁在银杏花粉中的质量分数仅为120.9 μg/g,不到银杏叶的6%。因此,通过参考银杏叶的主要黄酮组分来研究银杏花粉黄酮的意义不大,有必要对银杏花粉的黄酮类化合物进行系统地分离纯化。
基于DPPH-HPLC-DAD/PAD的液相色谱分析技术是一种从复杂样品中快速筛选抗氧化组分的检测技术,在中国植物、中药等的抗氧化物质快速筛选和鉴定方面有广泛应用[11]。制备型液相色谱技术是目前发展迅速的一种快速分离纯化技术,该技术在分析型高效液相色谱技术的基础上发展而来,具有上样量大,分离度和灵敏度高,分离速度快和目标化合物纯度高等特点,是实验室分离纯化未知化学组分的优选手段[12]。将 DPPH-HPLCDAD/PAD筛选技术和制备型液相色谱制备技术结合使用,有利于针对性地分离纯化出具有潜在抗氧化活性的黄酮组分。
本文首先对银杏花粉的总黄酮进行提取和分步萃取,并通过 DPPH自由基清除能力检测和组分分析锁定拟进一步分离纯化的萃取相。然后通过DPPH-HPLC-PAD技术对萃取相进行潜在抗氧化活性组分的筛选,并采用制备型液相色谱技术分离纯化这些目标组分,并进行结构鉴定。最后初步研究了分离组分的清除 DPPH自由基能力,以期为银杏花粉功能成分的深入研究奠定扎实的基础。
1 材料与方法
1.1 材料与仪器
银杏花粉:采自山东郯城,选取3棵100 a左右树龄的银杏雄树,在花穗成熟前3~5 d采集花穗。20 ℃干燥2~3 d,每天翻动2~3次。花粉完全散出后过100目筛,过筛花粉收集后置于干燥容器中-20℃冷冻密封保存;DPPH(1,1-二苯基-2-三硝基苯肼)购于美国 Sigma-Aldrich 公司;山奈酚对照品(纯度≥98%),购于山东省中药化学对照品/标准品工程技术研究中心;乙腈为色谱纯,甲醇、无水乙醇、石油醚、乙酸乙酯、正丁醇、冰醋酸均为分析纯。
XO-SM100超声微波组合反应系统,南京先欧仪器制造有限公司;Mettler AE240电子分析天平,精确到0.000 1 g,梅特勒-托利多仪器(上海)有限公司;CR22GⅢ高速冷冻离心机,日本日立公司;Agilent 1260高效液相色谱仪,美国Agilent公司;LC-6AD制备色谱仪,美国 Shimadzu公司;Agilent 6520 Accurate-Mass Q-TOF LC/MS液相色谱-质谱联用仪,美国 Agilent公司;Varian-600兆核磁共振仪,美国 Varian公司;Milli-Q Academic超纯水系统,电阻率18.2 MΩ,美国Millipore公司;R-230旋转蒸发仪,瑞士Buchi公司;UV-160型紫外可见分光光度计(日本Shimadzu公司)。
1.2 试验方法
1.2.1 银杏花粉黄酮的提取和分步萃取
采用微波法进行提取[13],提取液于13 000 r/min离心10 min,收集上清液后抽滤2次,滤液经旋转蒸发仪去除乙醇并浓缩,然后冷冻干燥得到银杏花粉黄酮粗提物。该粗提物采用适量蒸馏水分散,并依次用等体积的石油醚、乙酸乙酯和正丁醇各萃取3次,合并3次萃取液,经旋转蒸发浓缩、冷冻干燥得银杏花粉黄酮石油醚相、乙酸乙酯相、正丁醇相和水相萃取物。
1.2.2 DPPH自由基清除能力评价
测定方法参照文献报道[13],根据结果计算样品的DPPH清除率和半抑制率(IC50值)[14]。
1.2.3 银杏花粉黄酮粗提物和萃取相的组分分析及清除DPPH自由基组分筛选
取银杏花粉黄酮粗提物及石油醚相、乙酸乙酯相、正丁醇相和水相萃取物,采用分析型高效液相色谱(Agilent 1 260,HPLC)进行组分分析,分析柱采用Agilent SB-C18 柱(4.6 mm × 250 mm,5 μm),设定柱温30 ℃,流速1 mL/min,检测波长265 nm,上样量10 μL。液相色谱梯度洗脱条件见表1。
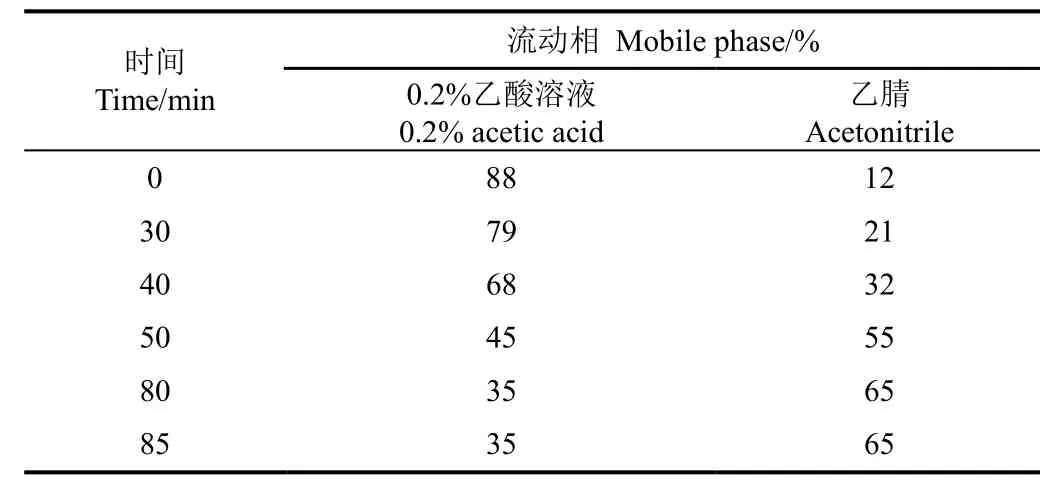
表1 分析型液相色谱流动相条件Table 1 Mobile phase conditions of analytical high performance liquid chromatography (HPLC)
清除 DPPH自由基黄酮的筛选采用 DPPH-HPLCPAD法[15],将待筛选样品与 DPPH试剂按体积比1:1进行混合、常温避光反应30 min后进行液相色谱检测,以甲醇代替 DPPH试剂作为反应前对照。液相色谱检测条件参照组分分析条件。
1.2.4 银杏花粉中清除DPPH自由基黄酮的分离纯化
采用制备型液相色谱技术(Shimadzu LC-6AD)对银杏花粉乙酸乙酯相萃取物进行分离纯化。制备柱采用YMC-C18柱(10 mm × 250 mm,5 μm),流速 3 mL/min,检测波长265 nm,样品经0.45 μm微孔滤膜过滤后进样300 μL,流动相条件见表2。

表2 制备型液相色谱流动相条件Table 2 Mobile phase conditions of preparative HPLC
1.2.5 分离组分的纯度检测和结构鉴定
采用液相色谱面积归一法进行纯度检测[16];采用紫外可见光谱、质谱、核磁共振氢谱、碳谱等进行结构检测[17-18],并通过结构解析、文献对照及标准品对照等确定分离组分的化学结构。
1.3 数据处理
试验数据均由 3 组平行取平均值计算得到,数据处理和方差分析使用SPSS 19软件。
2 结果与分析
2.1 银杏花粉黄酮的提取、分步萃取及DPPH清除能力分析
为了针对性地分离纯化具有潜在抗氧化活性的银杏花粉黄酮,对银杏花粉粗提物及石油醚相、乙酸乙酯相、正丁醇相和水相萃取物进行了 DPPH清除率测定,并计算其对DPPH的半抑制率(IC50值)。IC50值越低,说明该部位清除 DPPH的活性越高。结果显示,上述样品间IC50值具有极显著性差异(P<0.01)。银杏花粉粗提物的IC50值为1.32 mg/mL,乙酸乙酯相、正丁醇相的IC50值为0.46、0.84 mg/mL,分别是粗提物IC50值的34.85%和63.64%。水相的IC50值略高于粗提物,为1.61 mg/mL,石油醚相的IC50值最高,超过2.00 mg/mL。可见,银杏花粉粗提物具有清除 DPPH活性,并且通过分步萃取,清除DPPH活性组分在乙酸乙酯相和正丁醇相得到富集,其中乙酸乙酯相的清除DPPH活性最高。
在此基础上建立分析型高效液相色谱检测银杏花粉黄酮的方法,并检测其在乙酸乙酯相和正丁醇相中的富集情况,结果见图1。以银杏花粉粗提物中6个色谱峰各自的峰面积为“1”,计算乙酸乙酯相和正丁醇相相应化合物的相对峰面积,结果见表3。
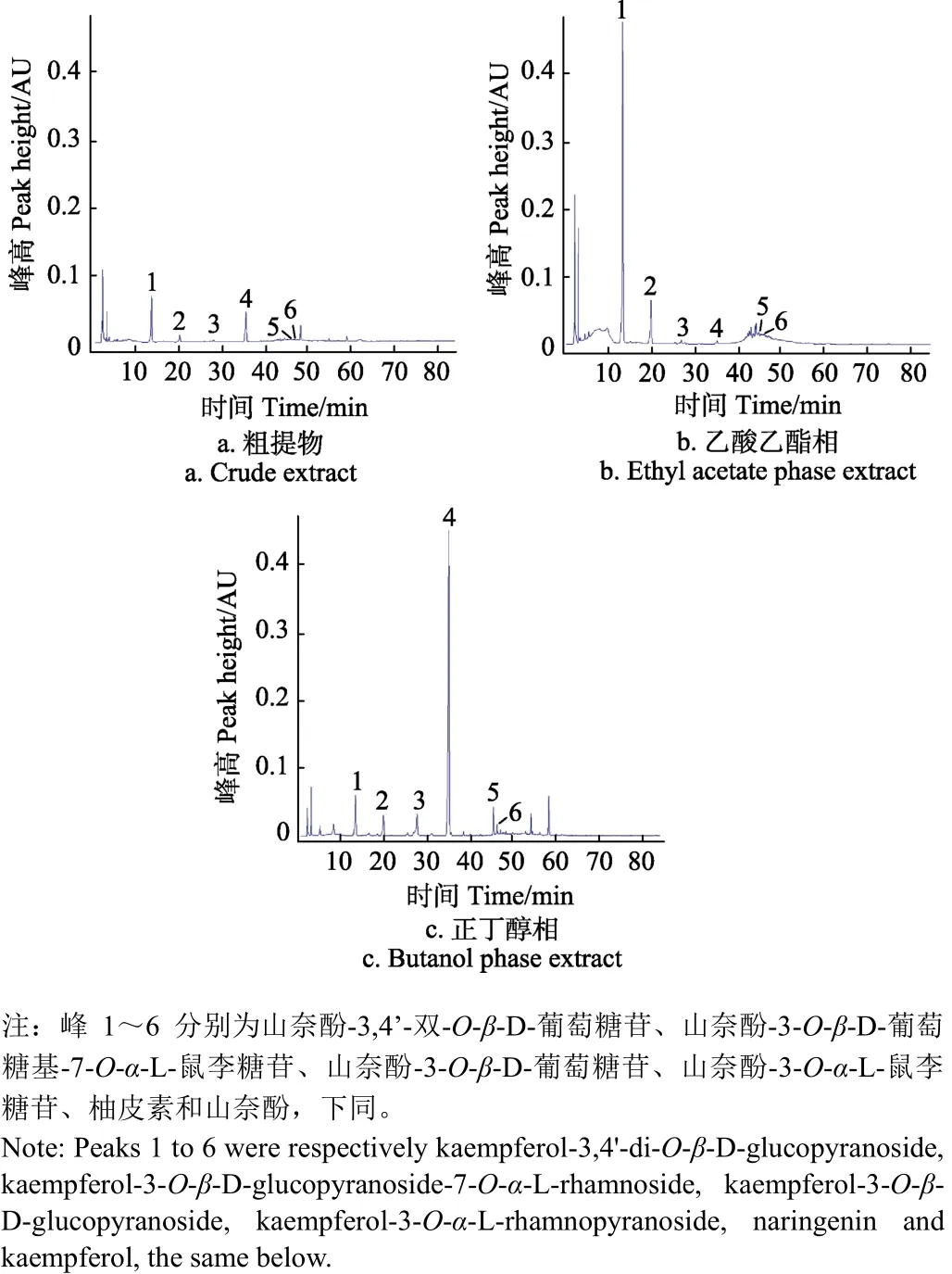
图1 银杏花粉粗提物、乙酸乙酯相和正丁醇相的液相色谱图Fig.1 Liquid chromatograms of crude extract, ethyl acetate phase extract, and butanol phase extract of Ginkgo biloba pollen
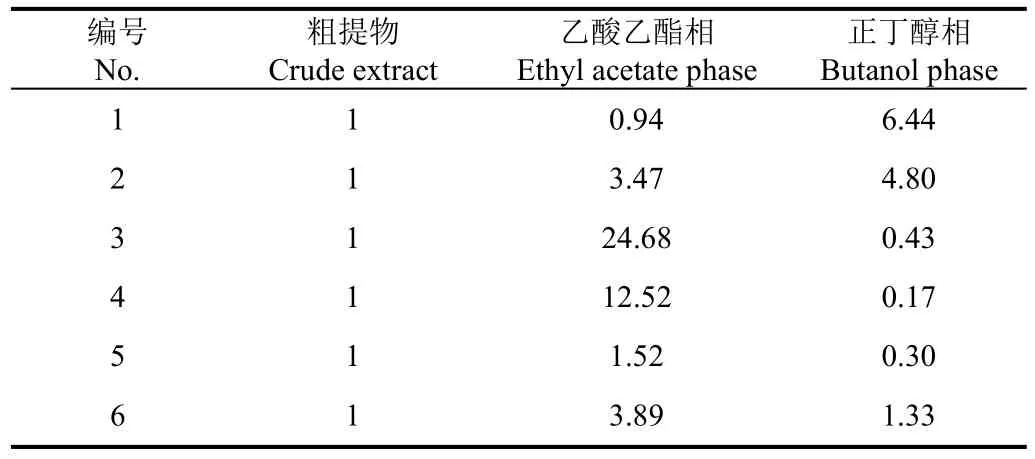
表3 银杏花粉粗提物、乙酸乙酯相和正丁醇相中化合物1~6的相对峰面积Table 3 Relative peak areas of compounds 1~6 in the crude extract, ethyl acetate phase extract, and butanol phase extract of Ginkgo biloba pollen
由图1和表3可知,银杏花粉粗提物的主要检出峰为化合物 1、2、3、4,这些化合物是后续分离纯化的重点目标物质,化合物5、6在粗提物中的含量较低。分步萃取后,在正丁醇相中化合物 1、2、6得到富集,但化合物3、4、5被大量稀释;而在乙酸乙酯相中化合物2、3、4、5、6均得到富集,尤其是化合物3、4在乙酸乙酯相分别被富集了24.68和12.52倍,化合物1在乙酸乙酯相虽未被富集,但能够达到下一步分离纯化和结构鉴定的基本要求。可见,乙酸乙酯相富集了分离纯化的主要目标物质,后续以乙酸乙酯萃取物为原料进行清除DPPH黄酮的筛选、分离和纯化。
采用DPPH-HPLC-PAD法对银杏花粉乙酸乙酯萃取物进行清除 DPPH自由基活性组分的快速筛选,结果见图2。与DPPH试剂反应后,化合物1~6的峰面积均有所下降,故这6个化合物均具有清除DPPH自由基的能力。后续对这 6个色谱峰进行制备型液相色谱的分离纯化。
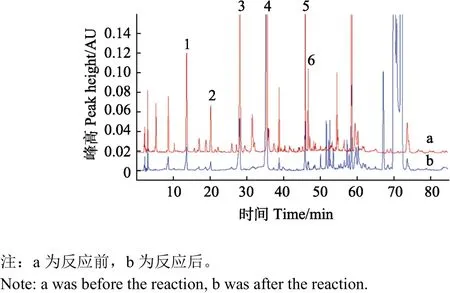
图2 银杏花粉乙酸乙酯萃取物与DPPH反应前后的色谱图Fig.2 Chromatograms of Ginkgo biloba pollen (GP) ethyl acetate phase extract based upon DPPH elimination detection.
2.2 利用制备型液相色谱分离纯化银杏花粉中清除DPPH自由基黄酮组分
由于银杏花粉粗提物的成分复杂,采用液相色谱进行组分分析和清除 DPPH自由基黄酮组分筛选时的液相色谱条件主要考虑组分间的分离度,所需的分析时间较长。而乙酸乙酯相样品杂质较少,为了提高制备效率,减少流动相用量及缩短制备周期,对制备型液相色谱的流动相梯度洗脱条件进行了优化,结果见表2,乙酸乙酯相的分离效果见图3。
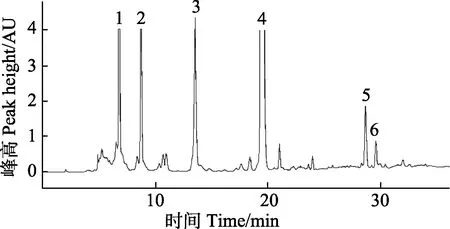
图3 化合物1~6的制备型液相色谱图Fig.3 Isolation and purification of compounds 1 to 6 by preparative liquid chromatography
由图3可见,化合物1~6在30 min内得到良好分离,在保证纯度的同时大大缩短了制备所需时间。通过色谱分离后,分别收集色谱峰1~6的洗脱液,采用水浴旋转蒸发除去乙腈,冷冻干燥后分别得到化合物1(25.0 mg,纯度>98.0%)、化合物2(8.6 mg,纯度≈85.7%)、化合物3(16.9 mg,纯度≈95.9%)、化合物4(15.1 mg,纯度>98.0%)、化合物5(13.4 mg,纯度>98.0%)和化合物6(9.16 mg,纯度>98.0%)。这些目标组分的质量和纯度满足下一步结构鉴定的要求。
2.3 银杏花粉清除DPPH自由基黄酮组分的结构鉴定
利用紫外可见光谱、质谱、核磁共振氢谱、碳谱等技术,鉴定得到了化合物1~6的化学结构,结果如下:化合物1的紫外可见光谱显示最大吸收波长(λmax)在265、340 nm,由电喷雾电离质谱(Electrospray Ionization Mass Spectrometry,ESI-MS)测定质荷比(mass-to-charge ratio,m/z)为609.1425 [M-H]-、611.1615 [M+H]+,推测分子式为C27H30O16,核磁共振(Nuclear Magnetic Resonance,NMR)显示其黄酮醇信号及2个β-D-葡萄糖信号,与6.23(1H, d, J = 1.8 Hz, H-6),6.47 (1H, d, J = 1.8 Hz, H-8)为 A环间位偶合信号,8.13 (2H, d, J = 9.0 Hz, H-2’, 6’)、7.16(2H, d, J = 9.0 Hz, H-3’, 5’)显示B环对位取代,与化合物3比较,B环数据受苷化影响,推测4’位成苷。其紫外可见光谱、质谱、核磁共振数据与 Cui等[19]的报道基本一致,故鉴定化合物1为山奈酚-3,4’-双-O-β-D-葡萄糖苷。化合物2的紫外可见光谱显示最大吸收波长(λmax)在264、314 nm,由 ESI-MS (m/z) 593.1461 [M-H]-、595.1658[M+H]+,推测分子式为 C27H30O15,NMR显示其黄酮醇信号、1个β-D-葡萄糖信号及1个α-L-鼠李糖信号,其紫外可见光谱、质谱、核磁共振数据与Kang[20]基本一致,故鉴定化合物 2为山奈酚-3-O-β-D-葡萄糖基-7-O-α-L-鼠李糖苷。化合物 3的紫外可见光谱显示最大吸收波长(λmax)在 265、349 nm,由 ESI-MS (m/z) 447.0879 [M-H]-、449.1077 [M+H]+,推测分子式为C21H20O11,NMR显示其黄酮醇信号及1个β-D-葡萄糖信号,6.21 (1H, d, J =1.8 Hz,H-6)、6.44 (1H, d, J = 1.8 Hz, H-8)为A环间位偶合信号,8.04 (2H, d, J = 9.0 Hz, H-2’, 6’)、6.89 (2H, d, J = 9.0 Hz,H-3’, 5’)显示为B环对位取代,以上数据与Kishore[21]基本一致,故鉴定化合物 3为山奈酚-3-O-β-D-葡萄糖苷。化合物4的紫外可见光谱显示最大吸收波长(λmax)在264、341 nm,ESI-MS (m/z) 431.0926 [M-H]-、433.1141[M+H]+,推测分子式为 C21H20O10,NMR显示其黄酮醇信号及1个α-L-鼠李糖信号。1H NMR显示A环间位偶合信号,B环对位取代信号,由13C NMR苷元苷化位移符合3位成苷特征,通过与Hegazi[22]的报道对比发现数据基本一致,鉴定化合物4为山奈酚-3-O-α-L-鼠李糖苷。化合物5的紫外可见光谱显示最大吸收波长(λmax)在213、289 nm,ESI-MS (m/z) 271.0673 [M-H]-、273.0754[M+H]+,推测分子式为C15H12O5,NMR谱中5.44 (1H, dd,J = 13.2, 3.0 Hz, H-2)、3.28 (1H, dd, J = 17.1, 13.2 Hz,H-3a)、2.68 (1H, dd, J = 17.1, 3.0 Hz, H-3b)及 78.6 (C-2)、42.4 (C-3)显示其为二氢黄酮类化合物,通过与陈胡兰等[23-24]的报道比对,鉴定化合物5为柚皮素。化合物6的紫外可见光谱显示最大吸收波长(λmax)在266、368 nm,ESI-MS (m/z) 285.0340 [M-H]-、287.055 2 [M+H]+,推测相对分子质量为286.0,分子式为C15H10O6,与山奈酚的分子量一致[25],由于王国霞等[8]的研究显示银杏花粉的主要黄酮苷元为山奈酚,故化合物 6为山奈酚的可能性较大。将化合物 6与山奈酚标准品进行比较,其高效液相色谱的出峰保留时间一致,故鉴定化合物 6为山奈酚。化合物1~6的化学结构见图4。
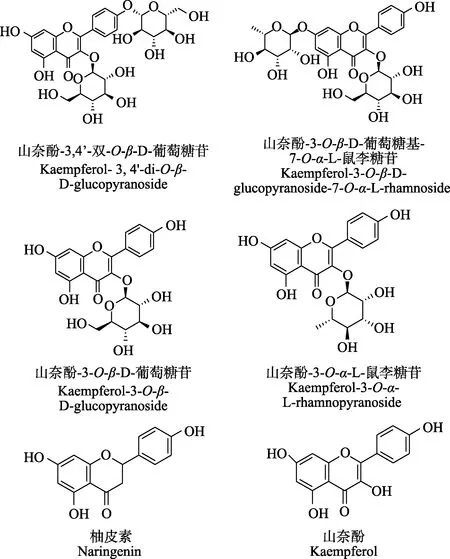
图4 化合物1~6的化学结构式Fig.4 Chemical structures of compounds 1 to 6
将纯化得到的 6种化合物重新混合制成标准品,并进行液相色谱分析,结果见图5,通过与图1a以及图2的出峰时间相比较,发现这 6种化合物与银杏花粉粗提物的6种主成分以及乙酸乙酯相的6种主要清除DPPH自由基活性物质的出峰保留时间一致。可见这 6种化合物即为银杏花粉的主要清除DPPH自由基黄酮组分。

图5 化合物1~6的混合标准品Fig.5 Mixed standards of compounds 1 to 6
2.4 纯化黄酮单体的DPPH清除能力
以维生素C和芦丁为对照,测定化合物1、2、3、4、5、6的DPPH清除率并计算IC50值。维生素C和芦丁的IC50值分别为0.013和0.014 mg/mL,山奈酚(6)的IC50值为0.017 mg/mL,与维生素C和芦丁相比均没有显著性差异(P>0.05)。山奈酚-3-O-β-D-葡萄糖基-7-O-α-L-鼠李糖苷(2)、山奈酚-3-O-β-D-葡萄糖苷(3)、山奈酚-3-O-α-L-鼠李糖苷(4)和山奈酚-3,4’-双-O-β-D-葡萄糖苷(1)均为以山奈酚为母核的黄酮苷,其 IC50值均高于山奈酚,分别为0.210、1.530、1.730和2.250 mg/mL。柚皮素(5)的IC50值最高,超过2.500 mg/mL。可见,上述化合物清除DPPH自由基的活性由高到低依次为:化合物6>化合物 2>化合物3>化合物 4>化合物 1>化合物 5。据文献报道,山奈酚广泛存在于植物花粉及蜂花粉中[26-27],多数以结合态的形式存在[28],具有较好的清除自由基和防止脂质过氧化等抗氧化作用[29-30],与本研究结果一致。
3 结 论
1)银杏花粉粗提物具有清除DPPH自由基活性,对DPPH的半抑制率为1.32 mg/mL,乙酸乙酯相和正丁醇相对DPPH的半抑制率为0.46和0.84 mg/mL,分别是粗提物的34.85%和63.64%,乙酸乙酯相的清除DPPH活性最高。
2)乙酸乙酯相富集了6种主要银杏花粉黄酮,而且均具有清除DPPH活性。
3)采用制备型液相色谱进行分离纯化,经结构鉴定分别为:山奈酚-3,4’-双-O-β-D-葡萄糖苷(1)、山奈酚-3-O-β-D-葡萄糖基-7-O-α-L-鼠李糖苷(2)、山奈酚-3-O-β-D-葡萄糖苷(3)、山奈酚-3-O-α-L-鼠李糖苷(4)、柚皮素(5)和山奈酚(6),其中山奈酚-3,4’-双-O-β-D-葡萄糖苷(1)和山奈酚-3-O-β-D-葡萄糖基-7-O-α-L-鼠李糖苷(2)是首次从银杏中纯化得到。
4)纯化产物清除DPPH自由基的活性由高到低依次为:化合物 6>化合物 2>化合物 3>化合物 4>化合物1>化合物5。其中山奈酚(6)清除DPPH的IC50值为0.017 mg/mL,与维生素C及芦丁相比没有显著性差异(P>0.05)。
[1] 任浩,宿树兰,管汉亮,等. 银杏花粉中核苷、氨基酸及无机元素的成分分析[J]. 中草药,2014,45(19):2839-2843.Ren Hao, Su Shulan, Guan Hanliang, et al. Component analysis of nucleosides, amino acids, and mineral elements in pollen of Gingko biloba[J]. Chinese Traditional and Herbal Drugs, 2014, 45(19): 2839-2843. (in Chinese with English abstract)
[2] 王国霞,曹福亮. 4个银杏主要产区的银杏花粉营养成分比较研究[J]. 浙江林业科技,2007,27(3):8-11.Wang Guoxia, Cao Fuliang. Comparative study on nutrient components of Ginkgo biloba pollen from 4 major production areas[J]. Journal of Zhejiang Forestry Science and Technology, 2007, 27(3): 8-11. (in Chinese with English abstract)
[3] 郝功元,吴彩娥,杨剑婷,等. 银杏花粉粗多糖脱色工艺研究[J].食品科学,2009,30(14):136-139.Hao Gongyuan, Wu Cai’e, Yang Jianting, et al.Decolorization of crude polysaccharide from Ginkgo biloba pollen[J]. Food Science, 2009, 30(14): 136-139. (in Chinese with English abstract)
[4] 裘纪莹,陈相艳,刘孝永,等. 银杏花粉及其发酵饮料的总黄酮含量及总黄酮测定方法比较[J]. 江苏农业科学,2015,43(10):371-373.Qiu Jiying, Chen Xiangyan, Liu Xiaoyong, et al. Total flavonoids contents in Ginkgo pollen and its fermentation beverage and comparative study on their determination methods[J]. Jiangsu Agricultural Sciences, 2015, 43(10): 371-373. (in Chinese with English abstract)
[5] 王未名,裘纪莹,刘孝永,等. 银杏花粉及其发酵饮料对小鼠的急性毒性评价[J]. 安徽农业科学,2017,45(5):77-78,213.Wang Weiming, Qiu Jiying, Liu Xiaoyong, et al. Acute toxic effects of Ginkgo pollen and its fermentation beverage on mice[J]. Journal of Anhui Agricultural Sciences, 2017, 45(5):77-78, 213. (in Chinese with English abstract)
[6] Xiao J, Wang T, Li P, et al. Development of two step liquid-liquid extraction tandem UHPLC-MS/MS method for the simultaneous determination of Ginkgo flavonoids, terpene lactones and nimodipine in rat plasma: Application to the pharmacokinetic study of the combination of Ginkgo biloba dispersible tablets and Nimodipine tablets[J]. Journal of Chromatography B, 2016, 1028: 33-41.
[7] Wang Y, Liu Y, Wu Q, et al. Rapid and sensitive determination of major active ingredients and toxic components in Ginkgo biloba leaves extract (EGb 761) by a validated UPLC–MS-MS method[J]. Journal of Chromatographic Science, 2017, 55(4): 459-464.
[8] 王国霞,曹福亮,汪贵斌,等. 不同地区银杏花粉黄酮和内酯含量的差异性[J]. 南京林业大学学报(自然科学版),2007,31(3):34-38.Wang Guoxia, Cao Fuliang, Wang Guibin, et al. Comparative study on the contents of flavonoids and lactones in Ginkgo pollen from different regions[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2007, 31(3): 34-38.(in Chinese with English abstract)
[9] 董宏博,崔桂花,赵文秀. 循环伏安法测定银杏叶中芦丁的含量[J]. 中国当代医药,2015,22(32):12-14.Dong Hongbo, Cui Guihua, Zhao Wenxiu. Determination of rutin content in Ginkgo leaves by cyclic voltammetry[J].China Modern Medicine, 2015, 22(32): 12-14. (in Chinese with English abstract)
[10] 徐澄梅,任浩,钱大玮,等. 采用UPLC-TQ-MS同时测定银杏花粉 24种资源性化学成分[J]. 中国中药杂志,2015,40(11):2157-2162.Xu Chengmei, Ren Hao, Qian Dawei, et al. Determine resource chemical component in Ginkgo pollen simultaneously by UPLC-TQ-MS[J]. China Journal of Chinese Materia Medica, 2015, 40(11): 2157-2162. (in Chinese with English abstract)
[11] Wang G, Huang X, Pei D, et al. DPPH-HPLC-DAD analysis combined HSCCC for screening and identification of radical scavengers in Cynomoriumsongaricum rupr[J]. New Journal of Chemistry, 2016, 40: 3885-3891.
[12] Li A, Xuan H, Sun A, et al. Preparative separation of polyphenols from water-soluble fraction of Chinese propolis using macroporous absorptive resin coupled with preparative high performance liquid chromatography[J]. Journal of Chromatography. B, 2016, 1012-1013: 42-49.
[13] 裘纪莹,庞停停,周庆新,等. 银杏花粉抗氧化成分的提取工艺优化[J]. 核农学报,2016,30(7):1365-1372.Qiu Jiying, Pang Tingting, Zhou Qingxin, et al. Optimization of extraction technology of antioxidant components from Ginkgo pollen[J]. Journal of Nuclear Agricultural Sciences,2016, 30(7): 1365-1372. (in Chinese with English abstract)
[14] Yang L, Sun G, Guo Y, et al. Holistic evaluation of quality consistency of Ixeris sonchifolia (Bunge) hance injectables by quantitative fingerprinting in combination with antioxidant activity and chemometric methods[J]. Plos One,2016, 11(2): 1-19.
[15] Qiu J, Chen L, Zhu Q, et al. Screening natural antioxidants in peanut shell using DPPH-HPLC-DAD-TOF/ MS methods[J].Food Chemistry, 2012, 135(4): 2366-2371.
[16] Xiong S L, Chen S S, Li L J, et al. Purity analysis method of dihydroxylammonium 5,5ʹ-bistetrazole-1,1ʹ-diolate (TKX-50)[J]. Journal of Energetic Materials, 2016, 34(3): 279-287.
[17] Schweiggert R M, Vargas E, Conrad J, et al. Carotenoids,carotenoid esters, and anthocyanins of yellow-, orange-, and red-peeled cashew apples (Anacardium occidentale L.)[J].Food Chemistry, 2016, 200: 274-282.
[18] Forino M, Tartaglione L, Dell'Aversano C, et al. NMR-based identification of the phenolic profile of fruits of Lycium barbarum (goji berries). Isolation and structural determination of a novel N-feruloyl tyramine dimer as the most abundant antioxidant polyphenol of goji berries[J].Food Chemistry, 2016, 194: 1254-1259.
[19] Cui B, Nakamura M, Kinjo J, et al. Chemical constituents of Astragali semen[J]. Chemical & Pharmaceutical Bulletin,1993, 41(1): 178-182.
[20] Kang W, Wang J, Ji Z. Flavonoids in Luculia pinceana[J].Chemistry of Natural Compounds, 2008, 44(5): 644-645.
[21] Kishore P H, Reddy M V B, Gunasekar D, et al. A new coumestan from Tephrosia calophylla[J]. Chemical and Pharmaceutical Bulletin, 2003, 51(2): 194-196.
[22] Hegazi N, Hashim A. Grandisin, 2-methoxy 6, 7, 2',6'-tetrahydroxy flavanone 6-O-glucoside, from Cassia grandis leaves-antioxidant and cytotoxic activities[J]. Die Pharmazie-An International Journal of Pharmaceutical Sciences, 2016, 71(9): 544-547.
[23] 陈胡兰,董小萍,张梅,等. 紫花地丁化学成分研究[J]. 中草药,2010,41(6):874-877.
[24] Pan Y G, Li Y X, Yuan M Q. Isolation, purification and identification of etiolation substrate from fresh-cut Chinese water-chestnut (Eleocharis tuberosa)[J]. Food Chemistry,2015, 186: 119-122.
[25] Rajauria G, Foley B, Abu-Ghannam N. Identification and characterization of phenolic antioxidant compounds from brown Irish seaweed Himanthalia elongata using LC-DAD–ESI-MS/MS[J]. Innovative Food Science &Emerging Technologies, 2016, 37: 261-268.
[26] Ares A M, Valverde S, Bernal J L, et al. Extraction and determination of bioactive compounds from bee pollen[J].Journal of Pharmaceutical and Biomedical Analysis, 2018,147: 110-124.
[27] Akbari M, Nejadsatari T, Noori M, et al. Pollen grain flavonoid studies of four Iranian Trifolium (Leguminosae)taxa as future honey biomarkers[J]. Phytologia Balcanica:International Journal of Balkan Flora and Vegetation, 2017,23(1): 17-22.
[28] Tu X, Ma S, Gao Z, et al. One-step extraction and hydrolysis of flavonoid glycosides in rape bee pollen based on soxhlet-assisted matrix solid phase dispersion[J].Phytochemical Analysis, 2017, 28(6): 505-511.
[29] de Florio Almeida J, dos Reis A S, Heldt L F S, et al.Lyophilized bee pollen extract: A natural antioxidant source to prevent lipid oxidation in refrigerated sausages[J].LWT-Food Science and Technology, 2017, 76: 299-305.
[30] Dar R A, Brahman P K, Khurana N, et al. Evaluation of antioxidant activity of crocin, podophyllotoxin and kaempferol by chemical, biochemical and electrochemical assays[J].Arabian Journal of Chemistry, 2017, 10: 1119-1128.

