基于体积感兴趣区的18F-FET PET脑胶质瘤分析方法研究
胡彬,胡海勇
1.浙江医药高等专科学校 医疗器械学院,浙江 宁波 315010;2.宁波市第二医院 设备科,浙江 宁波 315000
引言
氨基酸类正电子放射药物(18F- fluorethyl-L-Tyrosin,18F-FET)是弥补当前18F-FDG PET不足的重要药物[1]。与18F-FDG不同,18F-FET在正常脑组织中的摄取很低,尤其在良性病变如炎症、水肿、坏死和纤维化的组织中几乎不摄取,有助于提高PET显像的特异度[2]。最新一些临床研究已经证明18F-FET PET可以鉴别低级别胶质瘤(WHO Ⅰ级和Ⅱ级)和高级别胶质瘤(WHO Ⅲ级和Ⅳ级),并将其与非肿瘤病变区分开来[3-5]。此外,FET PET已被证明能够可靠区分肿瘤复发与由各种治疗(如手术,外部放射治疗和全身或局部化疗)诱发的反应性病变[6]。最近有研究显示18F-FET更适用于诊断脑胶质瘤,由此对于这方面的研究再次被重视起来[7-8]。在选取分析18F-FET PET脑胶质瘤影像时通常采用基于标准摄取值的感兴趣体积(Volume of Interest,VOI)选取法[9],由于实际肿瘤形状大小的特异性,该方法在选取过程中的精确度不高,因此需要探寻一种更为精确的VOI选取法以获得准确的分析结果。
1 资料与方法
1.1 研究对象
共收集25例脑胶质瘤患者,其中低级别脑胶质瘤7例,高级别脑胶质瘤18例,包括间变型少突胶质细胞瘤,间变型星形细胞瘤,胶质母细胞瘤和胶质肉瘤。
1.2 仪器
PET成像扫描仪:西门子Ecat Exact HR+scanner(Siemens Medical Systems, Hoffman Estates,IL,USA;32 rings)。
1.3 实验方法
1.3.1 数据采集
首先使用锗棒源进行标准空白扫描,随后对受试对象行15 min透射扫描,由此获得衰减校正数据。受试对象均禁食至少6 h,随后经静脉注射200 MBq18F-FET示踪剂。每位受试对象在注射后40 min内完成PET动态头部扫描,整个扫描时间被分为16个时间段,每段时长在1~5 min之间。所得图像采用Shepp滤波反投影傅立叶图像重建并完成衰减校正,随后将数据和图像传送至UNIX工作站进行后处理。
由于PET头部扫描需要较长时间,受试对象头部可能发生移动,需要检查图像中可能存在的头部运动并校正,否则可能在最终图像上产生伪影而且会影响时间—放射性活度曲线的结果。传统做法需要使用软件对每一帧图像进行检查,效率很低。为了提高效率和准确率,本研究使用MATLAB(Version 7.6,MathWorks)软件程序来完成自动校验检查。具体工作方法是计算帧与帧之间的位置差异,即第n+1帧减去第n帧获得总共15帧梯度变化的图像。将这些梯度帧图像用PMOD(Version 3.2,PMOD Technologies Ltd)软件加载并显示在同一幅图中进行对比,如果扫描过程中存在头部运动,则在梯度帧图像之间就会有位置差并在图中显现为明显的轮廓(图1)。反之,则梯度帧图像之间无位置差,图中只有噪声信号影像。对于检查出有头部运动的图像帧需要使用MPItool(Multi Purpose Imaging Tool,Advanced Tomo Vision GmbH V5.36) 软 件校正。不同时段由于其时间长短不一,受试对象所处状态的不同,很有可能会存在头部位置变化导致图像伪影。经MATLAB程序检查后发现第8和第9帧图像存在头部运动(图1)需要使用MPItool软件手动校正。校正过程中主要运用轮廓线对比法(图2),其中图2中第一行为第8帧图像(用红色轮廓线显示),第二行为第9帧图像(用黄色轮廓线显示),第三行为前两行的叠加图像。将第二行的图像作为参照,对照其轮廓线移动第一行图像来使得第三行叠加图像中的红色和黄色轮廓线完全重合,由此完成头部运动校正。完成后的图像将再次使用之前方法检查,直至头部运动被完全校正。

图1 头部运动图像帧检查与校正
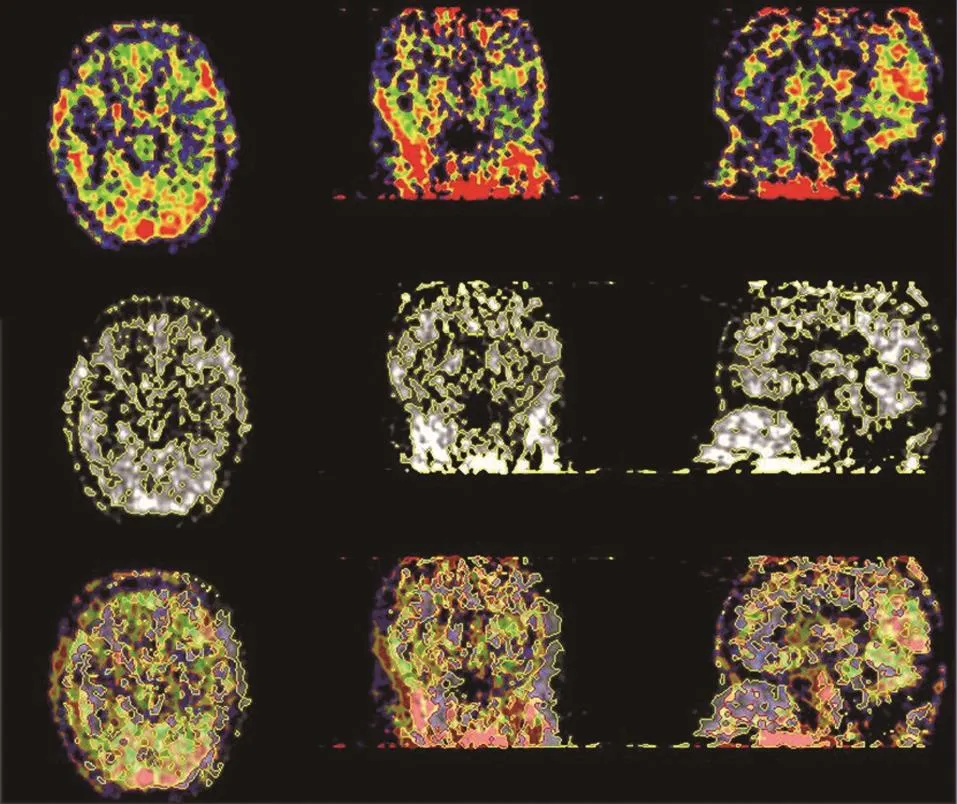
图2 图像中的头部运动
1.3.2 数据分析
头部运动校正后的数据被导入PMOD软件中对VOI内放射性活度的统计分析。本研究将脑胶质瘤部分定义为VOI,并采用等轮廓线法来设定,因此VOI的大小取决于轮廓线的变化。设定VOI时先在其中一帧图像上的脑胶质瘤外围部分选取一个方形ROI,随后将该ROI沿正反两个方向分别复制到当前图像帧的前后两帧上,形成覆盖整个肿瘤部分的三维立方体,保存为标准初始值。检查每一帧图像确定肿瘤完全覆盖于设定的三维立方体空间内。然后将阈值设定为50%,使得VOI能够覆盖超过标准初始空间分辨率50%的范围。此外还设定阈值70%和90%作比较。由于脑胶质瘤图像具有异质性,因此阈值50% VOI能够覆盖整个脑胶质瘤,而阈值70% VOI覆盖范围小于整个肿瘤,相比之下阈值90%能够覆盖的范围就更加有限。通过PMOD软件获得相应VOI内胶质瘤相关统计数据反映在时间—放射性活度曲线上,并对数据进行比较。
2 实验结果
2.1 时间放射性活度曲线分析
从时间—放射性活度曲线分析结果可以看出,阈值50%的曲线平稳地持续上升(图3a)曲线上每一点都在正确位置上。前5个点相当接近,代表其间隔时间相对较短,而接下来10个点间隔时间较长,距离也相对较大。阈值70%的时间活动曲线与阈值50%非常相似,但并不像前者那么平稳(图3b)。这是因为轮廓的阈值越大,VOI越小,由此产生噪声越多。阈值为90%的曲线完全不是一条平滑的曲线(图3c),可见其受到图像噪声影响很大,无法得出反映真实情况的分析结果。
2.2 阈值对比分析
为了更清晰准确地比较不同阈值下时间—放射性活度曲线的差异性,将PET动态数据导入到单一时间下的同一帧图像中进行比对。将之前所得VOI阈值50%、70%和90%的数据导入同个坐标下形成时间—放射性活度曲线(图4)。从图4a中可以看出,即便是取50%阈值,如果PET成像中含有头部运动,也会影响曲线的稳定性,由此得出的结果无法体现准确的肿瘤信息。除去头部运动后的曲线(图4b)VOI阈值90%曲线波动较大,放射性活度具有不确定性,这是因为它的感兴趣体积在区域内覆盖的范围很小,不能代表整个肿瘤部分。VOI阈值70%曲线趋势相比于前者走势更为平缓,但是也存在个别点偏离曲线正常位置。而VOI阈值50%曲线在所有曲线中最为平稳持续,虽然其中第12点不在曲线正常位置上,但是这极有可能是由于一个尚未修正的头部运动引起,再进行更为细致的头部运动矫正后可以修复。
3 讨论
近年来氨基酸类正电子显像在胶质瘤中得到了较好的发展,尤其是18F-FET因为其较长的半衰期、理想的生物分布,得到了越来越多的应用[10-11]。在分析评估恶性脑胶质瘤时,由于轮廓处理采用的成像模板不同会得到不同的目标体积,由此将可能导致取得显著不同的分析结果[12]。Filss等[13]使用静态18F-FET PET结合形态学MR图像生成VOI,并将这些VOI套用到相应的灌注加权的MR图像(PWI)上用于脑胶质瘤影像分析。由于需要MR图像的辅助,该方法在应用过程中相对复杂。
在本研究中通过MATLAB、MPI-Tool和PMOD 3种软件结合分析处理18F-FET脑胶质瘤的摄取动力学情况。衰减校正数据来自PET扫描前进行的锗棒源15 min透射扫描,存在以下限制和不足[14]:① 受检者体内发射计数的干扰;② 由于扫描时间和锗放射源的限制导致统计性不足;③ 受限于透射源几何位置及运动特征,透射扫描与发射扫描中的散射和偶然符 合计数有明显差异。

图4 阈值50%、70%和90%的时间—放射性活度曲线
近年来随着PET/CT一体机的普及,应用CT扫描数据来进行PET衰减校正技术也越来越成熟。CT衰减校正速度快效率高,但是由于需要进行衰减系数转化,对于高原子序数材料存在过度校正问题,影响PET定量分析的准确性,甚至导致PET图像伪影[15-16]。MATLAB程序在计算分析每一帧图像之间的差异上功能强大,能够产生非常清晰的梯度图像,有助于分辨图像中存在的动态伪影。相比逐一比较每一帧图像,亦可节约大量时间,提高了工作效率和准确率。本研究中图像质量问题主要来源于受试对象在扫描过程中的头部运动。因此在选取VOI前需先校正头部运动,以提高图像质量和VOI选取的准确性。在MPITool软件环境下通过轮廓线对比法,可以手动纠正去除头部运动导致的动态图像伪影。此外,利用体表标识或者骨性标识进行图像对比以去除头部运动也有不错的效果,成为目前研究的一大热点。PMOD软件不仅能显示最终完成的图像结果,而且在统计分析所设定的VOI内时间—放射性活度曲线方面发挥了重要作用。
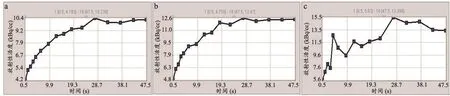
图3 时间—放射性活度曲线阈值统计结果
综上所述,在分析处理脑胶质瘤摄取的动力学行为方面运用等轮廓线法设定VOI进行分析的方法是有效的,并在选取阈值50%的情况下准确率相对较高。
[1] 何山震,王淑侠,王朋,等.18F和11C标记的氨基酸类分子探针的合成及应用研究进展[J].核技术,2014,37(8):23-29.
[2] Galldiks N,Langen KJ,Pope WB.From the clinician’s point of view—What is the status quo of positron emission tomography in patients with brain tumors?[J].Neuro-Oncology,2015,17(11).
[3] Pöpperl G,Kreth FW,Herms J,et al.Analysis of18F-FET PET for grading of recurrent gliomas: is evaluation of uptake kinetics superior to standard methods?[J].J Nucl Med,2006,47(3):393.
[4] Pöpperl G,Kreth FW,Mehrkens JH,et al.FET-PET for the evaluation of untreated gliomas: correlation of FET uptake and uptake kinetics with tumour grading[J].Eur J Nucl Med Mol Imag,2007,34(12):1933-1942.
[5] Jansen NL,Suchorska B,Wenter V,et al.Prognostic significance of dynamic18F-FET PET in newly diagnosed astrocytic highgrade glioma[J].J Nucl Med,2015,56(1):9-15.
[6] 高霞,张斌,王斌,等.18F-FDG、18F-RGD和18F-FET在LN229脑胶质模型体内生物分布和Micro-PET显像[J].同位素,2015,28(3):155-159.
[7] Combs SE,Bruckner T,Mizoe JE,et al.Comparison of carbon ion radiotherapy to photon radiation alone or in combination with temozolomide in patients with high-grade gliomas:explorative hypothesis-generating retrospective analysis[J].Radiother Oncol,2013,108(1):132-135.
[8] Grosu AL,Astner ST,Riedel E,et al.An interindividual comparison of O-(2-[(18)F]fluoroethyl)-L-tyrosine (FET)-and L-[methyl-(11)C]methionine (MET)-PET in patients with brain gliomas and metastases[J].Int J Radiat Oncol Biol Phys,2011,81(4):1049-1058.
[9] Tian Y,Hao CY,Wang Y,et al.Dynamic extraction for VOI from CT images based on volume rendering[J].Int J Image Graph,2007,7(1):195-209.
[10] 程林,程竞仪.氨基酸类正电子显像在胶质瘤中的研究进展[J].国际放射医学核医学杂志,2017,41(4):283-287.
[11] Roessler K,Becherer A,Donat M,et al.Intraoperative tissue fluorescence using 5-aminolevolinic acid (5-ALA) is more sensitive than contrast MRI or amino acid positron emission tomography (18F-FET PET) in glioblastoma surgery[J].Neurol Res,2012,34(3):314-317.
[12] Rieken S,Habermehl D,Giesel FL,et al.Analysis of FETPET imaging for target volume definition in patients with gliomas treated with conformal radiotherapy[J].Radiother Oncol,2013,109(3):487-492.
[13] Filss CP,Galldiks N,Stoffels G,et al.Comparison of18F-FET PET and perfusion-weighted MR imaging: a PET/MR imaging hybrid study in patients with brain tumors[J].J Nucl Med,2014,55(4):540-545.
[14] 柴培,聂彬彬,叶婷,等.CT用于PET衰减校正技术的研究进展[J].中国医学影像技术,2010,26(8):1576-1578.
[15] Turkington TG,Wilson JM.Attenuation artifacts and time-offlight PET[A].IEEE Nuclear Science Symposium Conference Record[C].2009:2997-2999.
[16] Pan T,Mawlawi O,Nehmeh SA,et al.Attenuation correction of PET images with respiration-averaged CT images in PET/CT[J].J Nucl Med,2005,46(9):1481.

