猪冠状动脉微栓塞后心肌细胞凋亡与内质网应激相关蛋白CHOP表达的关系
林崇强 刘涛 唐中力 刘阳春 李浪
[摘要]目的 探討猪冠状动脉微栓塞(CME)后心肌细胞凋亡与内质网应激相关蛋白C/EBP同源性蛋白(CHOP)表达的关系。方法 将选取的50头小型猪随机分为Sham组和CME组,每组25头。采用介入法经冠脉内注入微栓塞球建立CME模型,Sham组经冠脉内注入等量生理盐水。根据术后观察时间点进一步分为3 h组、6 h组、12 h组、24 h组、48 h组,每组5头。应用超声心动图检测心功能,HE染色观察心肌组织病理学变化,苏木素碱性复红苦味酸(HBFP)染色检测心肌微梗死面积,缺口末端标记(TUNEL)法检测心肌细胞凋亡,Western blot检测心肌组织CHOP、Caspase-3蛋白表达。结果 与相应Sham组比较,CME后各时间点心功能均不同程度下降(P<0.05),CME后12 h心功能下降最明显。CME后各时间点均可见多发局灶性微梗死心肌,以心内膜下及左心室为多,无大片坏死,各组间微梗死面积比较,差异无统计学意义(P>0.05)。与相应Sham组比较,CME组各时间点心肌细胞凋亡指数不同程度增加(P<0.05),CME后12 h心肌细胞凋亡达高峰。凋亡心肌细胞主要位于微梗死区及其边缘区。与相应Sham组比较,CME组各时间点CHOP、Caspase-3蛋白表达不同程度上调(P<0.05),呈动态变化,CME后12 h达高峰。结论 CME后CHOP蛋白表达上调可能参与内质网应激诱导的心肌细胞凋亡。
[关键词]冠状动脉微栓塞;凋亡;C/EBP同源蛋白;内质网应激
[中图分类号] R543.3 [文献标识码] A [文章编号] 1674-4721(2018)4(c)-0009-05
The relationship of myocardial apoptosis and endoplasmic reticulum stress-related protein CHOP in swine following coronary microembolization
LIN Chong-qiang1 LIU Tao2 TANG Zhong-li3 LIU Yang-chun4 LI Lang4
1.Department of Cardiovasolar Medicine,People′s Hospital of Cenxi City in Guangxi Zhuang Autonomous Region,Cenxi 543200,China;2.Department of Cardiovasolar Medicine,Minzu Hospital of Guangxi Zhuang Autonomous Region,Nanning 530001,China;3.Department of Cardiovasolar Medicine,People′s Hospital of Dao County in Hunan Province,Dao County 425300,China;4.Department of Cardiology,the First Affiliated Hospital of Guangxi Medical University,Nanning 530001,China
[Abstract]Objective To investigate the relation of myocardial apoptosis and endoplasmic reticulum stress-related (CME) protein C/EBP homologous protein (CHOP) in swine following coronary microembolization.Methods Fifty swine were selected and randomly divided into the Sham group (n=25) and the CME group (n=25).Five subgroups were assigned according to time points (3,6,12,24,48 h),5 cases in each group.The CME model was established through injecting microspheres into the coronary artery,while swine in the Sham group received the same dose of normal saline instead.Cardiac function was measured with echocardiography.Histopathological changes were detected with HE.Microinfarction and apoptotic index were detected with hematoxylinbasic fuchsinpicric acid (HBFP) and TUNEL stainings,respectively.The expressions of CHOP and Caspase-3 proteins were determined with Western blot.Results Compared with the Sham groups,the cardiac function was decreased in varying degrees in the corresponding CME groups (P<0.05).The cardiac function of 12 h following CME was the worst.Microinfarction rather than massive necrosis was found each time points following CME,mainly located in left ventricle and subendocardial myocardium.The difference,however,was not statistically significant (P>0.05).Compared with the Sham groups,the apoptotic index in the corresponding CME groups were increased in varying degrees (P<0.05).It peaked 12 h following CME.Apoptotic cardiomyocytes were mainly located in microinfarct area and its border area.Compared with the Sham groups,CHOP protein expression in the corresponding groups following CME enhanced in varying degrees (P<0.05),showing dynamic changes.It peaked 12 h following CME.Conclusion CME induces cardiomyocyte apoptosis and cardiac dysfunction,in which enhanced CHOP and caspase-3 expression may be involved.
[Key words]Coronary microembolization;Apoptosis;CHOP;Endoplasmic reticulum stress
经皮冠状动脉介入治疗(PCI)是目前治疗急性ST段抬高型心肌梗死的首选方法[1-2]。然而,即使解除心外膜冠状动脉阻塞或狭窄,仍有部分患者未能达到心肌水平灌注,称之为无复流现象。无复流现象是患者远期预后不良的独立预测因子,较之PCI术后再灌注良好者,发生无复流的患者早期梗死后并发症(恶性心律失常、心包积液、心包填塞、充血性心力衰竭)、左心室重构、晚期因心衰再次住院率及短期和长期死亡率明显升高[3]。研究显示,冠状动脉微栓塞(CME)是导致PCI术中发生无复流现象的主要原因之一[4]。PCI术中机械性操作致粥样斑块碎片和(或)血栓性碎屑随前向血流流入远端微循环,引起冠状动脉微循环堵塞,从而导致心肌微梗死、冠脉血流储备下降及心脏收缩功能障碍,而目前临床上对预防CME发生并无十分有效的措施[5]。目前的研究显示,心肌细胞凋亡是CME致心肌损伤的重要机制之一[6-7]。除线粒体途径和死亡受体途径外,内质网途径亦被证实参与细胞凋亡调控[8]。CME可导致钙稳态失衡及氧化应激反应,进而产生内质网应激。当应激持续存在或较强烈,损伤了内质网功能,且这些反应不足以恢复内质网稳态时,则可激活内质网凋亡通路。C/EBP同源蛋白(CHOP)为内质网应激介导的细胞凋亡的经典标志物之一[9]。关于CHOP在CME后心肌组织表达的动态变化,目前国内外鲜有研究报道。本实验拟经冠脉内注射微栓塞球建立猪CME模型,观察CME后不同时间点心肌细胞凋亡及内质网应激相关蛋白CHOP的表达变化,以探讨两者之间的关系。
1对象与方法
1.1主要仪器与试剂
42 μm微栓塞球(Dynospheres;Dyno Particles;Lillestrom,Norway);6F JL4.0指引导管(CordisInc.USA);0.014英寸Runthrough指引导丝(Terumo Medical Corporation,Japan);1.8F微导管(CordisInc.USA);4%多聚甲醛(北京索莱宝科技有限公司,中国);兔抗猪CHOP、caspase-3抗体(abcam,USA);兔抗猪GAPDH抗体(Cell Signaling Technology,USA),羊抗兔荧光二抗(LICOR,USA),TUNEL原位细胞凋亡检测试剂盒(Roche,USA)。
1.2 CME模型建立及实验分组
选取健康巴马系小型猪50头,雌雄不限,体质量25~30 kg,由广西大学动物科学技术学院提供(许可证号:SCXK桂2007-0003)。将其随机分为Sham组及CME组,每组25头。以氯胺酮(山西太原药业有限公司,国药准字 H14022824,20 mg/kg)和阿托品(河南天方药业股份有限公司,国药准字H41020290, 2 mg/头)诱导麻醉成功后,以地西泮(山西太原药业有限公司,国药准字 H14021957)静脉注射维持镇静。对右侧腹股沟区行常规消毒铺巾,2%利多卡因(山东圣鲁制药有限公司,国药准字 H20063986)局部麻醉。分离并穿刺右侧股动脉,成功后置入6F桡动脉鞘管,鞘内注入肝素(北京双鹤药业有限公司,国药准字 H110 20963)200 U/kg达肝素化,继以100 U/kg/h维持。经鞘管送入6F JL指引导管并行冠脉造影确定前降支,而后在指引导丝支撑下送入1.8F微导管至前降支中段,经微导管于40 min内注入10万个微栓塞球(悬浮于生理盐水中,浓度为1×104个/ml)10 ml,Sham组经冠脉内注入等量生理盐水,术毕肌内注射青霉素(桂林南药股份有限公司,国药准字 H45021515)80万单位预防感染。每组实验动物按观察时间点不同进一步分为3 h组、6 h组、12 h组、24 h组及48 h组,每组5头。
1.3观察指標及检测方法
1.3.1心功能检测 各组动物分别于术后相应时间点行心功能检查。右侧卧位固定,使用GE VIVID 7型超声心动图仪,探头频率1.5~4.3 MHz,分别沿胸骨旁左室长轴及短轴切面检测左室射血分数(LVEF)、左室舒张期末径(LVEDD)、短轴缩短率(FS)及心排血量(CO)。所有图像采集均由一名超声科专科医生完成。
1.3.2心肌组织取材 检测心功能后,经耳缘静脉注入10 ml 10%氯化钾(桂林南药股份有限公司,国药准字 H45020099),使心脏停博于心室舒张期,迅速取出心脏,生理盐水冲洗干净。取材部位为前降支中段以远所支配的心肌组织。部分心肌组织立即转移至-80℃冰箱保存,用于Western blot检测,其余用4%多聚甲醛固定后用于组织病理学检测。
1.3.3苏木素碱性复红苦味酸(HBFP)染色检测心肌微梗死面积 HBFP是一种检测早期心肌缺血及梗死的重要方法。正常心肌组织染成黄色,缺血心肌呈红色。每组选取5张切片行HBFP染色,每张片随机选取5个视野(×100),使用DMR+Q550病理图像分析仪(Leica,Germany)观察,采用Leica Qwin分析软件(Leica,Germany)以平面法测量红色梗死区域,梗死面积表示为总分析切片面积的百分比,取平均值。
1.3.4缺口末端标记(TUNEL)染色检测心肌细胞凋亡 严格按照TUNEL检测试剂盒说明操作。切片常规脱蜡,胰蛋白酶K37℃孵育30 min,加入TUNEL反应液,37℃孵育60 min,加入转化剂(POD)37℃孵育30 min及DAB底物溶液室温孵育3 min,封片后于400倍光学显微镜下随机选取10~15个不重叠视野观察。TUNEL阳性信号定位于细胞核,正常细胞呈淡蓝色,凋亡细胞呈棕黄色,同时结合形态学特征(细胞体积缩小、核染色质致密及核碎裂)判断凋亡心肌细胞,计算心肌细胞凋亡指数(凋亡指数=凋亡细胞/总细胞数×100%)。
1.3.5 Western blot检测CHOP、Caspase-3蛋白表达 应用RIPA裂解液(含蛋白酶抑制剂PMSF)提取心肌組织总蛋白,BCA法检测蛋白浓度,每孔50 μg蛋白行SDS-PAGE电泳,半干转至PVDF膜,5%脱脂奶粉室温封闭1 h,一抗4℃孵育过夜(anti-CHOP抗体,1∶1000;anti-Caspase-3抗体,1∶1000),荧光二抗(1∶5000)室温避光孵育1 h,使用Odyssey双色红外激光成像系统扫描,Quantity One软件(Bio-Rad,USA)测量条带灰度值,以内参GAPDH校正后的灰度值比值表示蛋白相对表达水平。
1.4统计学分析
采用SPSS 19.0统计软件进行数据分析,计量资料以均数±标准差(x±s)表示,两组间比较采用成组t检验,多组间比较采用单因素方差分析,相关性分析采用Pearson相关性分析,以P<0.05为差异有统计学意义。
2结果
2.1各组不同时间点心功能变化的比较
与Sham组比较,CME组各时间点心功能均不同程度下降,表现为LVEF、FS、CO下降及LVEDD增加,差异均有统计学意义(P<0.05)。Sham组内不同时间点的心功能指标比较,差异无统计学意义(均P>0.05)。CME组内比较:LVEF 12 h组、FS 12 h组、LVEDD 12 h组与其余时间点比较,差异有统计学意义(P<0.05);LVEF 6 h组、FS 6 h组与24 h组及48 h比较,差异有统计学意义(P<0.05)(表1)。
表1 各组不同时间点心功能指标动态变化的比较(x±s)
与Sham组相应时间点比较,aP<0.05;与CME后3、6、24、48 h比较,bP<0.05;与CME后24、48 h比较,cP<0.05
2.2 CME后心肌组织病理学改变分析
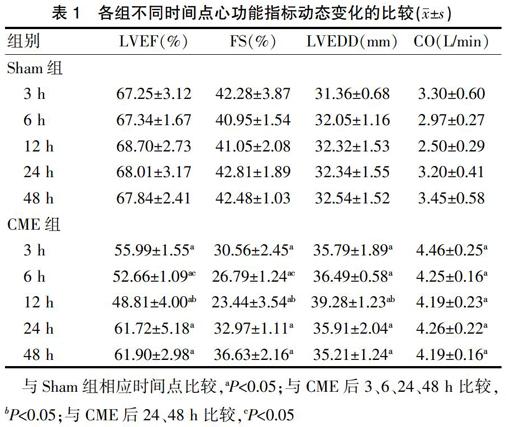
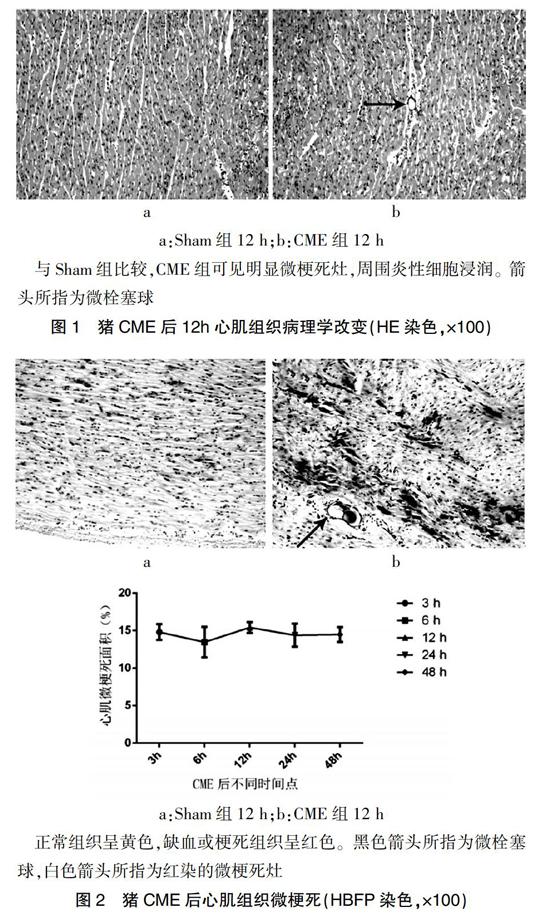
HE染色示微栓塞球沿微血管走行分布,周围可见心肌微梗死灶,多为楔形,呈局灶性分布,微梗死灶内心肌细胞核溶解或消失,胞质红染,周围心肌水肿,炎性细胞浸润明显(图1)。HBFP染色示Sham组偶见心内膜下缺血,无明显心肌梗死。CME组各时间点均可见明显多发性局灶性心肌微梗死,非透壁性,以心内膜下及左心室多见。CME组各时间点心肌微梗死面积比较,差异无统计学意义(P>0.05)(图2)。
a b
a:Sham组12 h;b:CME组12 h
与Sham组比较,CME组可见明显微梗死灶,周围炎性细胞浸润。箭头所指为微栓塞球
图1 猪CME后12h心肌组织病理学改变(HE染色,×100)
a b
a:Sham组12 h;b:CME组12 h
正常组织呈黄色,缺血或梗死组织呈红色。黑色箭头所指为微栓塞球,白色箭头所指为红染的微梗死灶
图2 猪CME后心肌组织微梗死(HBFP染色,×100)
2.3 CME后心肌细胞凋亡变化分析
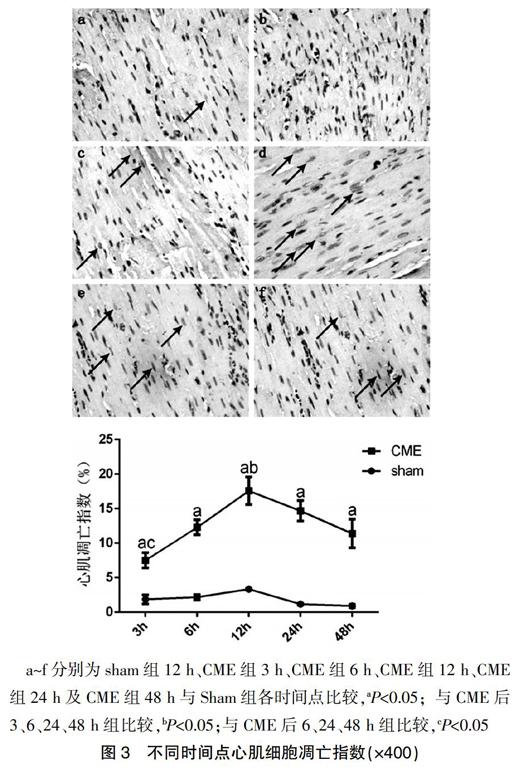
采用TUNEL法检测心肌细胞凋亡,阳性染色信号定位于心肌细胞核内,凋亡细胞呈棕黄色,正常心肌细胞核呈淡蓝色。Sham组心内膜下少许散在分布的凋亡细胞,各时间点比较差异无统计学意义(P>0.05)。与相应Sham组比较,CME组各时间点心肌细胞凋亡指数均不同程度上升(P<0.05)。凋亡心肌细胞主要位于微梗死灶内及其周边。CME后3 h心肌细胞凋亡指数升高,6 h升高更明显,12 h达高峰,24 h呈下降趋势,48 h已明显下降,但仍较Sham组为高(图3)。
a~f分别为sham组12 h、CME组3 h、CME组6 h、CME组12 h、CME组24 h及CME组48 h与Sham组各时间点比较,aP<0.05;与CME后3、6、24、48 h组比较,bP<0.05;与CME后6、24、48 h组比较,cP<0.05
图3 不同时间点心肌细胞凋亡指数(×400)
2.4 CME后心肌组织CHOP、Caspase-3蛋白表达变化
Sham组不同时间点的CHOP、Caspase-3蛋白表达差异无统计学意义(P>0.05)。与相应Sham组比较,CME组各时间点的心肌组织CHOP、Caspase-3蛋白表达均不同程度升高(P<0.05),呈动态变化,CME后12 h表达达高峰(图4、图5)。
与相应时间点Sham组比较,aP<0.05;与CME组3、6、24、48 h组比较,bP<0.05;与CME组3、48 h组比较,cP<0.05
图4 Western blot 检测sham组及CME组不同时间点CHOP蛋白相对表达水平
与相应时间点Sham组比较,aP<0.05;与CME组3、6、24、48 h组比较,bP<0.05;与CME组3、6、48 h组比较,cP<0.05
图5 Western blot 检测Sham组及CME组不同时间点Caspase-3蛋白相对表达水平
2.5相关性分析
CME组各时间点心肌细胞凋亡指数与CHOP、Caspase-3蛋白表达呈正相关关系(分别为r=0.615,P<0.05;r=0.901,P<0.05),与主要心功能指标LVEF呈负相关关系(r=-0.509,P<0.05)。
3讨论
本实验研究结果提示,猪CME后心功能下降,心肌细胞凋亡指数增加,CHOP蛋白表达上调,呈动态变化。相关性分析提示心肌细胞凋亡指数与CHOP蛋白表达呈明显正相关。心肌细胞凋亡可能与CME后内质网应激相关蛋白CHOP表达上调有关。
CME是PCI术中常见且棘手的并发症,可导致无复流现象的发生,是患者远期预后不良的强烈预测因子[10-11]。临床研究及动物实验研究提示,CME可导致恶性心律失常,冠脉血流储备下降,心功能进行性恶化,血清心肌损伤标志物升高,组织病理学提示心肌微梗死及细胞凋亡[12]。凋亡是受多基因严格调控的自主的程序性细胞死亡,心肌细胞凋亡参与多种心血管疾病病理生理过程,包括急性心肌梗死、慢性心力衰竭及心肌缺血再灌注损伤等[13]。笔者近期的研究提示,CME后存在心肌细胞凋亡,抑制心肌细胞凋亡可改善CEM后心功能,提示凋亡为CME致心肌损伤重要机制之一[14-15]。
目前已知的3条凋亡调控通路中,内质网应激介导的凋亡途径是新近发现的凋亡信号通路,且愈发受到关注[16]。内质网是蛋白折叠、钙體内平衡及脂质生物合成的细胞器。多种病理因素(如氧化应激、缺血、Ca2+耗竭、蛋白转运异常等)刺激内质网腔未折叠蛋白或错误折叠蛋白的聚集导致内质网功能障碍,即内质网应激。细胞通过启动未折叠蛋白反应以减少蛋白合成、增加未折叠蛋白降解,从而使细胞适应内质网应激。然而,如果内质网应激过强或持续存在,细胞便可启动凋亡信号通路,如诱导促凋亡转录因子CHOP表达、活化c-Jun氨基末端激酶(JNK)及胱天蛋白酶-12(Caspase-12)。目前的研究提示,未折叠蛋白反应及内质网介导的细胞凋亡参与多种心血管疾病病理生理过程,如心力衰竭、心肌缺血再灌注损伤及动脉粥样硬化[17-18]。CHOP是内质网凋亡途径中关键的转录因子之一,在生理状态下,CHOP表达极低[19-20]。Thorp等[21]的研究发现,CHOP-/-小鼠与CHOP+/+小鼠及Ldlr-/-小鼠杂交后代比较,斑块的坏死及凋亡均显著减少,提示内质网应激启动的CHOP表达上调与斑块的坏死、凋亡密切相关。本实验研究结果显示,猪CME后3 h CHOP蛋白表达上调,6 h上调更显著,12 h达高峰,24~48 h呈持续性下降,但仍较相应时间点假手术组为高。其动态变化规律与CME后心肌细胞凋亡动态变化符合,提示CHOP介导的内质网应激可能参与CME致心肌细胞凋亡。
综上所述,CME急性期心肌细胞凋亡呈动态变化,12 h达高峰,内质网应激相关蛋白CHOP表达上调可能参与CME致心肌细胞凋亡。CHOP有望成为防治CME致心肌损伤的新靶点。
[参考文献]
[1]中华医学会心血管病学分会,中华心血管病杂志编辑委员会.急性ST段抬高型心肌梗死诊断和治疗指南[J].中华心血管病杂志,2015,43(5):380-393.
[2]中华医学会心血管病学分会介入心脏病学组,中国医师协会心血管内科医师分会血栓防治专业委员会,中华心血管病杂志编辑委员会.中国经皮冠状动脉介入治疗指南(2016)[J].中华心血管病杂志,2016,44(5):382-400.
[3]Heusch G.The coronary circulation as a target of cardioprotection[J].Circ Res,2016,118(10):1643-1658.
[4]Heusch G,Kleinbongard P,Bose D,et al.Coronary microembolization:from bedside to bench and back to bedside[J].Circulation,2009,120(18):1822-1836.
[5]刘涛,李浪.栓子保护装置预防冠状动脉远端栓塞的研究进展[J].实用医学杂志,2014,30(19):3039-3041.
[6]Chen ZW,Qian JY,Ma JY,et al.TNF-alpha-induced cardiomyocyte apoptosis contributes to cardiac dysfunction after coronary microembolization in mini-pigs[J].J Cell Mol Med,2014, 18(10):1953-1963.
[7]Wang J,Chen H,Zhou Y,et al.Atorvastatin inhibits myocardial apoptosis in a swine model of coronary microembolization by regulating PTEN/PI3K/Akt signaling pathway[J].Cell Physiol Biochem,2016,38(1):207-219.
[8]Minamino T,Komuro I,Kitakaze M.Endoplasmic reticulum stress as a therapeutic target in cardiovascular disease[J].Circ Res,2010,107(9):1071-1082.
[9]陆薇薇.内质网应激和血管损伤性疾病[J].中国动脉硬化杂志,2012,20(10):939-944.
[10]Jaffe R,Dick A,Strauss BH.Prevention and treatment of microvascular obstruction-related myocardial injury and coronary no-reflow following percutaneous coronary intervention:a systematic approach[J].JACC Cardiovasc Interv,2010,3(7):695-704.
[11]Fokkema ML,Vlaar PJ,Svilaas T,et al.Incidence and clinical consequences of distal embolization on the coronary angiogram after percutaneous coronary intervention for ST-elevation myocardial infarction[J].Eur Heart J,2009,30(8):908-915.
[12]Harrison RW,Aggarwal A,Ou FS,et al.Incidence and outcomes of no-reflow phenomenon during percutaneous coronary intervention among patients with acute myocardial infarction[J].Am J Cardiol,2013,111(2):178-184.
[13]Charununtakorn ST,Shinlapawittayatorn K,Chattipakorn SC,et al.Potential roles of humanin on apoptosis in the heart[J].Cardiovasc Ther,2016,34(2):107-114.
[14]Liu T,Zhou Y,Liu YC,et al.Coronary microembolization induces cardiomyocyte apoptosis through the LOX-1-dependent endoplasmic reticulum stress pathway involving JNK/P38 MAPK[J].Can J Cardiol,2015,31(10):1272-1281.
[15]Liu T,Zhou Y,Wang JY,et al.Coronary microembolization induces cardiomyocyte apoptosis in swine by activating the LOX-1-dependent mitochondrial pathway and caspase-8-dependent pathway[J].J Cardiovasc Pharmacol Ther,2016, 21(2):209-218.
[16]Minamino T,Kitakaze M.ER stress in cardiovascular disease[J].J Mol Cell Cardiol,2010,48(6):1105-1110.
[17]Hong D,Bai YP,Gao HC,et al.Ox-LDL induces endothelial cell apoptosis via the LOX-1-dependent endoplasmic reticulum stress pathway[J].Atherosclerosis,2014,235(2):310-317.
[18]Millott R,Dudek E,Michalak M.The endoplasmic reticulum in cardiovascular health and disease[J].Can J Physiol Pharmacol,2012,90(9):1209-1217.
[19]Li Y,Guo Y,Tang J,et al.New insights into the roles of CHOP-induced apoptosis in ER stress[J].Acta Biochim Biophys Sin (Shanghai),2014,46(8):629-640.
[20]Oyadomari S,Mori M.Roles of CHOP/GADD153 in endoplasmic reticulum stress[J].Cell Death Differ,2004,11(4):381-389.
[21]Thorp E,Li G,Seimon TA,et al.Reduced apoptosis and plaque necrosis in advanced atherosclerotic lesions of Apoe-/- and Ldlr-/- mice lacking CHOP[J].Cell Metab,2009,9(5):474-481.
(收稿日期:201711-10 本文編辑:祁海文)

