矮壮素对小鼠前成骨细胞系MC3T3-E1骨骼发育相关基因及蛋白的影响及其机制
贾丽霞,张琪,侯晓红,孟庆贺,黄尧,周文娟,郝卫东*
(北京大学公共卫生学院食品安全毒理学研究与评价北京市重点实验室,北京100191)
矮壮素是一种植物生长调节剂,可抑制植物中赤霉素的合成,促进植株生长,提高作物产品的质量[1]。作为谷物主要的抗倒伏植物生长调节剂,残留的矮壮素极有可能通过谷物秸秆作为动物饲料的方式进入动物体内,然后通过肉类产品进入人体[2]。目前我国矮壮素的残留问题还比较突出,2012年李春梅等[3]检测出我国部分肉类产品中矮壮素的浓度范围为0.4~636.0μg/kg,其中鸡肉和羊肉的含量最高,分别为636.0和486.0μg/kg。本实验室前期一项对青春发育期大鼠的研究显示,矮壮素对大鼠的骨骼发育有明显影响。通过对大鼠灌胃给予矮壮素,发现在150和300 mg/kg的剂量下大鼠的股骨和胫骨长度都明显变小,高剂量组下骨密度值也发生明显变化,病理检查发现股骨近端生长板明显变薄[4]。
本研究选用MC3T3-E1小鼠前成骨细胞对矮壮素的毒性作用进行研究。MC3T3-E1细胞可以表达碱性磷酸酶(alkaline phosphatase,ALP)、骨钙素(osteocalcin,OCN)、骨形成蛋白2(bone morphogenetic protein2,BMP2)、生长激素受体(growth hormonereceptor,GHR)等促进骨骼发育的功能蛋白。本研究通过检测MC3T3-E1细胞中骨骼发育相关基因的mRNA和蛋白表达以及MAPK信号通路的变化情况,进一步探讨矮壮素对骨骼发育的影响及其作用机制。
1 材料与方法
1.1 细胞株
小鼠前成骨细胞MC3T3-E1购自美国模式培养集存库(American Type Culture Collection,ATCC)细胞库。将MC3T3-E1小鼠前成骨细胞培养于FBS体积分数为10%的 α-MEM培养液中(含100U/mL的青霉素和链霉素),37 ℃、CO2体积分数为5%的培养箱中培养,每2 d换液1次,待细胞铺满80%瓶底面积时,用0.25%胰酶消化,按1∶3比例传代。
1.2 药物与试剂
矮壮素购于美国Sigma-Aldrich公司;TransZol Up试剂购于中国北京全式金生物(TransGen Biotech)公司;Prime-ScriptTMRT-PCR Kit试剂盒和SYBR Premix Ex TaqTM试剂盒均购于日本TaKaRa公司;BCA蛋白浓度测定试剂盒、蛋白裂解液购于中国碧云天生物技术有限公司;胎牛血清(fetal bovine serum,FBS)购于美国Hyclone公司;BMP2抗体、GHR抗体、Tubulin抗体均购于英国Abcam公司;Runx2抗体、ALP抗体均购于美国Santa Cruz公司;MAPK通路抗体(p-ERK、ERK、p-JNK、JNK)均购于美国CST公司;硝基四氮唑蓝(nitroblue tetrazolium,NBT)购于北京欣熙源生物科技有限公司,所用引物均由北京奥科鼎盛生物技术有限公司合成;其他常用试剂均购自北京化学试剂公司。
1.3 器材与仪器
超净工作台购于日本AirTech公司;荧光定量PCR(iCycler)、基因扩增仪、电泳仪、电转仪均购于美国Bio-Rad公司;超声破碎仪(VerSonic100)购于美国VirTis公司;核酸蛋白浓度测定仪(nanophotometer P330)购于美国Implen公司;二氧化碳培养箱(HERA Cell型)购于德国Heraeus公司;多功能酶标仪购于德国Omega公司;倒置显微镜购于重庆仪器厂;化学发光仪(Tanon-4500型)购于北京平原皓生物技术有限公司。
1.4 实验方法
1.4.1 MTT法检测矮壮素对MC3T3-E1细胞相对存活率的影响将处于对数生长期的小鼠前成骨细胞MC3T3-E1用0.25%胰酶消化,以含10%FBS的 α-MEM培养液制成单细胞悬液,然后按5×104/mL的密度接种于96孔培养板,每孔200μL,于37℃、CO2体积分数为5%的培养箱中培养24h。待细胞完全贴壁后,吸弃原培养基,分别更换浓度为8、40、200、1000 μg/mL的矮壮素染毒液,以不含矮壮素的细胞孔作为正常对照组,不含细胞的孔作为空白对照组,每组重复6孔,隔天换液,染毒时间分别为24、48、72h。待染毒结束前4h于板孔中加入5mg/mL的MTT20μL,继续孵育4h后,取出培养板,轻轻吸弃孔内液体,于每孔中加入150μL DMSO(分析纯),室温振荡,使结晶充分溶解,于酶标仪562nm处测定各孔吸光度 D (562)值。计算细胞相对存活率=[D(562)实验组- D(562)空白组]/[D( 5 62)对照组-D (562)空白组]。
1.4.2 荧光定量PCR检测矮壮素对MC3T3-E1细胞骨骼发育相关基因mRNA表达的影响PCR基因引物由奥科生物公司合成,结果见表1。以0μg/mL矮壮素作为对照组,8、40、200、1000μg/mL矮壮素染毒48h后经消化处理,收集细胞,酚氯仿法提取总RNA,验证总RNA完整性,使用Nano-drop2000测定总RNA样品纯度和浓度。利用逆转录试剂盒(Prime-ScriptTMRTPCR Kit)以Oligo dT为引物将1μg RNA逆转录为cDNA。Real-Time PCR按照SYBR Premix Ex TaqTM试剂盒说明书进行操作。以GAPDH为内参,采用2-△△CT计算各基因的mRNA相对表达量。

表1 检测基因引物序列
1.4.3 Western blot检测成骨相关蛋白的表达及MAPK信号通路的变化情况矮壮素染毒48h后经消化处理,收集细胞。使用RIPA提取细胞总蛋白,然后使用BCA蛋白定量试剂盒测定蛋白浓度。使用SDSPAGE电泳分离后,电转至NC膜,使用3%BSA进行磷酸化蛋白的封闭,5%脱脂奶粉进行非磷酸化蛋白的封闭,室温孵育2h后,各自分别按照1∶1000的稀释比例加入相应测定蛋白(ALP、BMP2、Runx2、GHR、ERK、p-ERK、JNK、p-JNK、Tunbulin)的一抗,包括,4℃孵育过夜。TBST洗涤5min, 共5次,山羊抗小鼠二抗(1∶5000)和山羊抗兔二抗(1∶5000)室温轻摇孵育2h,TBST洗涤5min,共2次,TBS洗涤 1次。将化学发光试剂盒A液和B液混合并覆盖于NC膜上,于凝胶成像系统采集数据。
1.5 统计学方法
应用SPSS22.0统计软件进行数据分析,各组指标比较均采用单因素方差分析,以 α=0.05为检验水准。
2 结果
2.1 矮壮素对MC3T3-E1细胞增殖的影响
MTT实验结果如图1,不同剂量(8~1000μg/mL)矮壮素在染毒24、48h时对MC3T3-E1细胞无明显细胞毒性,染毒72 h 时,1 0 00 μ g/mL组的细胞相对存活率与对照组相比虽然降低(P<0.05),但其相对存活率仍高于80%。

图1 矮壮素染毒不同时间对M C3T3-E1细胞相对存活率的影响
2.2 矮壮素对MC3T3-E1细胞成骨相关基因mRNA表达的影响
荧光定量PCR检测矮壮素染毒48h后细胞中ALP、OCN、GHR、IGF-1mRNA表达情况,如图2所示:ALP和OCN作为成骨细胞定向分化的标志物,其mRNA表达量随着矮壮素剂量的升高呈上升趋势,在1000 μg/mL剂量组mRNA表达量与对照组相比明显升高(P<0.05或P<0.01);GHR和IGF-1的mRNA的表达并没有发生明显的变化。

图2 不同浓度矮壮素染毒 4 8h后对MC3T3-E1 细 胞成骨相关基因 m RNA 表达的影响
2.3 矮壮素对MC3T3-E1细胞破骨相关基因表达的影响
荧光定量PCR检测矮壮素染毒48h后细胞中RANKL、OPG、IGF-1mRNA表达情况,如图3所示:在1000μg/mL的剂量组,RANKL mRNA表达明显上升(P<0.01),M-CSF和OPG mRNA表达与对照组相比差异无统计学意义;RANKL与OPG的比值,在1000μg/mL剂量组明显升高(P<0.05)。

图3 不同浓度矮壮素染毒 4 8h后对MC3T3-E1 细 胞破骨相关基因 m RNA 表达的影响
2.4 矮壮素对MC3T3-E1细胞骨骼发育相关蛋白的影响
Westerm blot检测MC3T3-E1细胞中ALP、BMP2、GHR、Runx2蛋白的表达情况,如图4所示:矮壮素染毒48h后,ALP蛋白的表达量没有发生明显的变化;BMP2、Runx2蛋白的表达量在1000μg/mL剂量组明显降低;GHR蛋白在8、40、200、1000μg/mL剂量组均明显降低。
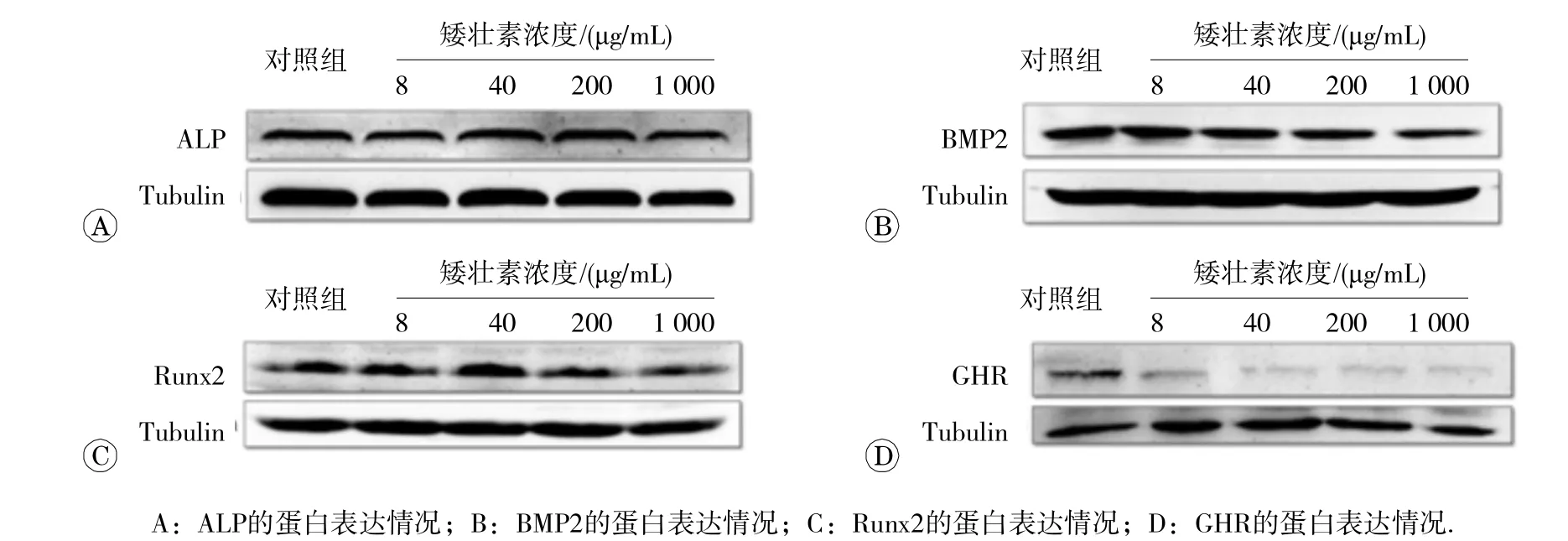
图4 矮壮素染毒 4 8h后对M C3T3-E1细胞骨骼发育相关蛋白的影响
2.5 矮壮素染毒48h后MAPK信号通路相关蛋白的变化
Western blot检测矮壮素染毒48h后MC3T3-E1细胞中MAPK信号通路相关蛋白的变化情况,如图5所示:不同浓度矮壮素染毒48h后,磷酸化JNK的表达量明显升高,而磷酸化ERK的表达量明显降低。

图5 矮壮素染毒48h后MC3T3-E1细胞MAPK通路相关蛋白的变化情况
3 讨论
骨骼发育一般通过成骨细胞和破骨细胞的动态变化进行调节[5]。成骨细胞是体内骨发育形成的关键细胞,对骨的发育、损伤修复、以及骨的代谢平衡和骨量的维持起着至关重要的作用。活跃的成骨细胞具有典型的蛋白合成结构,富含线粒体,粗面内质网及高尔基体发达等。成骨细胞富含较高的ALP,可以合成I型胶原,合成并分泌骨基质,表达 O CN和OPN基因,能够吸收和转运钙离子,具有在条件培养基中钙化的能力等,因此在骨形成过程中起到极其重要的作用[6]。
研究结果显示,矮壮素对小鼠前成骨细胞MC3T3-E1无明显细胞毒性,但可影响其骨骼发育相关基因及蛋白的表达。ALP作为成骨细胞早期分化标志,其表达量的多少影响着成骨细胞的分化[7-8]。OCN是由分化期成骨细胞分泌的蛋白,可反映成骨细胞的活跃程度[9]。生长激素(GH)和胰岛素样生长因子1(IGF-1)具有促进合成的作用,可以增加骨形成蛋白的表达量,促进成骨细胞的分化。同时,GH与靶器官的GHR结合发挥直接和间接的促生长作用,可以通过增强成骨细胞的功能从而增加骨的厚度而增加骨强度[10]。研究中测定ALP和OCN的mRNA的变化情况,发现矮壮素染毒48h后,ALP和OCN的 mRNA表达量均明显上升,但ALP蛋白表达量并没有发生明显的变化。同时在基因水平上检测生长激素受体(GHR)和胰岛素样生长因子1(IGF-1)的变化情况时,发现这两种蛋白的mRNA表达量并未发生明显变化;但在蛋白水平上,随着染毒剂量的增加,GHR蛋白表达量明显减少。该结果表明,矮壮素可能影响ALP和OCN的转录水平,但对ALP蛋白的翻译影响作用较小。并且矮壮素对GHR和IGF-1的转录无明显作用,但是抑制了GHR的翻译,导致GHR的表达量明显减少,这可能会影响生长激素对成骨细胞的作用,从而抑制成骨细胞的分化。
RANKL/RANK/OPG是研究骨骼发育的一个重要信号通路,主要调控成骨细胞与破骨细胞的信息交流。RANKL是核因子 κB受体活化因子配体,是RANK的相关配体,RANK是一种Ⅰ型跨膜蛋白,属于TNF受体家族,表达于许多细胞的表面,如破骨细胞前体[11-12]。在M-CSF存在的前提下,RANKL结合表达于破骨细胞前体的受体RANK,通过启动细胞内信号转导,促进破骨细胞成熟与分化。与RANK和RANKL不同,OPG不具有跨膜和胞质内的结构域,OPG通过阻止RANKL与RANK的结合,起负调节作用[13]。因此当RANKL/OPG的比例发生变化则可能影响破骨细胞的分化。本研究在mRNA水平上检测M-CSF、RANKL、OPG的表达情况,发现RANKL的表达量明显上升(P<0.01);MCSF 的表达呈上升趋势,OPG的表达量呈下降趋势,但其变化趋势都不具有统计学意义。分析RANKL/OPG其相对表达量,显示出明显升高(P<0.01),因此推测矮壮素会促进破骨细胞的分化成熟。
Runx2作为骨形成最早的标志基因,是成骨细胞开始分化的标志,能够激活骨钙蛋白、骨桥素、骨涎蛋白和Col1等成骨功能蛋白基因的转录和表达,缺乏Runx2的参与,成骨细胞无法完成分化和成熟等生理过程;Runx2在协调涉及成骨细胞分化的多个信号中发挥中心作用[14]。研究结果显示,矮壮素抑制了Runx2蛋白的表达。并且BMP2蛋白表达量也明显减少。BMP2作为重要的骨形成蛋白,对成骨细胞的分化成熟有着重要作用[8]。BMP2表达量的减少说明矮壮素抑制了MC3T3-E1向成熟成骨细胞的分化。
MAPK通路在骨骼发育过程中起着重要作用[15]。成骨细胞的生长、分化与MAPK信号转导通路密切相关[16]。己有研究显示,MAPK通路中,ERK通路可转导启动成骨细胞分化所需的信号[17],ERK通路可以在成骨细胞分化早期通过调节Runx2的磷酸化和活性,从而影响成骨细胞的分化[18]。本研究中发现矮壮素染毒后,MC3T3-E1细胞的分化可能与MAPK通路有关,推测可能与ERK通路和JNK通路相关。ERK蛋白的磷酸化水平被抑制,并且Runx2蛋白水平也减少。推测矮壮素有可能通过抑制ERK的磷酸化水平,进而抑制Runx2蛋白的表达,抑制了MC3T3-E1向成熟成骨细胞的分化。对于JNK通路对成骨细胞分化的作用,目前还没有定论[19]。有研究显示,JNK磷酸化水平的升高或者降低都有可能会抑制成骨细胞的分化[20-21]。 本研究中观察到,JNK磷酸化水平升高,可能在抑制MC3T3-E1成骨功能蛋白表达中发挥作用。
矮壮素作为常用的植物生长调节剂,广泛应用于农业生产中。本实验使用小鼠前成骨细胞MC3T3-E1对矮壮素的骨骼发育毒性进行了体外实验评价,发现矮壮素会影响该细胞骨骼发育相关蛋白的表达,且该作用可能与ERK和JNK信号通路有关,这为全面评价矮壮素的骨骼发育毒性提供了进一步的实验数据。但骨骼发育受体内激素分泌和细胞因子等多种因素共同调节,矮壮素对骨骼发育的作用机制还需从不同方面因素进行进一步研究。
[1]张曦,金芬,钱永忠,等.食品中矮壮素和缩节胺分析方法的研究进展[J].食品与发酵工业,2008,34(10):127-131.
[2]European FooDSafety.Review of the existing maximum residue levels for chlormequat according to Article12of Regulation[J].EFSAJ,2016,14(3): 44 22.
[3]LI C,JIN F,YU Z,et al.Rapid determination of chlormequat in meat by dispersive solid-phase extraction and hydrophilic interaction liquid chromatography(HILIC)-electrospray tandem mass spectrometry[J].J A Food Chem,2012,60(27):6816-6822.
[4]HUANG D,WU S,HOU X,et al.The skeletal developmental toxicity of chlormequat chloride and its underlying mechanisms[J].Toxicology,2017,381:1-9.
[5]HADJIDAKIS DJ,ANDROULAKISII.Boneremodeling[J].Ann NY AcaDSci,2006,1092(1):385- 3 96.
[6]SUDO H,KODAMA H A,AMAGAIY,et al.In vitro differentiation and calcification in a new clonal osteogenic cell line derived from newborn mouse calvaria[J].J Cell Biol,1983,96(1):191-198.
[7]BECK G R,ZERLER B,MORAN E.Phosphate is a specific signal for induction of osteopontin gene expression[J].P Natl AcaDSci USA,2000,97(15):8352-8357.
[8]HU Z,PEEL S A,HO S K,et al.Role of bovine bone morphogenetic proteins in bone matrix protein and osteoblastrelated gene expression during rat bone marrow stromal cell differentiation[J].J Craniofacial Surg, 2005, 16(6): 1006-1014.
[9]HAUSCHKA P V,LIANJB,COLE D E,et al.Osteocalcin and matrix Gla protein:vitamin K-dependent proteins in bone[J].Physiol Rev,1989,69(3):990-1047.
[10]CANALIS E.The fate of circulating osteoblasts[J].New EnglJMed,2005,352(19):2014-2016.
[11]ANDERSON DM,MARASKOVSKY E,BILLINGSLEY W L,et al.A homologue of the TNF receptor and its ligand enhance T-cell growth and dendritic-cell function[J].Nature,1997,390(6656):175-179.
[12]STOLINAM,SCHETTG,DWYER D,et al.RANKL inhibition by osteoprotegerin prevents bone loss without affecting local or systemic inflammation parameters in two rat arthritis models:comparison with anti-TNFαor anti-IL-1therapies[J].Arthritis Res Ther,2009,11(6):R187.
[13]TIAN H,FANY B. S tructure a nd mechanism of O PG & RANK &RANKL and their effect on bone diseases[J].ProgMod Biomed,2010,1 0 (20):3 9 63-3966.
[14]FRANCESCHI R T,XIAO G.Regulation of the osteoblastspecific transcription factor, Runx2: responsiveness to multiple signal transduction pathways[J].J Cell Biochem,2003,88(3):446-454.
[15]FRANCESCHI R T,XIAO G.Regulation of the osteoblastspecific transcription factor, Runx2: responsiveness to multiple signal transduction pathways[J].J Cell Biochem,2003,88(3):446-454.
[16]GUICHEUXJ, LEMONNIERJ, GHAYOR C, et al.Activation of p38mitogen-activated protein kinase and c-Jun-NH2-terminal kinase by BMP-2and their implication in the stimulation of osteoblastic cell differentiation[J].J BoneMineral Res,2003,18(11):2060.
[17]GE C,CAWTHORN W P,LIY,et al.Reciprocal control of osteogenic and adipogenic differentiation by ERK/MAP kinase phosphorylation of Runx2and PPARgamma transcription factors[J].J Cell Physiol,2016,231(3):587-596.
[18]GE C,XIAO G,JIANG D,et al.Identification and functional characterization of ERK/MAPK phosphorylation sites in the Runx2transcription factor[J].J Biol Chem,2009,284(47):32533-32543.
[19]GREENBLATTM B,SHIMJH,GLIMCHER L H.Mitogenactivated protein kinase pathways in osteoblasts[J].Annual Rev Cell Dev Biol,2013,29(1):63.
[20]李烨,刘文锋,刘如石,等.丙二醛通过激活p38和JNK通路抑制间充质干细胞成骨分化[J].中国生物化学与分子生物学报,2012,28(9):804-810.
[21]ZHANG GM.Ubiquitin ligase Smurf1controls osteoblast activity and bone homeostasis by targetingMEKK2for degradation[J].Cell,2005,121(1):101-113.

