卡比多巴抑制肝癌HepG2细胞增殖及其作用机制
秦 舒,朱玉蓉
流行病学研究表明,帕金森病(PD)患者需长期服用左旋多巴和卡比多巴,其多种恶性肿瘤的发病率显著低于正常健康人群,包括胃癌、肝癌、胰腺癌、直肠癌、前列腺癌、肺癌等,但黑色素瘤和乳腺癌除外[1]。由此推测,左旋多巴和卡比多巴是否可能具有抗癌作用。因此,针对左旋多巴进行了大量的研究,但实验结果并未证实左旋多巴具有抑制多种恶性肿瘤的作用[2]。但研究发现,卡比多巴的化学结构与苯肼十分相似。苯肼是吲哚胺-2,3-双加氧酶1(IDO1)的一种抑制剂,而IDO1则是细胞内色氨酸降解代谢的主要催化酶,其代谢产物犬尿氨酸又是芳香烃受体(AhR)的生理激活剂[3]。与此同时,大量相关实验表明,AhR参与细胞增殖、凋亡及免疫代谢[4-6],直接影响肿瘤的黏附、生长、迁移和侵袭。因此,不难提出假设,卡比多巴是否是通过影响AhR的活性来发挥抗癌作用。我国是乙肝大国,每年约有22万人死于原发性肝癌,其死亡率在恶性肿瘤中排名第2[7]。本实验建立肝癌HepG2细胞株的离体模型,通过不同浓度卡比多巴的干预,观察HepG2细胞的增殖能力、AhR的激活以及CYP1A1、CYP1A2、CYP1B1等靶基因转录水平的变化,借此验证卡比多巴是否具有抗癌作用,并探索其可能的药理机制,以期为肝癌的临床治疗提供实验依据。
1 材料与方法
1.1 主要细胞及仪器、试剂 人肝癌HepG2细胞株,购自美国典型培养物保藏中心(ATCC);胎牛血清(德国Biochrom公司);DMEM高糖培养基(美国Gibco 公司);卡比多巴、MTT、DMSO(美国 Sigma公司);自动酶标仪(美国 BIO-RAD 550型);高容量cDNA合成试剂盒(美国Invitrogen公司);引物序列(中国华大基因);Alexa Fluor 488、DAPI(美国 Molecular Probes公司);Ⅰ、Ⅱ抗(美国 Abcam 公司);荧光显微镜(瑞士MMI公司)。
1.2 细胞培养 HepG2细胞株在37℃条件下,使用DMEM高糖培养基(10%的胎牛血清、青霉素100 IU/ml、链霉素 100 g/L),在 5%CO2的环境中培养,并传代10~20代。所有实验均采用处于对数生长期的细胞,并重复3次。
1.3 MTT法测定细胞生存率 取HepG2细胞接种于96孔板中,每孔1×104个细胞,放入培养箱中培养24 h。然后按实验要求分别加入终浓度为0、1、2.5、5、7.5、10、12.5、15 μM 的卡比多巴。 以上各组每天弃上清,并更换一次卡比多巴,2 w后终止培养。向每个孔中加入MTT(20 μl,5 g/L)和DMEM培养液(180 μl, 无血清); 继续培养 4 h 后, 加入 150 μl DMSO,37℃下溶解10 min。然后放入自动酶标仪,测定吸光度值(A570nm),并按照下面的公式计算细胞生存率:细胞生存率=(实验组A570nm值)/(对照组A570nm值)×100%。
1.4 实时荧光定量 PCR(qRT-PCR)测定细胞中CYP1A1、CYP1A2和 CYP1B1 mRNA的表达 取HepG2细胞,将其制成单细胞悬液,以每孔1.8×105个细胞接种6孔板,待细胞贴壁生长良好后,分别加入卡比多巴(0、10、50 μM)、CH223191(0、10 μM),作用6 h,提取各组细胞的RNA。使用高容量cDNA合成试剂盒逆转录合成cDNA。引物序列见表1。反应条件:预变性 95 ℃,30 s;变性 95 ℃,5 s;退火、延伸60℃,30 s, 共40个循环;65~95℃(每次增加0.5℃)测定熔解曲线。扩增得到的Ct值使用2-ΔΔCt法计算目的mRNA的相对表达量。
1.5 免疫荧光观察AhR表达 使用4%多聚甲醛固定细胞,加入Ⅰ抗(小鼠抗 AhR 抗体)(1∶50),在4℃条件下孵育45 min;再加入Ⅱ抗(羊抗鼠IgG,绿色)(1∶400)在37 ℃条件下孵育 2 h;接着加入 DAPI染色5 min;然后在荧光显微镜下观察。

表1 PCR引物序列
1.6 统计学方法 应用SPSS20.0软件分析,计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LST-t检验,假设检验水准a=0.05。
2 结果
2.1 不同浓度卡比多巴对HepG2细胞生长的抑制作用不同浓度的卡比多巴 (1、2.5、5、7.5、10、12.5、15 μM)对HepG2细胞增殖均有显著的抑制作用(P<0.05),且呈现浓度依赖性(图 1)。
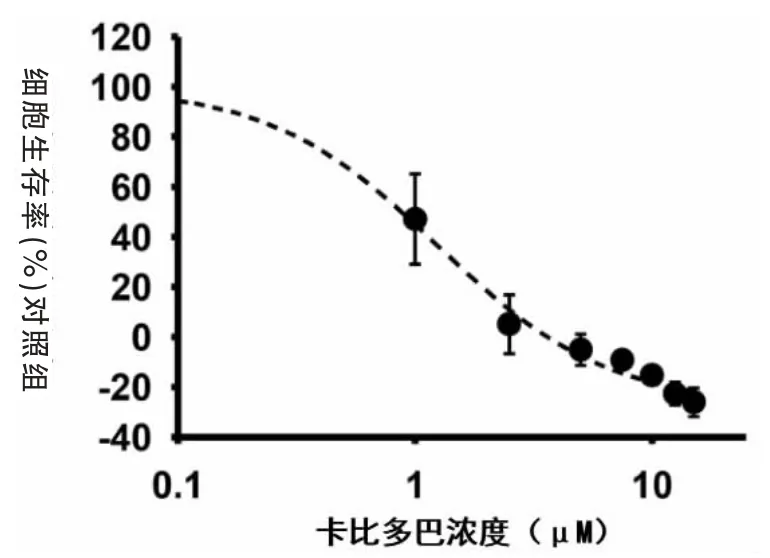
图1 不同浓度卡比多巴对HepG2细胞生长的抑制作用
2.2 不同浓度卡比多巴对 CYP1A1、CYP1A2和CYP1B1基因表达的影响 卡比多巴显著增加了CYP1A1、CYP1A2和 CYP1B1 mRNA 的含量(P<0.05),且呈现显著的浓度依赖性(图 2、3)。

图2 不同浓度卡比多巴对于CYP1A1 mRNA表达水平的影响

图3 不同浓度卡比多巴对于CYP1A2和CYP1B1 mRNA表达水平的影响
2.3 CH223191抑制卡比多巴的阻断作用 卡比多巴可显著增加CYP1A1 mRNA的相对水平(P<0.05);加入 CH223191(AhR 的特异性拮抗剂)后,可有效阻断卡比多巴对于CYP1A1基因表达的激活作用(P<0.05,图 4)。

图4 CH223191阻断卡比多巴对于CYP1A1基因表达的激活作用
2.4 卡比多巴处理导致AhR的激活 免疫组化染色显示,相比于空白对照组,卡比多巴处理的实验组细胞核(蓝色)中出现了AhR(绿色),提示AhR被激活,并发生核转移(图5)。

图5 卡比多巴激活AhR并发生核转移(×100)
3 讨论
卡比多巴通过抑制外周多巴脱羧酶来防止左旋多巴转化为无法通过血脑屏障的多巴胺[8],从而丧失药效。因此,其多与左旋多巴配伍,常用于PD的辅助治疗。临床推荐用量为50~100 mg/d,但即使将其用量提高到450 mg/d,仍具有很高的安全性[9],证明其毒副作用小。本实验结果显示,较低浓度(1 μM)的卡比多巴即可显著抑制HepG2细胞的生长增殖,且呈现浓度依赖性,证实其具有高效的抗癌作用。
受到卡比多巴分子结构的启发,推测其药理作用的靶点可能是AhR。它是一种配体依赖性的转录因子,通过与不同配体的结合而激活,后以异二聚体复合物的形式发生核转移,通过经典/非经典多条信号传导通路激活下游靶基因[10]。研究表明,AhR在多种肿瘤组织中表达上调,包括肝癌[11]。AhR活化后改变肿瘤细胞周期,促进其生长增殖,并抑制凋亡[5];同时降低其的接触能力,增加转移和侵袭的可能[12]。陈艳美等[13]利用RNA干扰HCCLM3细胞中的AhR,发现HCCLM3细胞的增殖和迁移能力显著降低;将RNA干扰的HCCLM3细胞注射到裸鼠体内,其肿瘤生长也受到了显著的抑制。本实验通过免疫组化染色显示,卡比多巴引起了AhR激活并发生核转移;RT-PCR结果显示,卡比多巴导致3种目标基因 CYP1A1、CYP1A2和 CYP1B1 mRNA水平的增高。同时,添加CH223191可有效阻断了CYP1A1的转录,这些均证明卡比多巴是通过激活AhR来发挥其抗肿瘤作用,这与文献描述相矛盾。究其原因,可能是因为AhR具有配体依赖性和双重调控性。配体依赖性是指不同类型的配体同样作用于AhR,但最终可能产生促癌和抑癌两种截然不同的结果,如多环芳烃、卤代芳烃等配体结合AhR后,主要发挥促癌作用;而苯并噻唑、氨基黄酮等配体结合AhR后,则主要发挥抑癌作用[14]。双重调控性是指同一种配体在两种不同的环境中与AhR结合,但结果可能分别表现为活化和抑制AhR,如山柰酚在MCF-7细胞中表现为AhR的激动剂,诱导细胞死亡;而在含有TCDD的环境中,山柰酚则表现为AhR的拮抗剂,减少代谢毒物,发挥细胞保护作用[15]。卡比多巴可能就是一种特异性配体,通过与AhR结合,诱导其构象改变,活化并产生抑制肝癌细胞生长增殖的生物学效应。但具体的作用机制尚不清楚,有待在后续的实验中进一步深入研究。
[1] Disse M,Reich H,Lee PK,et al.A review of the association between parkinson disease and malignant melanoma[J].Dermatologic Surgery,2016,42(2):141.
[2] Inzelberg R,Israelikorn SD.The particular relationship between Parkinson's disease and malignancy:a focus on skin cancers[J].Journal of Neural Transmission,2009,116(11):1503-1507.
[3] 徐跃洋,吴俊军.吲哚胺-2,3-双加氧酶IDO1抑制剂研究进展[J].中国新药杂志,2016(4):425-432.
[4] KalmesM,Hennen J,ClemensJ,etal.Impactofaryl hydrocarbon receptor(AhR)knockdown on cell cycle progression in human HaCaT keratinocytes[J].Biological Chemistry,2011,392(7):643-651.
[5] Miglio G,Rosa AC,Rattazzi L,et al.Protective effects of peroxisome proliferator-activated receptor agonists on human podocytes:proposed mechanisms of action[J].British Journal of Pharmacology,2012,167(3):641.
[6] 李善宝,徐军明.色氨酸2,3-双加氧酶在色氨酸分解代谢及免疫调节中的作用[J].国际外科学杂志,2016,43(7):491-494.
[7] 陈冬,王仁本.原发性肝癌外放疗临床应用现状[J].中华肿瘤防治杂志,2015,22(1):76-80.
[8] Ahlskog JE,Muenter MD.Frequency of levodopa-related dyskinesias and motor fluctuations as estimated from the cumulative literature[J].Movement Disorders,2001,16(3):448-458.
[9] Brod LS,Aldred JL,Nutt JG.Are high doses of carbidopa a concern?A randomized clinical trial in Parkinson's disease[J].Movement Disorders,2012,27(6):750-753.
[10] Esser C.The Aryl Hydrocarbon receptor in immunity:tools and potential[M]//Suppression and Regulation of Immune Responses.Springer New York,2016:239-257.
[11] Liu Z,Wu X,Zhang F,et al.AhR expression is increased in hepatocellular carcinoma [J].Journal of Molecular Histology,2013,44(4):455-461.
[12] Ishida M,Mikami S,Kikuchi E,et al.Activation of the aryl hydrocarbon receptor pathway enhances cancer cell invasion by upregulating the MMP expression and is associated with poor prognosis in upper urinary tract urothelial cancer[J].Carcinogenesis,2010,31(2):287-295.
[13] 陈艳美,姜燕.AHR小干扰RNA对肝癌HCCLM3细胞体外增殖和体内肿瘤生长的影响[J].肿瘤,2014,34(3):223-230.
[14] 何珩,张智慧.AHR与肿瘤发生发展相关性的研究进展[J].肿瘤预防与治疗,2017,30(3):226-231.
[15] Safe S,Lee SO,Jin UH.Role of the aryl hydrocarbon receptor in carcinogenesis and potential as a drug target[J].Toxicological Sciences,2013,135(1):1.

