吉泰盆地古樟群体遗传多样性分析
钟永达 田晓娟 李彦强 刘立盘 杨爱红 刘淑娟 余发新
(江西省科学院生物资源研究所,江西省观赏植物遗传育种重点实验室,江西 南昌 330096)
香樟 (Cinnamomumcamphora) 是我国重要的经济和用材树种,主要分布在我国台湾省和长江以南数省。朝鲜、越南、日本等地亦有分布,其他各国有引种栽培[1]。香樟是一种古老的树种,早在石炭纪中就有香樟植物的化石,而且中国古代人民栽培利用香樟历史悠久,在距今约7 000年的浙江河姆渡遗址中就发现有樟木的使用,在两三千年就有栽培香樟的记载[2-3]。1999年香樟被列入国家二级重点保护野生植物[2]。吉泰盆地是江西省最大的盆地,地域上包括吉安地区8县1市 (吉安市、泰和县、吉水县、吉安县、永丰县、新干县、峡江县、安福县、万安县)。盆地土层深厚,土壤肥沃,气候温和湿润、雨量丰沛、光照充足,非常适宜香樟的生长[4-5]。永丰县现有古樟林20余处,泰和县16处,安福县15处。其中,安福县400年以上的香樟有8 700多株,千年以上的有200多株,有2株香樟为汉代遗物,树龄2 000余年[3,6]。香樟作为一种古老树种,在长期的进化过程中,受到土壤、气候和人为干扰等外部因素影响,造成了基因的遗传漂变、基因渐渗概率改变以及瓶颈效应等,最终不可避免的导致香樟群体遗传多样性水平和遗传结构发生改变[7-8]。目前,我国学者开展了中国香樟部分地区的遗传多样性与遗传结构研究[9-14],对了解我国香樟的遗传变异来源和规律,指导香樟种质资源保护,提高香樟良种选育水平起到了重要作用。本研究对吉泰盆地的古樟群体进行收集并育种,调查各材料的种子性状和苗期性状,分析各性状间的遗传变异程度和相关性,并进行聚类分析,旨在了解吉泰盆地古樟群体的原始遗传多样性信息,为进一步筛选香樟核心种质,进行种质资源保护和良种选育提供参考。
1 材料与方法
1.1 试验材料
供试材料为来自吉泰盆地8县1市的148株古樟树 (树龄大于100 a以上),其中安福县、泰和县和新干县各20株,吉安县18株,吉水县和永丰县各16株,峡江县和万安县各14株,吉安市10株 (表1)。
1.2 试验设计
2014年11月底,待种子呈紫黑色后,利用高枝剪从树上直接采种,每棵树采种1 kg左右带回实验室。将种子用清水浸泡2~3 d,使果皮吸水软化,用细沙搓揉除净果皮果肉,将种子冲洗干净,晾干后即可进行种子大小测量并湿沙贮藏。沙藏后盖上塑料薄膜,1个星期左右喷水1次,保持温度在15 ℃以下。2015年2月底在江西省南昌县黄马乡育苗基地进行播种。试验采用完全区组设计,双行区,行长1.2 m,株距12 cm,平均行距20 cm,3次重复,人工点播,以常规方法进行田间管理。
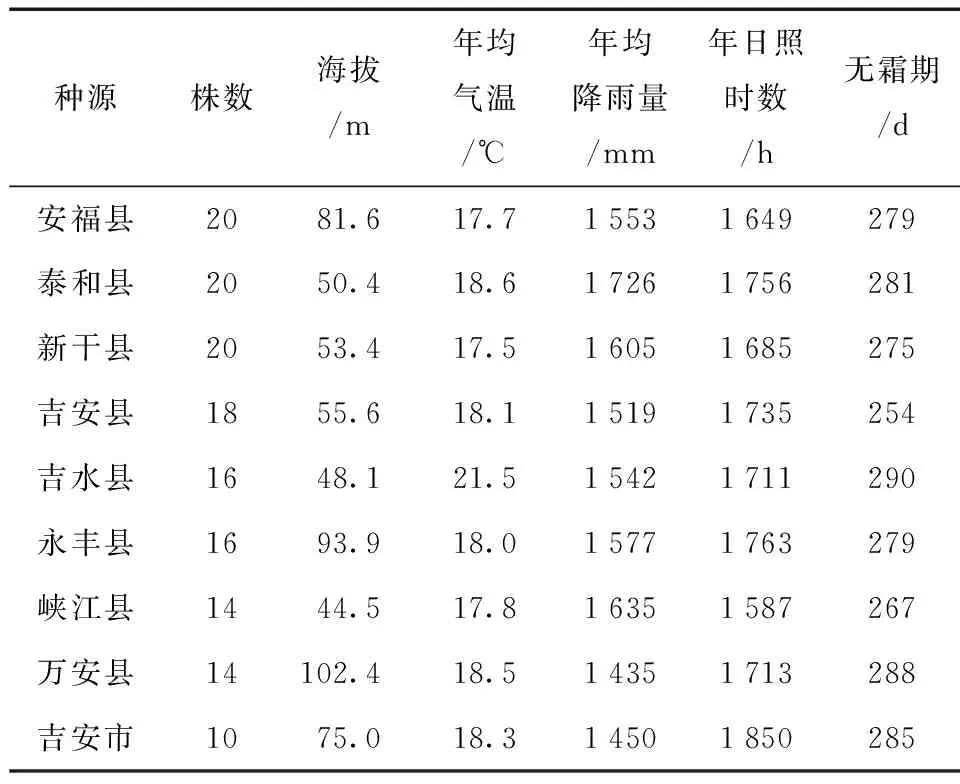
表1 供试148棵古樟的来源及分布Table 1 The provenance and distribution of 148 C.camphora over 100 years
1.3 性状测定
种子大小和千粒质量的测量利用扫描仪和Image J软件进行。具体步骤为:选取待测香樟种子,平铺于白布上,种子之间隔开一定距离。在白布边上摆一把有刻度的直尺,作为 “标尺” 用于在该扫描模式下像素值与距离值的转换。采用紫光高清拍摄仪Unispro G760 (或其他扫描仪) 进行扫描,保存文件。运行Image J软件,open导入照片。选取直尺上已知距离,打开analyze/set scale,设定参数。distance inpixels为扫描时的分辨率;known distance为选取的直尺距离;pixel aspect ratio可理解为放大倍数,由于扫描时多为100%扫描,此处设置为1.0;unit of length为已知距离的长度单位,点击ok进入下一步骤。 打开Image/type/8-bit,将待测种子彩色图像转换成黑白二值图像,打开Image/adjust/threshold,种子自动用黑色填充。最后,打开analyze文件下的analyze particles,设置size (10~100 mm2),circularity (0.50~1.00)。点击ok,输出种子面积大小及个数。该结果可以保存也可直接复制粘贴至Excel表中进行处理。用精度为0.001 g天平称量,根据Image J软件测定的粒数,换算成千粒质量。2015年12月底在各重复中每小区选中间30株调查苗高和地径,调查按常规方法进行。
1.4 数据分析
H′=-∑(Pi×lnPi)
(1)
式中:H′表示Shannon′s信息指数,Pi表示第i种表型出现的频率。
2 结果与分析
2.1 古樟的表型性状及遗传变异情况
148株古樟的4个表型性状及变异系数统计结果见表2。4个性状的变异系数在13.92%~18.55%之间,平均变异系数为16.51%。地径的变异系数最大,种子大小和苗高次之,千粒质量最小。4个数量性状的遗传多样性指数介于3.30~3.36之间,最高的是种子大小,苗高最小,平均多样性指数为3.34,表现出较高的遗传多样性。对4个性状的种源间和群体内个体间差异进行了方差分析,结果表明:4个性状在种源间的差异均达到极显著水平 (P< 0.01),除苗高性状在群体内个体间差异达到显著水平 (P< 0.05),种子大小、千粒质量和地径等3个性状群体内个体间差异均不显著。

表2 参试古樟的表型性状及变异系数Table 2 The phenotypic traits and variation coefficient of C.camphora over 100 years
2.2 表型性状间的相关分析和主成分分析
对4个表型性状进行了相关性分析 (表3),结果表明:种子大小和千粒质量显著正相关;苗高和种子大小、千粒质量表现出极显著的正相关;地径只和千粒质量显著正相关,与种子大小和苗高无显著相关性。

表3 江西古樟各性状间的相关性分析Table 3 The correlation analysis of phenotypic traits of C.camphora over 100 years from Jiangxi Provenance
注:**表示差异极显著 (P< 0.01)。
主成分分析结果表明 (表4):第1主成分的特征值和贡献率最大,分别为3.075和76.88%,说明利用第1个主成分就能解释不同香樟个体表型性状的绝大部分遗传信息含量。第一主成分包含了全部的表型信息,4个表型性状的绝对值都较大,说明种子大小、千粒质量大的个体其苗高、地径也较好,种子大小在一定程度上决定了后期植株苗期的生长量。

表4 4个表型性状的特征向量、特征值、贡献率及累计贡献率Table 4 Power vector, eigenvalues, contribution rate, and cumulative contribution rate of 4 phenotypic traits
2.3 聚类分析
利用SPSS软件对各表型数据进行Z得分标准化转换,以欧式距离为遗传距离,采用Ward法进行聚类分析。从聚类图可以看出 (图1),在遗传距离为5处,9个群体可以分为5个类群,类群的组成及各类群的表型性状平均值如表5所示。安福县和吉水县2个种源组成第I个类群,其种子大小和千粒质量中等,但苗高和地径较小;第II个类群有泰和县和新干县组成,表现为种子大小和地径最小,千粒质量和苗高中等;第III个类群由万安县、峡江县和永丰县组成,表现为苗高和地径中等,种子大小和千粒质量较小;吉安县单独为第IV类群,表现为种子大小、千粒质量、苗高和地径均较大;吉安市为第V个类群,其种子大小、千粒质量、苗高和地径等4个性状均为最大。相关性分析表明,种子大小与千粒质量性状与海拔、年均气温、年均降雨量、年日照时数和无霜期等环境因子均无显著相关性。

图1基于表型性状的江西古樟群体聚类
Fig.1 Cluster dendrogram of JiangxiC.camphoraover 100 years based on analysis of phenotypic traits

表5 各类群表型性状平均表现Table 5 The average performance of phenotypic traits of each group
3 结论与讨论
表型性状遗传多样性研究是检测林木群体遗传变异最简单、直接的方法。本研究对吉泰盆地9个种源,148株古樟的4个表型性状进行了形态多样性分析,结果显示4个性状的平均多样性指数为3.34,平均变异系数为16.51%,说明吉泰盆地古樟具有丰富的多样性。
方差分析可以从种源和群体内个体两个层次分析群体的遗传多样性水平,为香樟的遗传改良提供理论依据。本研究结果显示4个性状在种源层次均呈现出极显著差异,而且从均方比例来看,决定各性状的主要是种源,说明种源是决定香樟各性状的决定因素,与前人的研究结果基本一致[11, 14, 16-17]。然而本研究中种源内群体内个体间除了苗高性状为显著差异,其他性状差异均不显著,暗示吉泰盆地香樟群体间虽然具有丰富的遗传多样性,但在长期的自然演替和进化过程中,由于地理隔离等原因,群体内保持了遗传上的稳定性,形成了不同的地理种源。
植物种子大小能直接影响幼苗建成,与幼苗高度显著正相关[18-19],而与幼苗的相对生长率呈负相关[20]。本研究中的研究结果也表明香樟苗高和种子大小及千粒质量呈极显著的正相关,但地径只与千粒质量显著正相关,且与种子大小相关性不显著。前人的研究结果也表明,地径与地理气候因子均无显著相关性[14],也不影响树木的后期生长[11],反映了地径性状可能是微效多基因和环境因子共同调控的结果。利用主成分分析,第一个主成分解释了4个表型性状的全部信息,贡献率达到76.88%,而且4个性状的特征向量都具有较高的值,说明种子大小在一定程度上决定了植株苗期生长量。
利用表型性状将吉泰盆地9个古樟群体聚为5大类群。其中位于吉泰盆地腹地中间的第V类群 (吉安市) 和第IV类群 (吉安县) 群体表现最好,相邻的安福县、吉水县组成的第I类群和第II类群的泰和县等3个县的种子大小和千粒质量次之,最外围的万安县、永丰县和峡江县组成的第III类群种子最小,最轻 (表5),呈现出中心大、四周小的分布模式。聚类结果表明其与吉泰盆地的地形地貌具有显著相关性。吉泰盆地中部地势最低,为赣江及其支流形成的河谷冲击平原,经台地、岗地、低丘、高丘过渡到低山和中山,周围山地地势逐渐升高,向中心呈环状阶梯式排列,形成中部低、周围高的地形地貌。相关分析结果显示:这种分布模式可能是气象因子与土壤条件等多因素共同作用的结果,例如降蒸差、坡向、凋落物厚度、沉积速率、土壤湿度、土壤颗粒大小、土壤肥力、土壤细菌构成等[21-23]。
现有的研究表明,基于表型性状的遗传多样性研究仍是进行林木种质资源收集,评价及遗传改良的重要手段。本研究基于吉泰盆地特殊的地形及古樟种质资源为对象,分析了其群体间的遗传多样性水平,为后续香樟核心种质库的构建提供准确的信息数据,为种质资源保护策略的制定、良种选育亲本选择及实际生产中种子的调运提供参考依据。
[1] 戴宝合. 野生植物资源学[M]. 北京: 农业出版社, 1993.
[2] 国家林业局. 国家重点保护野生植物名录 (第一批). 第4号令[Z]. 北京: 农业部,国家林业局, 1999.
[3] 黎祖尧, 陈尚钘. 江西樟树[M]. 南昌: 江西科学技术出版社, 2015.
[4] 周明枞, 杜国华. 吉泰盆地土壤基层分类[J]. 土壤, 1985, 17(3): 25-32.
[5] 杨格格, 杨艳昭, 封志明, 等. 南方红壤丘陵地区土地利用变化特征: 以吉泰盆地为例[J]. 地理科学进展, 2010, 29(4): 483-488.
[6] Zhou Y, Yan W D. Conservation and applications of camphor tree (Cinnamomumcamphora) in china: Ethnobotany and genetic resources[J]. Genetic Resources and Crop Evolution, 2015, 63(6): 1049-1061.
[7] 马逸麟, 谢长瑜, 胡晨琳, 等. 江西省吉泰盆地土地质量评价[J]. 物探与化探, 2015, 39(2): 387-395.
[8] 文亚峰, 韩文军, 吴顺. 植物遗传多样性及其影响因素[J]. 中南林业科技大学学报, 2010, 30(12): 80-87.
[9] 潘晓华. 樟树居群遗传多样性及遗传结构的RAPD分析[D]. 福州: 福建师范大学, 2004.
[10] 任华东, 姚小华. 樟树种子性状产地表型变异研究[J]. 江西农业大学学报, 2000, 22(3): 370-375.
[11] 姚小华, 任华东, 孙银祥, 等. 樟树种源/家系早期性状变异及选择研究[J]. 江西农业大学学报 (自然科学版), 2002, 24(3): 330-335.
[12] 任华东, 姚小华, 孙银祥, 等. 樟树种源苗期生物量变异及其综合评价[J]. 林业科学研究, 2000, 13(1): 80-85.
[13] 林声庆. 樟树一年生幼苗遗传变异研究[J]. 安徽农学通报, 2012, 18(14): 24-26.
[14] 姚小华, 任华东, 吴柯久, 等. 樟树苗期遗传变异研究[J]. 江西农业大学学报, 1999, 21(3): 320-328.
[15] 白鹏, 程须珍, 王丽侠, 等. 小豆种质资源农艺性状综合鉴定与评价[J]. 植物遗传资源学报, 2014, 15(6): 1209-1215.
[16] 李芳, 金志农, 黎祖尧, 等. 樟树种子性状及对生境因子的响应[J]. 江西农业大学学报, 2017, 39(1): 92-100.
[17] 钟永达, 袁凡, 孟伟伟, 等.材用樟树遗传变异与苗期选择[J]. 南昌大学学报 (理科版), 2016, 40(2): 197-204.
[18] 张忠. 树木种子大小与实生苗生长物候现象的关系[J]. 国外林业, 1995(4): 1-4.
[19] Jakobsson A, Eriksson O. A comparative study of seed number, seed size, seedling size and recruitment in grassland plants[J]. Oikos, 2000, 88(3): 494-502.
[20] Wu G, Chen M, Zhou X, et al. Response of morphological plasticity of three herbaceous seedlings to light and nutrition in the qing-hai tibetan plateau[J]. Asian Journal of Plant Sciences, 2006,5(4):635-642.
[21] Stromberg J C, Boudell J A. Floods, drought, and seed mass of riparian plant species[J]. Journal of Arid Environments, 2013, 97(10): 99-107.
[22] Csontos P, Tamas J, Podani J. Slope aspect affects the seed mass spectrum of grassland vegetation[J]. Seed Science Research, 2004, 14(4): 379-385.
[23] Grubb P J. Seed mass and light-demand: The need to control for soil-type and plant stature[J]. New Phytologist, 1998, 138(1): 169-170.

