18O标记联合高效液相色谱-高分辨率质谱技术定量测定阿胶中的明胶
沙小梅,胡姿姿,涂宗财,,*,张路正,李 鑫,王 辉,张 露,黄 涛
(1.江西师范大学生命科学学院,江西 南昌 330022;2.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
阿胶是传统中药之一,由驴皮中的主要成分胶原蛋白部分断裂而产生,被广泛用于补充血红细胞和血红蛋白[1-2]。除了补血功效,阿胶还具有增强免疫力[3]和抗疲劳活性[4]。阿胶与人参、鹿茸并称为最有价值的3 种传统中药材[5],此外,含有阿胶的零食和营养品也备受欢迎。目前,阿胶已广泛销往多个地区,尤其是亚洲国家,如中国、日本、韩国、马来西亚等。
近年来,由于高需求和有限的驴皮供应,大量其他种类的明胶被加入阿胶产品,由此引发的阿胶掺假事件使得消费者对阿胶产品质量产生了担忧和困惑。市场上,每年明胶产量大约为326 000 t,其中95%以上的明胶源于猪和牛[6-7]。在掺假的阿胶产品中,发现了大量的牛皮明胶和猪皮明胶。阿胶、牛皮明胶和猪皮明胶均属于哺乳动物明胶,同源性非常高。对于哺乳动物明胶来源的鉴定,国内外科研工作者采用了许多方法进行攻关,包括高效液相色谱法[8]、磷酸钙沉淀法[9]、红外光谱法[10-11]、电泳技术[12]、酶联免疫吸附测定[13]、聚合酶链式反应技术[14-16]、高效液相色谱-串联质谱联用技术[17-19]等。其中,基于明胶的特征性多肽检测,高效液相色谱-串联质谱联用被认为是一种有效的明胶鉴定方法[20]。Cheng Xianlong等[21]运用高效液相色谱-串联质谱联用技术鉴定了5 种明胶(阿胶、牛皮明胶、猪皮明胶、龟甲胶和鹿角胶),然而每种明胶中只鉴定了一个特征性多肽。课题组在前期研究中,通过高效液相色谱-高分辨率串联质谱技术(high performance liquid chromatography-linear ion trap/Orbitrap high-resolution mass spectrometry,HPLCLTQ/Orbitrap MS/MS)系统研究了阿胶、牛皮明胶和猪皮明胶的鉴定。在目标明胶含量低于10%时,于3 种明胶混合物中,分别找到了5、11 个和15 个阿胶、牛皮明胶和猪皮明胶的特征性多肽。明胶溯源是识别阿胶掺假的第一步,若能进一步确定各明胶的精确含量将为阿胶品质监控提供技术支撑。
由于具有简单、高效、特异性标记于精氨酸或赖氨酸残基的C端等优点,胰蛋白酶催化的18O标记法广受欢迎[22-24]。本课题组通过胰蛋白酶催化的18O标记和生物质谱技术建立了纯明胶(牛皮明胶、猪皮明胶)的定量方法[25],但是否能用于明胶混合物中对目标明胶进行定量还有待进一步研究。因此,本实验选定阿胶和牛皮明胶为研究对象,通过两部分研究建立阿胶的定量方法。首先,通过检测18O标记情况和18O/16O比值,分析18O标记和生物质谱技术是否能用于阿胶定量。其次,以不同比例混合阿胶和牛皮明胶,分别测定混合物中阿胶和牛皮明胶的添加量,分析18O标记和生物质谱技术在明胶混合物中定量目标明胶的准确性。
1 材料与方法
1.1 材料与试剂
阿胶 山东东阿阿胶公司;牛皮明胶(G9382)、胞内蛋白酶赖氨酸-C(Lys-C) 美国Sigma公司;O(97%) 美国Cambridge Isotope Laboratories公司;胰蛋白酶、ProteaseMax表面活性剂 美国Promega Corporation公司;所有其他的试剂均为分析纯。
1.2 仪器与设备
HPLC 日本Shimadzu公司;C18柱 美国Phenomenex公司;LTQ/OrbitrapVelos质谱仪 美国Thermo Fisher Scientific公司;超纯水设备 德国Millipore公司。
1.3 方法
1.3.1 阿胶样品的预处理
在50 ℃水浴锅中,用去离子水溶解阿胶,制备40 mg/mL的溶液。将阿胶溶液置于离心机中,14 000×g离心20 min。冷却后,上清液进一步通过0.45 μm的过滤器处理,得到的滤液冻干,备用。
1.3.2 明胶样品的酶解
将阿胶、牛皮明胶及其混合物(阿胶和牛皮明胶以10∶1、1∶1和1∶10质量比混合制得)溶解于20 mmol/L的Tris-盐酸缓冲液(pH 8.0,含有50 mmol/L的氯化钠、50 mmol/L的氯化钙),制成1 mg/mL的溶液。100 μL的明胶溶液和100 μL的Tris-盐酸缓冲液混匀后,加入ProteaseMax表面活性剂使其在混合溶液中的质量浓度达到0.1 mg/mL。加入15 μL的二硫苏糖醇(100 mmol/L),置于95 ℃水浴锅中加热5 min,冰浴冷却。加入30 μL的烷基化试剂(100 mmol/L的碘乙酰胺),并于常温下暗室放置20 min。加入20 μL的Lys-C(0.05 μg/μL),置于37 ℃酶解4 h。加入20 μL的胰蛋白酶(0.1 μg/μL),混合溶液于37 ℃酶解过夜。
1.3.3 纯明胶酶解物的18O标记
50 μL胰蛋白酶(0.1 μg/μL)加入纯明胶酶解液中,混合均匀。将溶液分成两等份,冻干。每份冻干样中加入色谱级乙腈80 μL,采用真空离心机在室温下去除乙腈。向一份干样中加入10 μL色谱级乙腈和40 μL H218O,另一份干样中加入10 μL色谱级乙腈和40 μL H216O,置于30 ℃孵化过夜。标记结束后,采用半胱氨酸烷基化的方法使胰蛋白酶失活,将副反应(即标记后的18O被16O替代)速率降至最低。胰蛋白酶的灭酶方案是在Staes等[26]报道的实验方案基础上经过适当修饰而确定。10 μL三(2-羧乙基)膦(50 mmol/L)置于一个离心管中,干燥;15 μL碘乙酰胺(100 mmol/L)置于另一个离心管中,暗室下干燥。将18O标记好的样品转移至装有三(2-羧乙基)膦的离心管中,37 ℃孵化60 min;再将溶液转移至装有碘乙酰胺的离心管中,37 ℃暗室孵化90 min。16O标记的样品也要进行胰蛋白酶的酶解处理。上述步骤完成后,将样品置于-80 ℃冰箱贮藏备用。
1.3.4 高效液相色谱-质谱检测
运用高效液相色谱-质谱对明胶酶解液(18O标记物和16O标记物以不同比例混合)检测,实验参数主要包括液相工作条件和质谱参数。
本实验中的液相色谱具有2 个泵,流速为50 μL/min,采用的柱子为C18柱(2.0 mm×100 mm)。流动相A为5%的乙腈和95%的水,含有体积分数0.1%的甲酸。流动相B为95%的乙腈和5%的水,含有体积分数0.1%的甲酸。明胶酶解液梯度洗脱条件:0~5 min,2% B;40 min,20% B;42 min,95% B。明胶酶解液上样量为3 μg,液相中的流出组分直接注入LTQ/Orbitrap质谱检测,采用HCD断裂收集到的一级质谱,鉴定明胶的特征性多肽。碰撞能量设置为35%,动态排除时间设置为90 s。
1.3.5 数据库检索
采用数据转换软件Thermo proteome discoverer将raw格式数据转化成mgf,再提交至处理软件Mascot Daemon检索,数据库为实验室自设数据库(包含牛皮和猪皮I型胶原蛋白序列)。检索参数包括:半胱氨酸经碘乙酰胺(C)为固定修饰;氧化(P、K)为可能性修饰;最大的未酶切位点为5;一级质谱错误率为±0.025‰;二级质谱错误率为±0.5 Da。当Mascot分数大于40时,多肽峰被认定为阳性鉴定或准确度极高(P<0.05)[27]。目标多肽为基于阿胶或牛皮明胶独一无二的特征性多肽[17]。
1.3.618O/16O比值计算
18O标记的多肽与16O标记的多肽含量比可以通过单一同位素质谱峰的峰高计算。考虑到13C的干扰和一个18O原子的并入,18O/16O比值的计算公式如下[29-30]:

其中:I0、I2和I4分别为检测到的没有被18O标记的多肽单一同位素质谱峰、质量增加2 Da的质谱峰和质量增加4 Da的质谱峰的相对强度;m0、m2和m4分别表示理论上的多肽单一同位素质谱峰、质量增加2 Da的质谱峰和质量增加4 Da的质谱峰的相对强度。在本研究中,根据Johnson和Muddiman的报道[28],m4/m0和m2/m0的值分别用2×10-12Mr3.2684和3×10-7Mr1.9241代替(Mr为多肽的相对分子质量)。本实验中的阿胶和牛皮明胶定量,分别选取5 个和10 个特征性多肽质谱峰,计算各个质谱峰18O/16O比值的平均值用于减小错误率。
2 结果与分析
2.1 18O标记阿胶的特征性多肽分析
课题组前期研究结果表明,18O标记法结合生物质谱技术能用于纯牛皮明胶的定量[25]。为研究混合物中阿胶和牛皮明胶的定量,本实验首先以纯阿胶为研究对象,研究18O标记法结合生物质谱技术定量阿胶的可行性。基于前期研究结果(在目标明胶含量低于10%时,于阿胶、牛皮明胶和猪皮明胶混合物中,分别鉴定了5、11 个和15 个阿胶、牛皮明胶和猪皮明胶的特征性多肽),选取5 个特征性多肽用于阿胶的定量研究,其氨基酸序列和相对分子质量如表1所示。

图1 对比16O和18O标记后阿胶特征性多肽的一级质谱图Fig. 1 Comparison of mass spectra of donkey-hide gelatin peptides after 16O and 18O labeling
图1A为阿胶α1链的特征性多肽1066GEAGPAGPA GPIGPVGAR1083的16O标记多肽一级质谱图,实测m/z 765.905 52+与理论m/z 765.904 82+十分匹配,此外,MS/MS(图谱未展示)证明了此特征性多肽的氨基酸序列。经过18O标记后,即图1B,这个多肽的m/z转变成了767.909 52+,增加的4.008 0 Da与理论质量增加量4.008 5 Da非常接近,MS/MS(图谱未展示)亦证明了氨基酸序列的正确性和多肽C端氨基酸残基Arg1083已被两个18O原子标记。类似地,图1C中,m/z 802.921 52+的一级质谱峰来源于阿胶α2链977GE*PGPVGSVGPVGAVGPR994。对应地,图1D中,经过18O标记后,802.921 52+的质谱峰消失,伴随着一个新的质谱峰804.928 22+出现,两个质谱峰的质量差4.013 4 Da与理论上18O标记后的理论质量差4.008 5 Da匹配度良好。另外,利用MS和MS/MS检测其余3 个特征性多肽经16O和18O标记的质谱图,确定了它们的C端精氨酸残基都能被两个18O原子标记。上述结果说明胰蛋白酶催化的18O标记法能用于标记阿胶的特征性多肽。
2.2 纯阿胶中18O/16O比值的测定结果
为了进一步确定18O标记法是否能用于阿胶定量,以5 个不同质量比(20∶1、10∶1、5∶1、1∶1和1∶5)混合18O和16O标记的阿胶酶解物进行液相色谱-质谱检测,通过特征性多肽的18O/16O实测比值与混合比例的偏差检测定量方法的准确度。
图2为阿胶16O标记多肽(m/z为733.348 22+)和18O标记多肽(m/z为735.352 72+)以不同比例混合后经液相色谱-质谱检测到的一级质谱图,这两个质谱峰的信噪比(RSN)都很高,而且,两个峰代表的18O/16O比值在外观上十分接近实际混合比例(20∶1、10∶1、5∶1、1∶1和1∶5)。此外,基于18O和16O标记的5 个特征性多肽的质谱峰峰高,计算18O/16O平均值,并与实际混合比例进行比较。如表1所示,当18O和16O标记物以20∶1、5∶1、1∶1和1∶5混合,5 个特征性多肽的实测平均比例分别为19.66±0.62、10.24±0.41、5.01±0.32、1.00±0.05和0.20±0.01。18O/16O实测值与实际混合比值十分接近,偏差很小,说明基于18O标记和生物质谱技术建立的阿胶定量方法具有高准确性。

表1 阿胶的特征性多肽的18O/16O相对比例定量Table1 Quanti fi cation of relative 18O/16O ratios of the marker peptides for donkey-hide gelatin
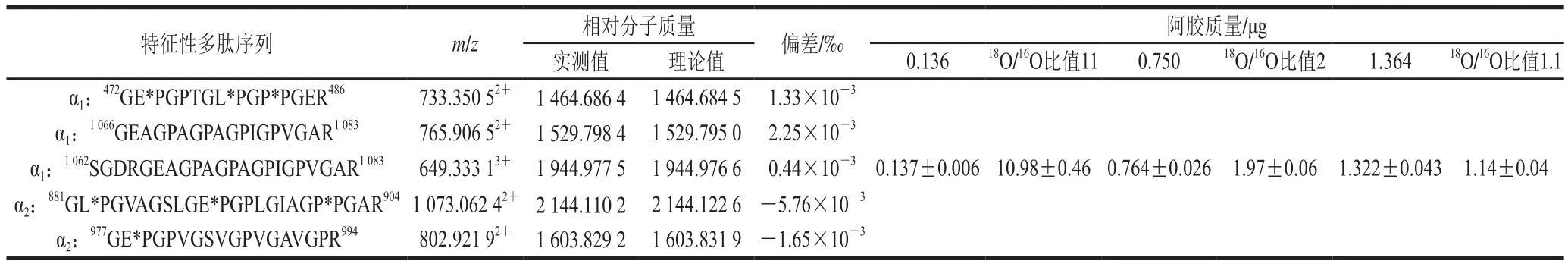
表2 明胶混合物中阿胶的定量Table2 Quanti fi cation of donkey-hide gelatin from its mixtures with bovine-hide gelatin

表3 明胶混合物中牛皮明胶的定量Table3 Quanti fi cation of bovine-hide gelatin from its mixtures with donkey-hide gelatin

图2 阿胶的特征性多肽472GE*PGPTGL*PGP*PGER486的18O和16O标记物以不同比例混合后检测到的一级质谱图Fig.2 Mass spectra of peptide 472GE*PGPTGL*PGP*PGER486 from donkey-hide gelatin with various 18O/16O ratios
2.3 明胶混合物中阿胶的定量
在阿胶掺假中,常将阿胶与其他种类的明胶混合,因此,分别以质量比1∶10、1∶1和10∶1混合阿胶和牛皮明胶,利用18O标记和生物质谱技术定量混合物中的阿胶。在上样时,混合纯阿胶酶解物的18O标记物1.5 μg和混合明胶酶解物的16O标记物1.5 μg,即混合明胶中16O阿胶质量分别为0.136、0.750 μg和1.364 μg。换言之,测定1∶10、1∶1和10∶1的阿胶-牛皮明胶混合物时,阿胶酶解物的18O/16O比值分别为11、2和1.1。
图3为明胶混合物中阿胶特征性多肽472GE*PGPTGL*PGP*PGER486的18O和16O标记物的一级质谱图。即使有牛皮明胶的干扰,16O标记多肽(m/z为733.34962+)和18O标记多肽(m/z为735.353 92+)的质谱峰都具有很高的RSN,而且两个峰代表的18O/16O比值在外观上十分接近实际的18O/16O比值,即11、2和1.1。

图3 在阿胶和牛皮明胶混合物中检测到的阿胶特征性多肽472GE*PGPTGL*PGP*PGER486的18O和16O标记物的一级质谱图Fig.3 Mass spectra of peptide 472GE*PGPTGL*PGP*PGER486 for donkey-hide gelatin from its mixtures with bovine-hide gelatin
表2列出了利用5个特征性多肽对明胶混合物中阿胶进行定量的检测结果。当阿胶与牛皮明胶以质量比1∶10、1∶1和10∶1混合时,上样的溶液中含有的阿胶质量分别为0.136、0.750 μg和1.364 μg,阿胶中18O/16O比值分别为11、2和1.1。基于阿胶的5个特征性多肽的结果平均值,当阿胶与牛皮明胶以质量比1∶10、1∶1和10∶1混合时,检测到的阿胶质量分别为(0.137±0.006)、(0.764±0.026)μg和(1.322±0.043)μg,检测到的18O/16O比值分别为10.98±0.46、1.97±0.06和1.14±0.04,测定结果与实际阿胶质量、18O/16O比值十分接近,偏差很小,说明联合18O标记和生物质谱技术可用于明胶混合物中阿胶的定量。
2.4 明胶混合物中牛皮明胶的定量
阿胶和牛皮明胶以质量比10∶1、1∶1和1∶10混合制备明胶混合样品,利用18O标记和生物质谱技术定量混合物中的牛皮明胶时,上样溶液包含1.5 μg纯牛皮明胶酶解物的18O标记物和1.5 μg混合明胶酶解物的16O标记物,即混合明胶中16O牛皮明胶质量分别为0.136、0.750 μg和1.364 μg。换言之,测定质量比为10∶1、1∶1和1∶10的阿胶与牛皮明胶混合物时,牛皮明胶酶解物的18O/16O比值分别为11、2和1.1。
图4为明胶混合物中牛皮明胶特征性多肽977GE*PGPAGAVGPAGAVGPR994的18O和16O标记物的一级质谱图。即使有阿胶的干扰,16O标记多肽(m/z为766.894 22+)和18O标记多肽(m/z为768.898 52+)的质谱峰都具有很高的RSN,而且两个峰代表的18O/16O比值在外观上十分接近实际的18O/16O比值,即11、2和1.1。
表3列出了利用10 个特征性多肽定量明胶混合物中牛皮明胶的检测结果。当阿胶与牛皮明胶以质量比10∶1、1∶1和1∶10混合时,上样溶液中含有的牛明胶质量分别为0.136、0.750 μg和1.364 μg,牛皮明胶中18O/16O比值分别为11、2和1.1。基于牛皮明胶的10 个特征性多肽的结果平均值,当阿胶与牛皮明胶以质量比10∶1、1∶1和1∶10混合时,检测到的牛皮明胶质量分别为(0.137±0.007)、(0.752±0.018)μg和(1.351±0.040)μg,检测到的18O/16O比值分别为10.71±0.44、2.02±0.02和1.12±0.04,测定结果与实际牛皮明胶质量和18O/16O比值十分接近,偏差很小,说明18O标记和生物质谱技术可用于明胶混合物中牛皮明胶的定量。同理,若阿胶中掺入其他种类的明胶,如猪皮明胶,亦可运用此方法进行定量。


图4 在阿胶和牛皮明胶混合物中检测到的牛皮明胶特征性多肽977GE*PGPAGAVGPAGAVGPR994的18O和16O标记物的一级质谱图Fig.4 Mass spectra of peptide 977GE*PGPAGAVGPAGAVGPR994 for bovine-hide gelatin from its mixtures with donkey-hide gelatin
3 结 论
本研究运用胰蛋白酶催化的18O标记法和生物质谱技术对明胶混合物中的阿胶和牛皮明胶进行定量分析,为阿胶品质监控提供技术支撑。经胰蛋白酶催化,阿胶的特征性多肽均能被H218O的2 个18O原子标记,引起质量增加4 Da。当18O和16O标记物以20∶1、10∶1、5∶1、1∶1和1∶5混合时,选取的5 个阿胶特征性多肽实测平均比例分别为19.66±0.62、10.24±0.41、5.01±0.32、1.00±0.05和0.20±0.01,表明定量方法的准确度高。当阿胶与牛皮明胶以质量比1∶10、1∶1和10∶1混合时,采用18O标记法和生物质谱技术,检测到阿胶质量分别为(0.137±0.006)、(0.764±0.026)μg和(1.322±0.043)μg,检测到的牛皮明胶质量分别为(1.351±0.040)、(0.752±0.018)μg和(0.137±0.007)μg,检测结果与实际值十分接近。由此可见,联合胰蛋白酶催化的18O标记法和生物质谱技术可用于阿胶产品的品质监测。
本研究对阿胶和牛皮明胶混合物中的目标明胶进行了定量检测,并未考虑食品基质(如黄酒、豆油、冰糖等)对明胶定量效果的影响,后续将以阿胶模拟产品和市售阿胶产品为对象开展进一步的研究,以保证18O标记法和生物质谱技术检测阿胶中各类明胶添加量的准确性。
[1] 吴海燕, 孙佳明, 张辉. 阿胶的研究进展[J]. 吉林中医药, 2016, 36(1)∶57-60. DOI∶10.13463/j.cnki.jlzyy.2016.01.016.
[2] LIU M, TAN H, ZHANG X, et al. Hematopoietic effects and mechanisms of Fufang e'jiao jiang on radiotherapy and chemotherapy-induced myelosuppressed mice[J]. Journal of Ethnopharmacology,2014, 152(3)∶ 575-584. DOI∶10.1016/j.jep.2014.02.012.
[3] 张珣, 王静凤, 李冰, 等. 阿胶对小鼠免疫功能的影响[J]. 食品工业科技, 2011, 32(11)∶ 400-402. DOI∶10.13386/j.issn1002-0306.2011.11.024.
[4] 李辉, 王静凤, 赵芹, 等. 阿胶的活性成分及其对运动小鼠的抗疲劳作用研究[J]. 食品工业科技, 2011, 32(8)∶ 374-376. DOI∶10.13386/j.issn1002-0306.2011.08.019.
[5] 郭健, 孙佳明, 张志颉, 等. 阿胶化学成分及药理作用研究进展[J]. 吉林中医药, 2013, 33(4)∶ 389-391. DOI∶10.13463/j.cnki.jlzyy.2013.04.039.
[6] KARIM A A, BHAT R. Fish gelatin∶ properties, challenges,and prospects as an alternative to mammalian gelatins[J].Food Hydrocolloids, 2009, 23(3)∶ 563-576. DOI∶10.1016/j.foodhyd.2008.07.002.
[7] CAI L, FENG J, REGENSTEIN J, et al. Confectionery gels∶effects of low calorie sweeteners on the rheological properties and microstructure of fi sh gelatin[J]. Food Hydrocolloids, 2017, 67∶ 157-165. DOI∶10.1016/j.foodhyd.2016.12.031.
[8] NEMATI M, OVEISI M R, ABDOLLAHI H, et al. Differentiation of bovine and porcine gelatins using principal component analysis[J].Journal of Pharmaceutical and Biomedical Analysis, 2004, 34(3)∶ 485-492. DOI∶10.1016/S0731-7085(03)00574-0.
[9] HIDAKA S, LIU S Y. Effects of gelatins on calcium phosphate precipitation∶ a possible application for distinguishing bovine bone gelatin from porcine skin gelatin[J]. Journal of Food Composition &Analysis, 2003, 16(4)∶ 477-483. DOI∶10.1016/S0889-1575(02)00174-6.
[10] HASHIM D M, MAN Y B C, NORAKASHA R, et al. Potential use of Fourier transform infrared spectroscopy for differentiation of bovine and porcine gelatins[J]. Food Chemistry, 2010, 118(3)∶ 856-860.DOI∶10.1016/j.foodchem.2009.05.049.
[11] CEBI N, DURAK M Z, TOKER O S, et al. An evaluation of Fourier transforms infrared spectroscopy method for the classification and discrimination of bovine, porcine and fi sh gelatins[J]. Food Chemistry,2016, 190∶ 1109-1115. DOI∶10.1016/j.foodchem.2015.06.065.
[12] NUR A T, CHE M Y, RN R M H, et al. Use of principal component analysis for differentiation of gelatine sources based on polypeptide molecular weights[J]. Food Chemistry, 2014, 151(20)∶ 286-292.DOI∶10.1016/j.foodchem.2013.11.066.
[13] VENIEN A, LEVIEUX D. Differentiation of bovine from porcine gelatines using polyclonal anti-peptide antibodies in indirect and competitive indirect ELISA[J]. Journal of Pharmaceutical &Biomedical Analysis, 2005, 39(3/4)∶ 418-424. DOI∶10.1016/j.jpba.2005.04.013.
[14] SHABANI H, MEHDIZADEH M, MOUSAVI S M, et al. Halal authenticity of gelatin using species-specif i c PCR[J]. Food Chemistry,2015, 184∶ 203-206. DOI∶10.1016/j.foodchem.2015.02.140.
[15] MUTALIB S A, MUIN N M, ABDULLAH A, et al. Sensitivity of polymerase chain reaction (PCR)-southern hybridization and conventional PCR analysis for Halal authentication of gelatin capsules[J]. LWT-Food Science and Technology, 2015, 63(1)∶ 714-719. DOI∶10.1016/j.lwt.2015.03.006.
[16] 吴亚君, 王斌, 刘鸣畅, 等. 阿胶中马和驴成分的实时荧光PCR检测[J]. 食品科学, 2014, 35(8)∶ 85-88. DOI∶10.7506/spkx1002-6630-201408016.
[17] ZHANG G, LIU T, WANG Q, et al. Mass spectrometric detection of marker peptides in tryptic digests of gelatin∶ a new method to differentiate between bovine and porcine gelatin[J].Food Hydrocolloids, 2009, 23(7)∶ 2001-2007. DOI∶10.1016/j.foodhyd.2009.03.010.
[18] YILMAZ M T, KESMEN Z, BAYKAL B, et al. A novel method to differentiate bovine and porcine gelatins in food products∶ nanoUPLCESI-Q-TOF-MS(E) based data independent acquisition technique to detect marker peptides in gelatin[J]. Food Chemistry, 2013, 141(3)∶2450-2458. DOI∶10.1016/j.foodchem.2013.05.096.
[19] FLAUDROPS C, ARMSTRONG N, RAOULT D, et al. Determination of the animal origin of meat and gelatin by MALDI-TOF-MS[J].Journal of Food Composition & Analysis, 2015, 41∶ 104-112.DOI∶10.1016/j.jfca.2015.02.009.
[20] GRUNDY H H, REECE P, BUCKLEY M, et al. A mass spectrometry method for the determination of the species of origin of gelatine in foods and pharmaceutical products[J]. Food Chemistry, 2016, 190∶276-284. DOI∶10.1016/j.foodchem.2015.05.054.
[21] CHENG X L, WEI F, XIAO X Y, et al. Identif i cation of fi ve gelatins by ultra performance liquid chromatography/time-of-flight mass spectrometry (UPLC/Q-TOF-MS) using principal component analysis[J]. Journal of Pharmaceutical and Biomedical Analysis, 2012,62(2)∶ 191-195. DOI∶10.1016/j.jpba.2011.12.024.
[22] QIAN W J, PETRITIS B O, NICORA C D, et al. Trypsin-catalyzed oxygen-18 labeling for quantitative proteomics, in gel-free proteomics[M].Springer, 2011∶ 43-54. DOI∶10.1007/978-1-61779-148-2_3.
[23] LIU N, ZHAO L, HE C, et al. Advances in technologies and biological applications of18O labeling strategies in LC-MS based proteomics∶ an updated review[J]. Current Analytical Chemistry, 2012, 8(1)∶ 22-34.DOI∶10.2174/157341112798472233.
[24] CASTILLO M J, REYNOLDS K J, GOMES A, et al. Quantitative protein analysis using enzymatic [(18) O] water labeling[J].Current Protocols in Protein Science, 2014, 76∶ 23.4.1-9.DOI∶10.1002/0471140864.ps2304s76.
[25] SHA X M, TU Z C, WANG H, et al. Gelatin quantification by oxygen-18 labeling and liquid chromatography-high-resolution mass spectrometry[J]. Journal of Agricultural & Food Chemistry, 2014,62(49)∶ 11840-11853. DOI∶10.1021/jf503876a.
[26] STAES A, DEMOL H, DAMME J V, et al. Global differential non-gel proteomics by quantitative and stable labeling of tryptic peptides with oxygen-18[J]. Journal of Proteome Research, 2004, 3(4)∶ 786-791.DOI∶10.1021/pr049956p.
[27] ZHANG Q, TU Z, WANG H, et al. Improved glycation after ultrasonic pretreatment revealed by high-performance liquid chromatographylinear ion Trap/Orbitrap high-resolution mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2014, 62(12)∶ 2522-2530.DOI∶10.1021/jf5002765.
[28] JOHNSON K L, MUDDIMAN D C. A method for calculating16O/18O peptide ion ratios for the relative quantification of proteomes[J].Journal of the American Society for Mass Spectrometry, 2004, 15(4)∶437-445. DOI∶10.1016/j.jasms.2003.11.016.
[29] FENSELAU C, YAO X. Proteolytic labeling with18O for comparative proteomics studies[M]//Quantitative proteomics by mass spectrometry.New York∶ Humana Press, 2007∶ 135-142. DOI∶10.1007/978-1-59745-255-79.
[30] CASTILLO M J, REYNOLDS K J, GOMES A, et al. Quantitative protein analysis using enzymatic [18O] water labeling[J]. Current Protocols in Protein Science, 2014, 76∶ 1-9. DOI∶10.1002/0471140864.ps2304s76.

