国内首例凝胶基质自体软骨细胞移植治疗膝关节软骨损伤及文献回顾
丁 一,郑静晨,张仲文
软骨修复技术是当今骨科和运动医学的研究热点。自体软骨细胞移植(autologous chondrocyte implantation ,ACI)[1,2]等组织工程技术的疗效较为确切[3],因而备受瞩目。纤维蛋白凝胶型自体软骨细胞移植(fibrin matrix-mixed gel-type ACI, G-ACI)是一种新型第三代ACI技术,凝胶基质可支持软骨细胞的扩增、迁移,构成支架成分,其形成透明样软骨的成功率高于传统ACI技术[4]。G-ACI手术操作便捷,不受缺损部位、形状、深度所限[5]。目前,G-ACI在欧洲、韩国等地已进入临床应用阶段,短期随访疗效好[5-7]。本团队首次在国内开展了G-ACI手术,现将手术技术和短期随访结果报告与讨论如下。
1 资料与方法
1.1 病例选择 根据国际软骨修复协会( ICRS) 指南,我科选取1例女性48岁右膝骨软骨损伤患者作为国内首例在2016-04-18接受G-ACI手术的患者。该患者右膝髌股关节对吻伤,髌骨软骨大面积缺损, 股骨内髁小部分缺损,均为Outerbridge/ICRS Ⅲ-Ⅳ度。患者签署了知情同意书,临床研究按照赫尔辛基宣言和中国伦理进行。
1.2 手术方法
1.2.1 术前准备 膝关节正侧位X线片,测量下肢力线和Q角;术前进行MRI检查和KOOS评分。
1.2.2 关节镜下活检 在硬膜外麻醉下施行患膝关节镜检查,术中探查半月板,如有病变,则对其进行相应治疗。采集患膝非负重区健康关节软骨约 50 mg,放入培养液,送实验室(武警总医院细胞实验室,GMP标准)分离培养。软骨细胞培养的标准:细胞数量达到1.2×107/vial,超过活性80%[5]。软骨组织收集工作需要在二次手术前6周完成。
1.2.3 G-ACI手术 手术在硬膜外麻醉下进行,采用髌旁内侧入路显露膝关节,外翻髌骨后可见髌骨和股骨内髁的缺损区域。刮匙刮除剥脱及病变的软骨至正常组织,深度达软骨下骨,修整软骨缺损创面为近似圆形或椭圆形。为了确保手术效果,用2.5 mm钻头在缺损区域制作数个深度5 mm的骨道,将2 ml细胞混悬液(细胞活性85%),与纤维蛋白、凝血酶通过双联注射器注射到缺损部位,5 min后,凝胶硬化[5],逐层关闭伤口,佩戴支具锁至0 °,手术时间45 min。
1.2.4 术后康复 术后2周内不能下垂小腿,2周后进行CPM训练,起始角度60°,至8周增至120°,术后6~8周扶拐下地,术后8~10周脱拐[6]。
1.2.5 随访 在术后3、6、12个月进行KOOS 评分,在术后1、3、6、12个月时进行MRI 检查。所有 MRI 检查均在武警总医院核磁共振科完成,采用3.0T MRI进行T1Vibe和T2Mapping扫描。
1.3 评估方法 采用Trattnig标准评估MRI软骨组织修复情况,包括:(1)缺损部位的填充程度;(2)与周边软骨的整合;(3)修复组织的信号强度;(4)软骨下骨和骨髓的情况。
2 结 果
2.1 一般情况 术前X线片示下肢力线正常,无明显内外翻。术前MRI示髌骨软骨损伤软骨变薄,内髁软骨损伤,未发现除软骨损伤之外的疾病。据术中测量,患者右膝髌骨软骨缺损面积1.8 cm×3.0 cm, 股骨内髁缺损面积0.5 cm×0.5 cm,Outerbridge/ICRS Ⅲ-Ⅳ度损伤(图1)。

图1 关节镜下与二次手术照片
A,D.活检术中关节镜下所见,分别示髌骨大范围软骨缺损,横向、深达软骨下骨,股骨内髁小范围软骨缺损,深达软骨下骨;B,E.二次手术清创后测量髌骨、内髁区域缺损面积;C,F.凝胶注射后,用刮匙探及硬度
2.2 MRI检查
2.2.1 T2Mapping 患者术后6、12个月和1.5年的T2Mapping MRI显示,缺损区域的mapping值逐渐降低(图2),由术前的71降至40。
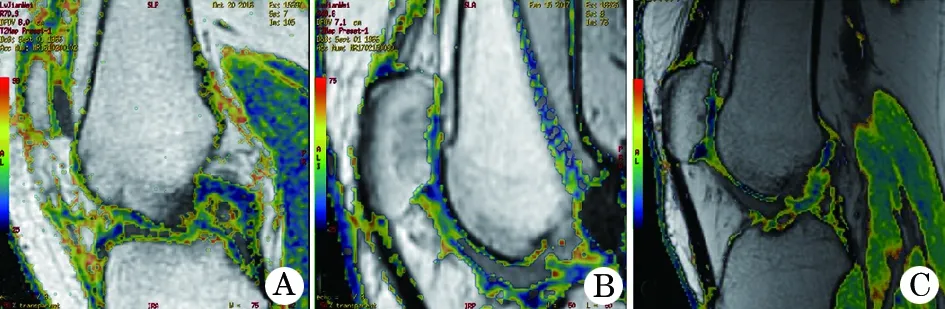
图2 G-ACI术后T2 Mapping MRI 变化
T2Mapping中,成熟的透明软骨显示为偏蓝色,新生软骨信号为绿色,黄色和红色代表变性或损伤;A.患者在G-ACI术前的软骨T2Mapping信号异常;B.G-ACI术后12个月的Mapping值显著下降,为不成熟软骨信号;C.术后1.5年的软骨信号区趋于正常
2.2.2 T1Vibe MRI示患者术后6个月的T1Vibe MRI显示髌骨和内髁区域的移植物附着牢固,可见类似新生软骨的移植物信号,骨髓水肿依然存在;术后12个月,移植区域的软骨层逐渐增厚,软骨信号稍显不均,骨髓水肿减轻;至术后1.5年,髌骨和股骨内髁的缺损已被移植的软骨细胞填平,软骨厚度基本恢复正常水平,骨髓水肿信号消失(图3)。
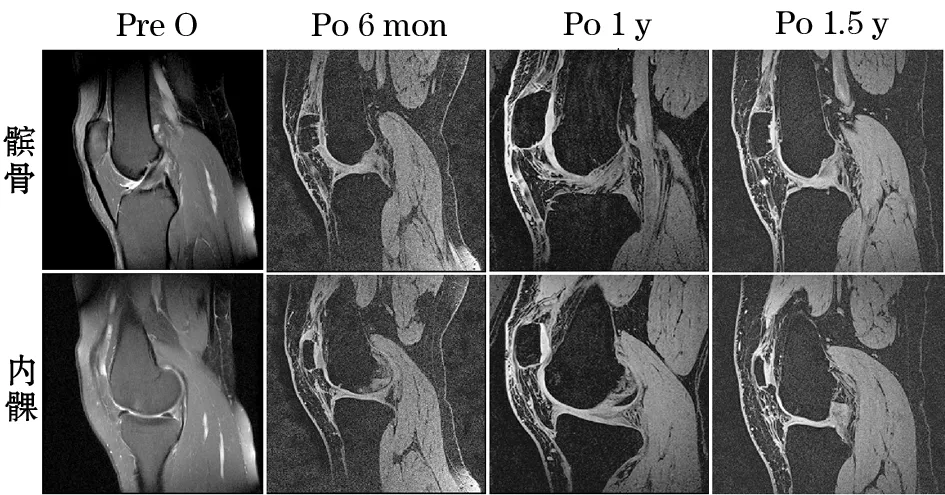
图3 术前与术后软骨缺损处的MRI
Pre O为术前,Po 6 mon为G-ACI术后6个月,Po 1为G-ACI术后12个月,Po 1.5为G-ACI术后1.5年
2.3 KOOS评分 患者术前的KOOS评分是51.4(表1),而术后6、12个月,1.5年时的KOOS评分各项均呈逐渐增高的趋势,患者的主观感受改善最快发生在术后6~12个月,此期间各项指标增幅最大,至术后1.5年KOOS评分已达到79.6分(表1)。在KOOS评分的各项中,改善程度最大的是症状方面,程度最小的是日常活动方面。
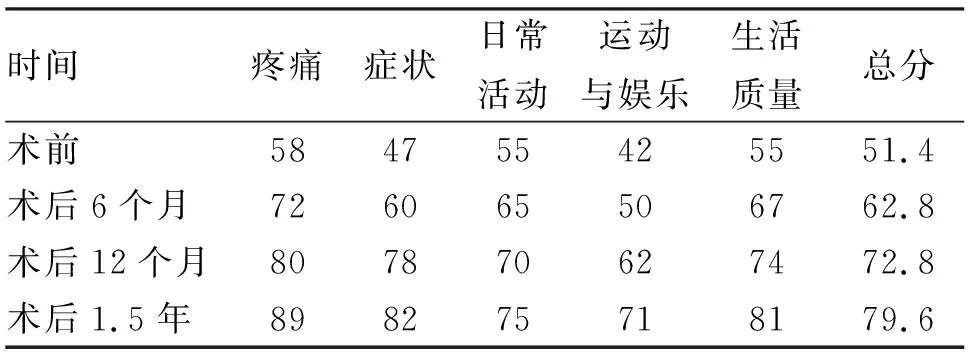
表1 术前与术后不同时期的KOOS评分对比
3 讨 论
G-ACI属于新研制的第三代ACI技术,以纤维蛋白和凝血酶反应形成的凝胶聚合物为基质,在软骨损伤部位以注射填充的方式进行自体软骨细胞移植。纤维蛋白凝胶的生物相容性和生物降解性很好,无毒副作用,近些年来逐渐成为各种软骨再生技术中的热门载体[9]。与MACI等常规第三代ACI技术相比,省去了修剪膜片、贴合等复杂步骤,增强了移植物的附着,因此手术暴露更小,可微创操作。纤维蛋白原和凝血酶的比例决定了凝胶的凝固时间[10],本例凝胶凝固时间为5 min。G-ACI技术中的纤维蛋白凝胶亦构成了负载移植细胞的3D支架,可支持软骨细胞的扩增、迁移[6,11]。体外培养发现软骨细胞在纤维蛋白凝胶中培养72 h的细胞活力在90%以上,且依然保持软骨细胞的表型,其在凝胶支架中均匀分布[6]。通常认为,移植后的软骨细胞合成细胞外基质的能力与细胞数量有关,更高的细胞数将获得更优质的软骨,G-ACI技术可移植1.2×107的细胞,因此理论上讲G-ACI比MACI具有更好的疗效。动物实验中,G-ACI形成透明样软骨的成功率高于传统ACI技术[4],因此G-ACI具有良好的应用前景。近年来,G-ACI技术在欧洲、韩国等地已逐步在临床中应用于膝、踝关节全层软骨损伤的治疗中,短期随访取得了理想的疗效[5-7]。韩国一项临床研究对30位股骨内髁软骨深层缺损的病例进行G-ACI手术,平均年龄35岁(15~55岁),软骨损伤的面积平均为5.8 cm2,术后12个月关节镜复查见软骨修复理想,大多恢复至Outerbridge/ICRS Ⅱ级,术后2年的MRI显示缺损区被新生软骨填充[11]。据荷兰科学家报道,对膝关节软骨平均缺损面积为9 cm2,平均年龄35岁患者的19例患者进行G-ACI手术后的两年随访结果显示患者的主观改善效果良好[7]。本次选择的病例符合既往报道G-ACI适用的范围,因此推测术后随访和临床疗效可预期取得满意的结果。
3.0 MRI可清晰的显示移植的软骨细胞的再生和修复情况[8]。国际软骨修复学会影像组认为,MRI可获得质量较好的软骨影像,FS 3D vibe T1W 是一种用来观察软骨的特殊序列,通过增加关节软骨和软骨下骨的对比,使软骨显示更清晰,有利于观察和精确评价关节软骨微小病变,对软骨损伤具有较高诊断价值[12]。本研究中采用FS 3D vibe T1W序列来评价软骨修复情况,术后T1Vibe MRI演变清晰的显示了软骨再生和修复的动态过程。通常在ACI术后的早期,新生的软骨细胞不能完全填充缺损区[12],我们在术后6个月仅能在缺损区观察到不均匀的新生软骨信号。至术后12个月,移植的软骨细胞已基本填满缺损区,软骨厚度几乎恢复到正常水平,提示新生软骨的形成,同时骨髓水肿减轻,这与本团队之前的研究结果相一致[12,13],新生的软骨信号不均,在适宜的体内环境中,这些软骨组织将进一步成熟并改建,最终形成成熟的透明样软骨。术后1.5年,软骨厚度已经达到正常水平,信号趋于均匀,骨髓水肿消失,提示相对成熟的软骨再生。
T2Mapping 即软骨弛豫时间图[14],通过测量软骨T弛豫时间(T2Mapping 值),量化各种生理和病理情况下的软骨信号改变,间接反映软骨基质含水量、胶原纤维方向和含量、蛋白聚糖含量的改变。目前,T2Mapping已广泛用于ACI术后,评价新生软骨的生化性质和软骨成分与结构的修复情况[14],T2Mapping中,成熟的透明软骨含水量少,Mapping值低,显示为蓝色,损伤或变性时,Ⅱ型胶原发生退变,纤维的形态和排列方式改变,对水的通透性增加,同时胶原网架的断裂使蛋白多糖分散展开,暴露出更多的阴离子, 进一步增加了含水量,导致Mapping值增高,表现为黄色或橙红色。2例在术后,T2Mapping 值均较之前显著降低,蓝色部分增多、橙红色部分减少,提示G-ACI术后软骨组织的修复和改建。由于不同年龄、不同负重部位的Mapping值不同,内髁负重区的值要低于髌骨软骨,青年人关节软骨的Mapping值低于中老年人。因此,本例中采用自身前后对照的方法来评价T2Mapping值的变化。患者术前的T2Mapping显示其软骨损伤较严重,但在术后12个月时其Mapping比之前降低了近30%,同时患者主观KOOS评分也较术前明显提高,提示这一阶段已经开始了软骨再生和修复过程。术后1.5年时的Mapping值进一步下降,但仍不属于正常值范围,分析其原因可能有以下两点:(1)患者为中老年,软骨细胞活力略低于青年个体,因此软骨修复比较慢;(2)女性患者在ACI术后的主观评分和MRI表现要明显低于男性,尤其是有髌骨软骨损伤的女性患者,其具有更低的主观评分和MRI表现[15]。
KOOS 评分是一项主观评分。在患者术后的1.5年之内,其KOOS 评分的各项总体呈升高趋势,患者较为明显的主观改善发生在术后6~12个月期间,此时各项指标分值的增幅最快,其中改善程度最大的是症状方面,且患者自述疼痛症状好转明显,改善程度最小的是日常活动方面,可能是患者主诉的伸膝无力限制活动水平。术后1.5年时所有指标进一步改善,但日常活动方面的改善依然比其他分项低,这可能与文献报道的女性患者ACI术后主观评分较低有关[15]。在荷兰G-ACI术后随访两年的研究中也发现了日常活动方面改善也不明显的现象[7]。分析其原因可能与软骨损伤后的恐惧性心理有关,患者由于害怕再次受伤而不愿主动运动,这提示术后针对患者的心理特点进行心理辅导将可能会促进康复进程。
综上所述,G-ACI是一种新型第三代ACI技术,其操作简便快捷,不受缺损部位、形状、深度所限。利用G-ACI技术治疗膝关节软骨缺损的短期疗效理想,安全性佳,术后MRI可见软骨再生和修复,同时患者的主观评分显著提高。因此,利用G-ACI技术治疗软骨损伤具有在国内临床应用的优势和前景。
【参考文献】
[1] Bozkurt M, Isik C, Gursoy S,etal. Bilayer Matrix Autologous Chondrocyte Implantation without Bone Graft for Knee Osteochondral Lesion less than 8 mm Deep[J]. J Knee Surg, 2017,12: 28.
[2] Ebert J R, Schneider A, Fallon M,etal. A Comparison of 2-Year Outcomes in Patients Undergoing Tibiofemoral or Patellofemoral Matrix-Induced Autologous Chondrocyte Implantation[J]. Am J Sports Med, 2017, 45(14): 3243-3253.
[3] Adachi N,Ochi M,Deie M,etal. Implantation of tissue-engineered cartilage-like tissue for the treatment for full-thickness cartilage defects of the knee[J]. Knee Surg Sports Tr,2014, 22(6): 1241-1248.
[4] Munirah S, Samsudin OC, Chen HC,etal. Articular cartilage restoration in loadbearing osteochondral defects by implantation of autologous chondrocyte-fibrin constructs: an experimental study in sheep[J]. J Bone Jt Surg Br, 2007, 89(8): 1099-1109.
[5] Lee K T,Kim J S,Young K W,etal. The use of fibrin matrix-mixed gel-type autologous chondrocyte implantation in the treatment for osteochondral lesions of the talus[J]. Knee Surg Sports Tr,2013, 21(6): 1251-1260.
[6] Choi N Y,Kim B W,Yeo W J,etal. Gel-type autologous chondrocyte (ChondronTM) implantation for treatment of articular cartilage defects of the knee[J]. BMC Musculoskelet Disord,2010,28;11:103.
[7] Van Duijvenbode DC,Jonkers FJ,Könst YE,etal. Gel-type autologous chondrocyte implantation for cartilage repair in patients with prior ACL reconstruction: a retrospective two year follow-up[J]. Knee,2016, 23(2): 241-245.
[8] 张加廷,郭 静,张仲文,等.光学相干断层扫描3.0TMRI、超声法测量兔膝关节软骨厚度的比较[J]. 武警医学, 2016, 27(05): 472-475.
[9] Huh S W,Shetty A A,Ahmed S,etal. Autologous bone-marrow mesenchymal cell induced chondrogenesis(MCIC)[J]. J Clin Orthop Trauma,2016, 7(3): 153-156.
[10] Jang J D, Moon Y S, Kim Y S,etal. Novel repair technique for articular cartilage defect using a fibrin and hyaluronic acid mixture[J]. Tissue Eng Regen Med, 2013, 10:1.
[11] Kim M K,Choi S W,Kim S R,etal. Autologous chondrocyte implantation in the knee using fibrin[J]. Knee Surg Sports Traumatol Arthrosc,2010, 18(4): 528-534.
[12] Zhong X, Zhang Z W, Wang H,etal. Two-year MRI folowing up after matrix-induced autologous chondrocyte implantation of the knee[J]. Chin J Med Imaging Technol, 2012, 28(6): 1199-1203.
[13] Zhang Z,Zhong X,Ji H,etal. Matrix-induced autologous chondrocyte implantation for the treatment of chondral defects of the knees in Chinese patients[J]. Drug Des Devel Ther,2014, 8: 2439-2348.
[14] Domayer S E,Welsch G H,Nehrer S,etal. T2 mapping and dGEMRIC after autologous chondrocyte implantation with a fibrin-based scaffold in the knee: preliminary results[J]. Eur J Radiol,2010, 73(3): 636-642.
[15] Kreuz P C,Müller S,von Keudell A,etal. Influence of sex on the outcome of autologous chondrocyte implantation in chondral defects of the knee[J]. Am J Sports Med,2013, 41(7): 1541-1548.

