外周血miRNAs检测在骨肉瘤诊疗中的意义最新进展
刘书中,周 熹,刘 勇,王以朋
(中国医学科学院 北京协和医学院 北京协和医院 骨科,北京100730)
骨肉瘤(osteosarcoma,OS)是一种好发于儿童及青少年的原发性恶性骨肿瘤,其发病率约为4.4/100万,男性多于女性[1]。骨肉瘤好发于长骨干骺端,以股骨远端、胫骨近端及肱骨近端最为多见。骨肉瘤恶性程度高,具有较强的侵袭和转移特性,易发生肺转移,预后较差。随着新辅助化疗和放疗技术的广泛应用,骨肉瘤患者的5年生存率可达60-70%[2]。如何利用新理论、新技术实现骨肉瘤患者的早期诊断及合理治疗已成为临床诊疗中亟待解决的重点和难点。目前骨肉瘤的发病机制尚未完全阐明,现有研究表明骨肉瘤的发生与基因突变、信号通路异常激活、微小RNA以及长链非编码RNA(long noncoding RNA,lncRNA)的异常调节等多种因素密切相关,深入研究骨肉瘤分子生物学特征对于骨肉瘤的诊断和治疗亦具有重要意义[3,4]。
微小RNA(microRNA,miRNA)是一类在真核生物中发现的长度为18-25个核苷酸序列的内源性非编码小分子单链RNA。MiRNA可通过翻译抑制、降解靶基因mRNA、转录调控、介导ceRNA(competing endogenous RNA,ceRNA)调控网络等作用机制在机体正常细胞或肿瘤细胞的多种生物学过程中发挥重要作用,包括胚胎发生、细胞增殖、分化、粘附、侵袭、转移、凋亡的调控等,进而发挥“促癌或抑癌”的功能[3]。近年来,研究表明多种miRNAs在骨肉瘤细胞、肿瘤组织及外周血中均存在异常表达,这些miRNAs为骨肉瘤患者的早期诊断、准确诊断、微创诊断成为可能,并为骨肉瘤患者新型治疗方案的制定提供了一定的理论支持,有望成为骨肉瘤诊断及预后判断的新型生物学标记物及治疗靶点。本文就外周血miRNAs检测在骨肉瘤诊疗及预后评估领域的最新研究进展做一综述。
1 miRNA与骨肉瘤
近年来,研究发现miRNAs可参与调节多种生物学过程,并且miRNAs的差异表达与多种恶性肿瘤,如骨肉瘤、胰腺癌、肝细胞癌、肺癌、乳腺癌等的疾病发生、病情进展及患者预后相关[4,5]。多项研究表明部分miRNAs在骨肉瘤细胞系、肿瘤组织及外周血中存在差异表达,并与OS的疾病严重程度、恶性表型、化疗抵抗和预后密切相关,这些差异表达的miRNAs在OS疾病的衍进过程中发挥促癌基因或抑癌基因的生物学功能[4]。此外,研究者通过定量测定技术已检测出在骨肉瘤细胞、肿瘤组织及外周血中差异表达的miRNA谱系,一定程度上揭示了miRNA与骨肉瘤疾病发生、发展的密切联系。Hu等[6]在人骨肉瘤MG-63细胞系中共检测出268种异常表达的miRNAs,其中miR-9、miR-99、miR-195、miR-148a、miR-181a为过度表达,而miR-143、miR-145、miR-335、miR-539表达水平则呈下调趋势。Dai等[7]研究发现13种miRNAs在敲除嘌呤/嘧啶核酸内切酶1(APE1)的MG-63细胞系中表达水平发生显著改变(>2倍),其中miR-451、miR-1290、miR-765、miR-483-5p、miR-513a-5p、hsa-miR-129-5p和hsa-miR-31表达上调,而miR-29b、miR-197、let-7b、miR-324-5p、let-7i和miR-484则为下调,结果提示APE1是OS细胞中参与调节miRNA表达的关键因子。一项在22种OS细胞系中建立的miRNA研究显示高侵袭性OS细胞系中miR-199b-5p和miR-100-3p表达下调,而miR-155-5p、miR-135b-5p、miR-146a-5p水平上调,并提出miR-135b-5p和miR-146a-5p对骨肉瘤细胞的转移能力具有一定的预测价值[8]。另一项针对19种人OS细胞系建立的miRNA研究证实miR-9、miR-21、miR-31、miR-196a/b、miR-374a、miR-29、miR-130表达上调,miR-126、miR-486-5p、miR-150、miR-142-3p、miR-223、miR-144、miR-1、miR-195和miR-206水平下调[9]。
随着miRNA与骨肉瘤相关性研究的逐步深入,越来越多的学者致力于骨肉瘤患者肿瘤组织、外周血中miRNA差异表达谱系的建立,如Gougelet等[10]研究表明在OS患者肿瘤组织中5种miRNAs(miR-92a、miR-99b、miR-132、miR-193a-5p、miR-422a)表达水平下调,并可有助于骨肉瘤患者临床诊断的确立。Won等[11]利用miRNA芯片技术检测骨肉瘤瘤体组织与癌旁组织中的miRNA表达情况,研究发现瘤体组织中miR-199b-5p、miR-338-3p、miR-891a、miR-10b、miR-223、miR-150、miR-451表达水平与癌旁组织相比均上调10倍以上,并通过实时定量聚合酶链式反应(qRT-PCR)技术证实miR-199b-5p、miR-338-3p、miR-891a明显上调。OUYANG等[12]选取40例骨肉瘤患者及相同数量健康对照者血浆标本,应用qRT-PCR方法测定miRNA的表达水平,结果显示骨肉瘤患者外周血miR-21水平显著升高,并且高miR-21水平与高Enneking分期及化疗抵抗密切相关。综上所述,miRNAs表达水平的检测为OS的精准诊断、合理治疗提供了新的研究方向和理论基础,深入探讨miRNAs与骨肉瘤疾病发生、发展的相关性对于骨肉瘤的预后改善具有重要价值。
2 外周血miRNA检测在骨肉瘤诊断、治疗及预后评估中的意义
2.1 miRNA在外周血中的表达及检测方法
早期诊断对于骨肉瘤患者预后改善具有重要意义,组织病理学检查是诊断骨肉瘤的金标准,但组织活检属有创操作,可增加恶性肿瘤转移、种植扩散及出血等风险。因此,外周血miRNAs检测作为一种高准确性、高敏感性、微创性的诊断手段受到了国内外学者的广泛关注。外周血miRNAs可能来源于凋亡坏死的肿瘤细胞、血细胞、巨噬细胞等的裂解。最新研究显示外周血miRNAs也可来自组织细胞的主动分泌途径,成熟的miRNAs在细胞内被脂蛋白包被成外切酶体分泌至细胞外,进入血液循环,因此组织细胞中miRNAs与循环miRNAs必然存在一定的联系,研究结果表明多种miRNAs在组织和体液中具有相同的变化趋势[13]。此外,外周血中miRNAs在室温下过夜、反复冻存、解冻、煮沸、过酸或过碱等恶劣条件下仍可维持稳定,进一步为循环miRNAs替代组织活检而成为新型生化指标提供了理论基础[13]。
目前检测miRNA的方法中应用最为广泛的是qRT-PCR技术,其优势包括:(1)可区分miRNA前体与成熟体,只定量具有生物学活性的成熟miRNAs,可精确区分同一家族中序列高度同源的不同miRNAs,并能检测出只有一个碱基序列差别的不同miRNAs表达水平,灵敏度和特异度均较高;(2)样品消耗量少,只需要l-l0ng RNA即能检测出低丰度靶miRNA,定量线性范围宽;(3)检测技术相对更为简便,费用较低,利于在临床检测领域大规模推广[13,14]。
2.2 外周血miRNAs检测在骨肉瘤诊疗中的意义
2.2.1外周血miR-25-3p、miR-17检测在骨肉瘤中的意义
Fujiwara等[15]应用qRT-PCR技术对选取的14位骨肉瘤患者、14位年龄匹配的非骨肉瘤患者及8位健康对照者的血清标本进行检测,研究发现骨肉瘤患者血清中miR-25-3p表达水平显著高于非骨肉瘤患者(P=0.004)和健康对照者(P=0.004),血清miR-25-3p在鉴别骨肉瘤与非骨肉瘤患者中灵敏度为71.4%,特异度为92.3%(AUC=0.868,95% CI=0.743-0.993),并进一步证实血清miR-25-3p表达水平与骨肉瘤患者病情严重程度及预后密切相关。而血清miR-17-5p表达水平在鉴别骨肉瘤与非骨肉瘤患者中灵敏度为64.3%,特异度为 84.6%。在体外试验中,骨肉瘤细胞miR-25-3p、miR-17-5p的表达水平也显著升高。Li等[16]选取46名骨肉瘤患者与46名健康对照者外周血样本进行检测,研究证实骨肉瘤患者循环血中miR-17表达水平显著升高,并且与磷酸酶、张力蛋白同系物的水平呈负相关。此外,研究中骨肉瘤患者循环血中miR-17表达水平越高,整体生存期越短,故循环血miR-17水平可作为判断骨肉瘤患者预后状况的新型指标,并有望成为骨肉瘤疾病治疗的新靶点。Li等[17]将20名治疗前骨肉瘤患者与20名健康对照者纳入研究,研究结果表明miR-25-3p,miR-106a-5p,miR-16-5p,miR-20a-5p,miR-425-5p,miR-451a,miR139-5p在骨肉瘤患者血清中的表达水平较对照组显著降低,差异均具有统计学意义。
2.2.2外周血miR-497检测在骨肉瘤中的意义
Wang等[18]研究发现骨肉瘤患者外周血、肿瘤组织以及肺转移组织中miR-497表达水平均显著降低,其表达水平与突触核蛋白γ呈负相关。Pang等[19]选取185名骨肉瘤患者与130名健康对照者血清样本进行检测,研究证实骨肉瘤患者血清中miR-497水平较对照组显著降低(P<0.001),血清中miR-497水平与骨肉瘤疾病临床分期(P=0.001)、远处转移(P=0.001)、化疗抵抗(P=0.007)密切相关。血清miR-497在鉴别骨肉瘤与非骨肉瘤患者中具有较高的参考价值(AUC=0.848,95% CI=0.773-0.923),并进一步证实血清miR-497表达水平愈低,患者生存期愈短(P<0.001)。因此,血清中miR-497水平可作为骨肉瘤患者早期诊断、病情评估、预后判断的新型生化指标。
2.2.3外周血miR-124、miR-27a检测在骨肉瘤中的意义
Cong等[20]选取114例骨肉瘤患者、40例骨膜炎患者及50例健康对照者,应用qRT-PCR技术检测血清中miR-124水平,研究发现骨肉瘤组患者血清中miR-124表达水平显著低于其余两组(P<0.05),经手术治疗后患者血清中miR-124表达水平较术前明显增高(P<0.01),血清中miR-124表达水平与骨肉瘤较高的临床分期(P=0.0006)、远处转移(P=0.0256)直接相关,对骨肉瘤疾病具有良好的鉴别作用(AUC=0.846),血清miR-124表达水平愈低,患者临床分期及远处转移的发生率愈高,预计生存期愈短。因此,血清中miR-124水平可作为骨肉瘤患者早期筛查、病情评估、预后判断的独立预测指标。Xu等[21]研究证实血清中miR-124、miR-27a与骨肉瘤患者的化疗敏感性密切相关。对于化疗敏感度差的患者,血清miR-124水平显著降低,而血清miR-27a水平则明显升高,上述两种外泌体可在一定程度上预测骨肉瘤患者的化疗敏感性。Tang等[22]选取166名骨肉瘤患者与60名健康对照者血清样本进行检测,研究证实骨肉瘤患者血清中miR-27a水平较对照组显著升高(P<0.001),血清中miR-27a高表达与骨肉瘤较高的临床分期(P=0.001)、远处转移(P=0.01)、化疗抵抗(P=0.008)呈正相关,其对骨肉瘤具有良好的鉴别作用(AUC=0.867)。研究进一步证实血清miR-27a表达水平愈低,患者术后无病生存期(P=0.01)、总体生存期(P=0.006)愈短。血清中miR-27a水平有望成为骨肉瘤患者早期筛查、准确诊断、病情评估、预后判断的新型无创性生化指标。
2.2.4外周血miR-106a、miR-221检测在骨肉瘤中的意义
Li等[17]研究表明miR-106a-5p在骨肉瘤患者血清中的表达水平较对照组显著下调,差异具有统计学意义。Nakka等[23]研究表明骨肉瘤组患者血浆中miR-21、miR-221、miR-106a表达水平显著高于对照组,血浆中miR-21、miR-221、miR-106a表达水平可作为骨肉瘤患者早期筛查、准确诊断、病情评估、预后判断的新型标记物。Yang等[24]应用qRT-PCR技术检测骨肉瘤患者血清与肿瘤组织中miR-221表达情况,结果表明骨肉瘤患者血清、肿瘤组织中miR-221水平较对照组显著降低(P=0.001),血清中高表达的miR-221水平与较高的临床分期(P=0.006)、发生远处转移(P=0.01)呈正相关。因此,血清miR-221表达水平可作为骨肉瘤患者生存期的独立预测指标。
2.2.5其他外周血miRNAs检测在骨肉瘤中的意义
除上述文献报道的miRNAs以外,其他多种miRNAs在骨肉瘤患者的外周血中均有异常表达,并且其水平与骨肉瘤患者的病情严重程度、分级分期、化疗敏感性、治疗反应及疾病预后均存在密切联系。多项研究表明外周血miRNAs水平可作为骨肉瘤诊断、病情进展及预后评估的新型生化指标,并有望为骨肉瘤患者的治疗提供新的靶点(详见表1)[15,16,18-21,25-33]。
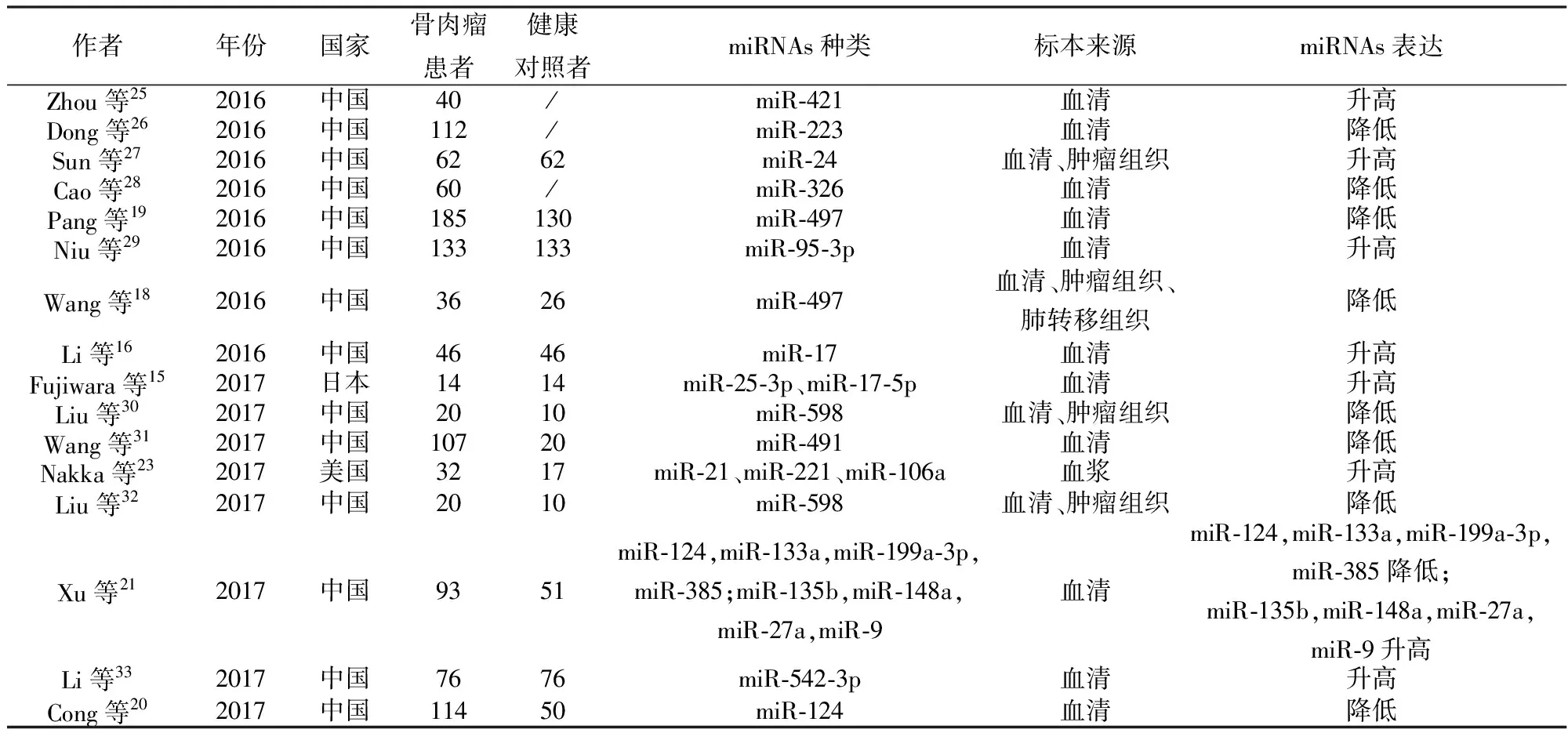
表1 2016-2017年Pubmed数据库中文献报道的外周血miRNAs检测与骨肉瘤相关性
3 结语及展望
近年来,针对外周血miRNAs的研究已成为国际上热点研究内容之一,但目前miRNAs与骨肉瘤的临床相关研究尚缺乏大样本、多中心的数据论证。由于miRNA作用的多重性,其在骨肉瘤疾病发生、发展中的特异性作用机制等尚需进行深入研究与探讨,以期早日应用于临床。随着研究的不断开展,外周血miRNAs检测将在骨肉瘤的早期诊断、鉴别诊断、预后评估及靶向治疗等诸多方面展现出更为广阔的应用前景。
参考文献:
[1]Cai H,Zhao H,Tang J,et al.Serum miR-195 is a diagnostic and prognostic marker for osteosarcoma[J].J Surg Res,2015,194(2):505.
[2]Zhou W,Hao M,Du X,et al.Advances in targeted therapy for osteosarcoma[J].Discov Med,2014,17(96):301.
[3]刘书中,劳立峰,王以朋.外周血miRNAs检测在骨肉瘤中的意义[J].中国生物制品学杂志,2016,29(5):552.
[4]Zhang J,Yan YG,Wang C,et al.MicroRNAs in osteosarcoma[J].Clin Chim Acta,2015,444:9.
[5]刘书中,李子全,李政垚,等.外周血miR-21检测在胰腺癌中的意义研究进展[J].中国实验诊断学,2016,20(6):1038.
[6]Hu H,Zhang Y,Cai XH,et al.Changes in microRNA expression in the MG-63 osteosarcoma cell line compared with osteoblasts[J].Oncol Lett,2012,4(5):1037.
[7]Dai N,Zhong ZY,Cun YP,et al.Alteration of the microRNA expression profile in human osteosarcoma cells transfected with APE1 siRNA[J].Neoplasma,2013,60(4):384.
[8]Lauvrak SU,Munthe E,Kresse SH,et al.Functional characterisation of osteosarcoma cell lines and identification of mRNAs and miRNAsassociated with aggressive cancer phenotypes[J].Br J Cancer,2013,109(8):2228.
[9]Namlos HM,Meza-Zepeda LA,Baroy T,et al.Modulation of the osteosarcoma expression phenotype by microRNAs[J].PLoS One,2012,7(10):e48086.
[10]Gougelet A,Pissaloux D,Besse A,et al.Micro-RNA profiles in osteosarcoma as a predictive tool for ifosfamide response[J].Int J Cancer,2011,129(3):680.
[11]Won KY,Kim YW,Kim HS,et al.MicroRNA-199b-5p is involved in the Notch signaling pathway in osteosarcoma[J].Hum Pathol,2013,44(8):1648.
[12]Ouyang L,Liu P,Yang S,et al.A three-plasma miRNA signature serves as novel biomarkers for osteosarcoma[J].Med Oncol,2013,30(1):340.
[13]Cappelletti V,Appierto V,Tiberio P,et al.Circulating Biomarkers for Prediction of Treatment Response[J].J Natl Cancer Inst Monogr,2015,2015(51):60.
[14]Urbanek MO,Nawrocka AU,Krzyzosiak WJ,et al.Small RNA Detection by in Situ Hybridization Methods[J].Int J Mol Sci,2015,16(6):13259.
[15]Fujiwara T,Uotani K,Yoshida A,et al.Clinical significance of circulating miR-25-3p as a novel diagnostic and prognostic biomarker in osteosarcoma[J].Oncotarget,2017,8(20):33375.
[16]Li S,Gao Y,Wang Y,et al.Serum microRNA-17 functions as a prognostic biomarker in osteosarcoma[J].Oncol Lett,2016,12(6):4905.
[17]Li H,Zhang K,Liu LH,et al.MicroRNA screening identifies circulating microRNAs as potential biomarkers for osteosarcoma[J].Oncol Lett,2015,10(3):1662.
[18]Wang L,Gao H,Gong N,et al.Downregulation of microRNA-497 is associated with upregulation of synuclein γ in patients with osteosarcoma[J].Exp Ther Med,2016,12(6):3761.
[19]Pang PC,Shi XY,Huang WL,et al.miR-497 as a potential serum biomarker for the diagnosis and prognosis of osteosarcoma[J].Eur Rev Med Pharmacol Sci,2016,20(18):3765.
[20]Cong C,Wang W,Tian J,et al.Identification of serum miR-124 as a biomarker for diagnosis and prognosis in osteosarcoma[J].Cancer Biomark,2017,[Epub ahead of print]
[21]Xu JF,Wang YP,Zhang SJ,et al.Exosomes containing differential expression of microRNA and mRNA in osteosarcoma that can predict response to chemotherapy[J].Oncotarget,2017,8(44):75968.
[22]Tang J,Zhao H,Cai H,et al.Diagnostic and prognostic potentials of microRNA-27a in osteosarcoma[J].Biomed Pharmacother,2015,71:222.
[23]Nakka M,Allen-Rhoades W,Li Y,et al.Biomarker significance of plasma and tumor miR-21,miR-221,and miR-106a in osteosarcoma[J].Oncotarget,2017,8(57):96738.
[24]Yang Z,Zhang Y,Zhang X,et al.Serum microRNA-221 functions as a potential diagnostic and prognostic marker for patients with osteosarcoma[J].Biomed Pharmacother,2015,75:103.
[25]Zhou S,Wang B,Hu J,et al.miR-421 is a diagnostic and prognostic marker in patients with osteosarcoma[J].Tumour Biol,2016,37(7):9001.
[26]Dong J,Liu Y,Liao W,et al.miRNA-223 is a potential diagnostic and prognostic marker for osteosarcoma[J].J Bone Oncol,2016,5(2):74.
[27]Sun Y,He N,Dong Y,et al.MiR-24-BIM-Smac/DIABLO axis controls the sensitivity to doxorubicin treatment in osteosarcoma[J].Sci Rep,2016,6:34238.
[28]Cao L,Wang J,Wang PQ.MiR-326 is a diagnostic biomarker and regulates cell survival and apoptosis by targeting Bcl-2 in osteosarcoma[J].Biomed Pharmacother,2016,84:828.
[29]Niu J,Sun Y,Guo Q,et al.Serum miR-95-3p is a diagnostic and prognostic marker for osteosarcoma[J].Springerplus,2016,5(1):1947.
[30]Liu K,Sun X,Zhang Y,et al.MiR-598:A tumor suppressor with biomarker significance in osteosarcoma[J].Life Sci,2017,188:141.
[31]Wang SN,Luo S,Liu C,et al.miR-491 Inhibits Osteosarcoma Lung Metastasis and Chemoresistance by Targeting αB-crystallin[J].Mol Ther,2017,25(9):2140.
[32]Liu K,Sun X,Zhang Y,et al.MiR-598:A tumor suppressor with biomarker significance in osteosarcoma[J].Life Sci,2017,188:141.
[33]Li Q,Song S,Ni G,et al.Serum miR-542-3p as a prognostic biomarker in osteosarcoma[J].Cancer Biomark,2017,[Epub ahead of print]

