紫花地丁与长萼堇菜的傅里叶变换红外光谱鉴别
贺雨馨,孙志蓉,曲继旭,程丽丽,朱南南
(北京中医药大学中药学院,北京 100102)
紫花地丁为堇菜科植物紫花地丁(ViolayedoensisMakino)的干燥全草,其功效为清热解毒、凉血消肿,用于疔疮肿毒、痈疽发背、丹毒及毒蛇咬伤[1]。紫花地丁不仅是我国传统中药之一,其在四川白马藏区和贵州侗族等少数民族区域常作为治疗皮癣、脚气等真菌性皮肤病的药物。现代药理研究发现紫花地丁具有良好的抗菌、抗氧化、抗病毒、抗肿瘤、调节免疫等功效[2]。由于堇菜属的一些植物从外观形态上不好区分,所以药材市场中的紫花地丁也存在来源混杂的问题。本课题组在贵州黔东南侗族聚居地采集的紫花地丁中常混有长萼堇菜(Violainconspicua),二者不仅外观形态相似,且种内变异现象普遍,导致无法准确区分。目前紫花地丁及其混淆品的鉴别方法研究主要集中在形态、显微及色谱鉴别方面[3]。本课题组在显微鉴别研究中发现,紫花地丁与长萼堇菜因亲缘关系近,因而差别较小,而色谱分析鉴别方法要求精度高、操作复杂、分析所需时间长。有研究从分子水平对紫花地丁及其混淆品进行了研究,确定了正品紫花地丁中8个特异性鉴别位点[4],为紫花地丁的准确鉴别提供了依据,但是分子鉴别在实际应用中因成本高,不便于推广,因此急需建立简便的、准确的鉴别方法,以保证紫花地丁用药准确。傅里叶变换红外光谱法(Fourier transform infrared spectroscopy,FT-IR)是用于鉴别化合物和确定分子结构的常用手段之一,其在中药材鉴别中的应用也在不断深入[5-9]。本文采用一维红外光谱、二阶导数谱分析技术对紫花地丁和长萼堇菜的不同提取物进行结构分析及鉴定,建立鉴别紫花地丁与长萼堇菜的分析方法。
1 材 料
1.1 样品来源
在贵州黔东南地区黎平县海拔600m以上山区,采集生长良好的样品植株全草,经DNA条形码技术鉴定为紫花地丁(Violayedoensis)和长萼堇菜(Violainconspicua)。
1.2 试 剂
溴化钾(KBr,纯度为99.9%)、石油醚、氯仿、乙酸乙酯、乙醇均为分析纯(北京化工厂);水为二次蒸馏水。
1.3 仪 器
Spectrum GX FT-IR红外光谱仪(美国Perkin Elmer公司),测定范围4 000~400 cm-1,含DTGS检测器,光谱分辨率4 cm-1,扫描信号累加次数32次,扫描时实时扣除水和CO2的干扰。BS110S电子分析天平,BP211D电子分析天平(德国Sartorius公司);G-20离心机(北京白洋医疗器械有限公司)。
2 方 法
2.1 样品制备
2.1.1 50%乙醇提取物的制备 准确称取紫花地丁与长萼堇菜的细粉各2 g,加10倍量50%乙醇,加热回流提取2 h,离心,回收上清液。药渣以5倍量提取溶剂再次提取。合并上清液,减压浓缩至浸膏状,烘干即得提取物。
2.1.2 不同萃取部位的制备 称取紫花地丁与长萼堇菜的细粉200 g,加10倍量50%乙醇,加热回流提取2 h,离心,回收上清液。药渣以5倍量提取溶剂再次提取。合并两次上清液,减压浓缩至溶液无醇味。分别用石油醚萃取,将溶液中色素尽数除去,再分别依次用氯仿、乙酸乙酯、正丁醇萃取。得相应的萃取部位,浓缩后即得不同萃取部位样品。
2.1.3 图谱扫描 将紫花地丁和长萼堇菜的提取物粉末和不同萃取部位粉末粉碎研磨过200目筛与KBr粉末混合研磨(药材与KBr用量之比约为2∶100)压片,红外光谱测定,获得样品的红外谱图。
2.2 数据处理
红外图谱采用Spectrum V6.3.5操作软件,对样品进行数据采集和图谱预处理,预处理过程包括基线校正(baseline automatic correction)和比对(compare);二阶导数谱采用Spectrum v6.3操作软件,13点平滑。
3 结 果
3.1 紫花地丁与长萼堇菜乙醇提取物红外光谱主体成分解析
将紫花地丁与长萼堇菜50%乙醇提取物一维红外光谱进行比对,两者在3 382 cm-1附近出现O-H伸缩振动峰,在2 928、2 856 cm-1处出现C-H键伸缩振动吸收峰,在该波数范围内两者吸收峰形相似,无明显差别。两样品均具有1 605、1 512 cm-1两个吸收峰,为苯环的C=C吸收峰,说明紫花地丁与长萼堇菜均含有芳香类物质。而两者在一维红外谱图上的区别集中在1 384~1 605 cm-1范围内,在1 384 cm-1处吸收峰为C-H弯曲振动或-OH弯曲振动,紫花地丁在此为一个尖峰,而长萼堇菜的峰形较钝,且在临近1 384 cm-1处的1 400 cm-1处出现一个小峰。1 384 cm-1附近的峰与1 605 cm-1附近的峰相对强度不同,紫花地丁在1 384 cm-1处的峰强度强于1 605 cm-1处,而长萼堇菜在1 384 cm-1处的峰强弱于1 605 cm- 1处。由于一维谱图中存在重叠峰,故两个样品的差别相对较小,进一步区别需要由二阶导数谱将一维谱图中的重叠峰分开,以提高谱图的分辨率,再进行分析。
从紫花地丁与长萼堇菜50%乙醇提取物的二阶导数谱(图1)可以看出,长萼堇菜在1 679 cm-1处和在1 176 cm-1处的峰强度均强于紫花地丁;紫花地丁在1 384 cm-1处的峰强度强于长萼堇菜;两样品在1 629 cm-1附近的峰与1 603 cm-1附近的峰相对强度不同,长萼堇菜样品在1 629 cm-1附近的峰强度强于1 603 cm-1附近的峰,而紫花地丁样品在1 629 cm-1附近与1 603 cm-1附近的峰强度相当。紫花地丁50%醇提取物最强峰出峰位置在1 384 cm-1处,而长萼堇菜在1 384 cm-1处和1 679 cm-1处的峰强度相当。二者出峰位置相差波数在1~5个波数之间。二者在二阶导数谱中,尤其是1 700~1 300 cm-1波数范围内的差别更为明显,这个范围内主要是酰胺类及芳香族物质的特征吸收带,说明二者此类物质的差别较大。

Figure1 Second derivative spectrum of the alcohol extract ofViolayedoensisMakino(A) andViolainconspicua(B)
3.2 紫花地丁与长萼堇菜石油醚萃取部位红外光谱主体成分解析
紫花地丁与长萼堇菜石油醚萃取部位一维红外光谱图,与50%乙醇提取物相比较,谱图的特征峰更为明显,长萼堇菜在937、913、905 cm-1处有尖峰,而紫花地丁在937、913、905 cm-1处没有明显尖峰,紫花地丁样品在1 076 cm-1附近的峰相对峰强度强于1 036 cm-1附近的峰,长萼堇菜在1 076 cm-1附近的峰相对峰强度弱于1 036 cm-1附近的峰。该波数范围内主要为醇、酚、酯和芳香族的特征吸收峰。紫花地丁与长萼堇菜具有丰富的挥发性物质,根据这个波段吸收峰峰形及峰强的区别,可以推测紫花地丁与长萼堇菜所含挥发性物质之间存在差别。
在相应的二阶导数谱(图2)中可以看出两者之间的差别,长萼堇菜在1 179、936、918、904、869、849 cm-1处的峰强度明显高于紫花地丁在该处的峰强度。两种样品在1 129 cm-1附近的峰与1 076 cm-1附近的峰相对强度不同,紫花地丁样品在1 076 cm-1附近的峰强度强于1 128 cm-1附近的峰,长萼堇菜样品两峰的峰强度相当。紫花地丁在826 cm-1处的峰强度强于长萼堇菜。紫花地丁样品和长萼堇菜样品的最强峰出峰位置均在1 467 cm-1处,紫花地丁中强峰出峰位置在1 382 cm-1处,长萼堇菜中强峰出峰位置在1 377 cm-1处。

Figure2 Second derivative spectrum of the petroleum ether extraction site ofViolayedoensisMakino(A) andViolainconspicua(B)
3.3 紫花地丁与长萼堇菜氯仿萃取部位红外光谱主体成分解析
将紫花地丁与长萼堇菜氯仿萃取部位一维红外光谱进行比较可以发现,两者均具有1 715 cm-1附近的C=O伸缩振动峰,且具有1 602、1 514、1 463 cm-1的苯环振动峰,猜测两者均具有香豆素类或黄酮类物质。长萼堇菜1 232、1 715 cm-1附近的峰峰强度强于紫花地丁在1 232、1 714 cm-1附近的峰峰强度,而紫花地丁在1 665 cm-1处峰强度强于长萼堇菜,紫花地丁在3 413、1 383、1 165、1 124、1 070、1 035 cm-1处出峰,长萼堇菜在 3 416、1 378、1 179、1 127、1 074处、1 033 cm-1处出峰,以上出峰位置紫花地丁与长萼堇菜存在不同,由于波数相差较大,说明该处各个峰中可能存在重叠峰的情况,故运用二阶导数谱图进行进一步比较。
在二阶导数图谱(图3)上对两者的出峰位置及峰强进行比较发现,紫花地丁样品在1 383 cm-1处出峰,长萼堇菜在1 378 cm-1处出峰,且紫花地丁该处的峰强度强于长萼堇菜该处峰强度;紫花地丁样品在1 739 cm-1处峰形较尖,长萼堇菜在1 740 cm-1处出峰,峰形较钝;长萼堇菜在1 179、1 143 cm-1处的峰强度强于紫花地丁在此波数的峰强度。紫花地丁样品和长萼堇菜样品在1 712~1 600 cm-1波段内及在970~800 cm-1波段内的峰形明显不同。紫花地丁样品和长萼堇菜样品的最强峰出峰位置均在1 466 cm-1处,紫花地丁样品中强峰出峰位置在1 601、1 516、1 383 cm-1处,长萼堇菜样品中强峰出峰位置在1 516 cm-1处。在970~800 cm-1波段内,长萼堇菜出现了6个自动峰,而紫花地丁则出现4个自动峰,且在峰强,峰位以及峰形上存在差别。
3.4 紫花地丁及长萼堇菜乙酸乙酯萃取部位红外光谱主体成分解析
通过分析紫花地丁与长萼堇菜乙酸乙酯萃取部位一维红外谱图发现紫花地丁在3 347 cm-1处出峰,峰形较钝,长萼堇菜在3 418 cm-1处出峰,峰形较尖;长萼堇菜在1 652 cm-1和1 606 cm-1处峰强度明显高于紫花地丁在1 655和1 604 cm-1处的峰强度。紫花地丁在1 074、974、913、840 cm-1处出现糖环振动峰,而长萼堇菜只在1 074与840 cm-1处出峰,初步说明紫花地丁与长萼堇菜乙酸乙酯萃取部位所含的糖苷有所不同。
精密度更高的二阶导数谱图(图4)显示,1 739 cm-1附近的峰与1 710 cm-1附近的峰相对强度不同,紫花地丁1 739 cm-1相对峰强度强于1 710 cm-1,而长萼堇菜在两处的峰相对峰强度相当;长萼堇菜在1 384 cm-1处出峰,紫花地丁在1 381 cm-1处出峰,二者相差3个波数,且长萼堇菜在1 384 cm-1处出峰的峰强度强于紫花地丁在1 381 cm-1处出峰的峰强度;1 467 cm-1附近的峰与1 384 cm-1附近的峰相对强度不同,紫花地丁1 467 cm-1相对峰强度强于1 381 cm-1,长萼堇菜在该两处的峰的峰强与紫花地丁相反。长萼堇菜在1 453 cm-1处出峰,紫花地丁在1 453 cm-1处未出峰。紫花地丁样品和长萼堇菜样品在950~800 cm-1波段内有明显的区别,紫花地丁出现6个自动峰,而长萼堇菜出现4个自动峰。紫花地丁样品最强峰出峰位置在1 467 cm-1处,长萼堇菜样品的最强峰出峰位置在1 384 cm-1处,紫花地丁样品中强峰出峰位置在1 739、1 514 cm-1处,长萼堇菜样品中强峰出峰位置在1 514、1 467 cm-1处。
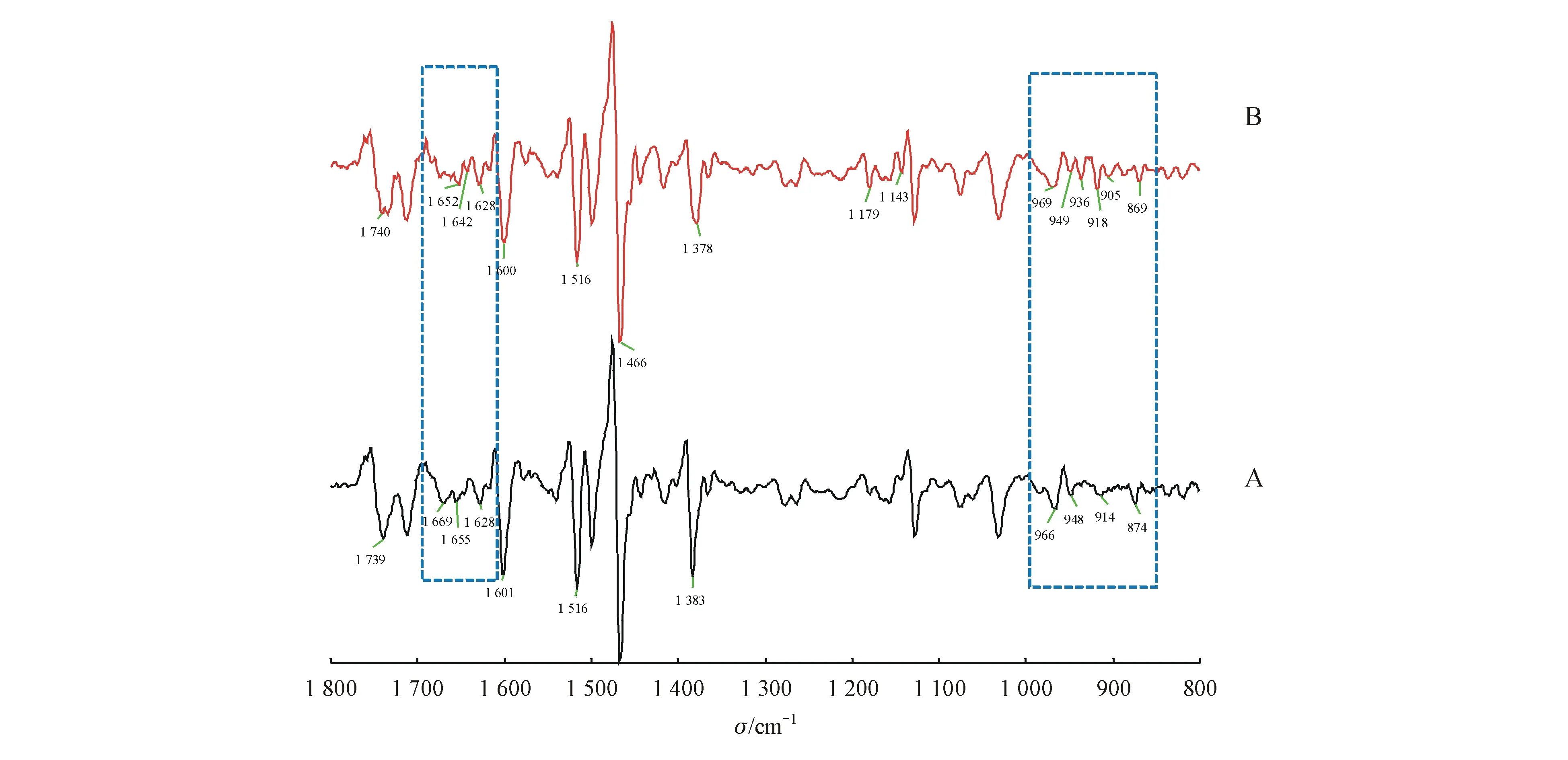
Figure3 Second derivative spectrum of the chloroform extraction site ofViolayedoensisMakino(A) andViolainconspicua(B)
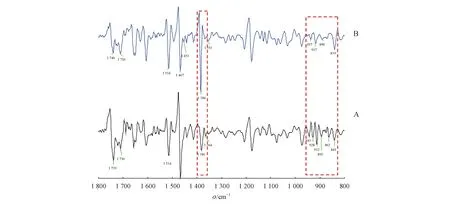
Figure4 Second derivative spectrum of the ethyl acetate extraction site ofViolayedoensisMakino(A) andViolainconspicua(B)
4 讨 论
从紫花地丁与长萼堇菜提取物与不同萃取部位的一维红外图谱中,可以推测出两者均含有挥发性物质、芳香类物质及糖苷类物质,这与文献报道相一致[10-14]。红外光谱能够通过出峰位置,峰强以及峰数来区别不同的物质。通过对两者的一维光谱图比较发现,二者的光谱差别并不明显,这是因为紫花地丁和长萼堇菜为同属植物,在化学成分上存在相似性。一维谱图中两者的区别主要集中在波数小于1 800 cm-1的范围内,故在对其进行二阶求导时,主要针对该区段进行求导分析。二阶导数谱中二者的区别更为明显,主要是峰强和峰数之间的差别。在50%乙醇提取物的二阶导数谱中,紫花地丁1 384 cm-1处的峰明显强于1 679 cm-1处,而长萼堇菜在两处的吸收峰强度相当。在石油醚萃取部位二阶导数谱图中,紫花地丁在950~900 cm-1波段内的峰强与吸收峰数量均小于长萼堇菜。在氯仿萃取二阶导数谱图中,二者在1 628~1 670 cm-1范围内的吸收峰和970~850 cm-1范围内的吸收峰峰强存在差别,尤其是在970~850 cm-1范围内,自动峰的数量、出峰位置以及峰强都存在区别。通过乙酸乙酯萃取部位二阶导数谱可以发现,紫花地丁最强峰出现在1 467 cm-1,而长萼堇菜的最强峰出现在1 384 cm-1。根据现有研究结果,发现紫花地丁与长萼堇菜乙酸乙酯萃取部位二阶导数谱中最强峰的出峰位置有明显区别,可以通过该部位对紫花地丁与长萼堇菜进行准确品种鉴别。一维红外光谱与二阶导数分析方法相结合,可以实现紫花地丁与长萼堇菜的区分鉴别。
堇菜属植物分布广,种类众多,形态变异复杂且具有普遍杂交现象,并且堇菜属植物在地方药上多作为紫花地丁使用,因此市场中常出现一些难以从形态上进行辨别的紫花地丁混淆品,如早开堇菜、东北堇菜、白花堇菜、长萼堇菜、犁头草、新疆堇菜等[15-16]。这些混淆品在外观形状上难以与正品紫花地丁相区别。本试验采用红外光谱法结合二阶导数分析技术获得紫花地丁与常见混淆品长萼堇菜的主体化学成分结构信息,证明该鉴定方法在紫花地丁与长萼堇菜鉴别上的可行性,不仅为紫花地丁与其混淆品的鉴别提供新思路,也为其他基原相近、易混淆的中药品鉴别提供了一个可发展的方向。
研究表明,不同产地的紫花地丁在总黄酮和微量元素上存在明显差别[17],同时红外光谱也存在差别[18]。后期本课题组将针对不同产区的紫花地丁和长萼堇菜的红外光谱进行研究,探讨不同产区两者挥发性物质、芳香类物质及糖苷类物质之间的差别,建立更全面的红外光谱鉴别方法。
参 考 文 献
[1] Chinese Pharmacopoeia Commission.ChinesePharmacopoeia:part1(中华人民共和国药典:一部)[S].Beijing:China Medical Science Press,2015:337-338.
[2] Cheng LL,Sun ZR,Zhu NN,etal.Research Status of Pharmacology ofViolayedoensisMakino[C].ChinaCommoditiesSocietyAcademicForum(中国商品学会学术论坛).2015.
[3] Zhang YY,Hou HC,Yang JY.Comparison ofViolayedoensisMakino and its common counterfeit[J].ModChinMed(中国现代中药),2010,12(7):25-27.
[4] Zhu Y.Studies on pharmacognosy of Violae herba and adulterant(紫花地丁及其常见混淆品的生药学研究)[D].Luzhou:Southwest Medical University,2014.
[5] Yang YR,Liu F.Study of dendrobium from Yunnan by Fourier transform infrared spectroscopy combined with hierarchical cluster analysis[J].ChinJInformTraditChinMed(中国中医药信息杂志),2014,21(9):75-79.
[6] Li XN,Liu XP,Li QR,etal.FTIR spectrum identification ofHedyotisdiffusaand its counterfeit[J].JChinMedMater(中药材),2004,27(5):335-337.
[7] Zhang DY,Chen JT,Wang MF,etal.Identification of quality goods and adulterants of traditional Chinese medicineLygodiumjaponicum(Thumb.) Sw by FT-IR[J].JAnhuiAgricSci(安徽农业科学),2017,45(10):115-117.
[8] Zhou Y,Li PF,Zhang QWetal.Study on the identification of partial Herba Japonicum by Fourier transform infrared spectroscopy[J].SpectroscSpectralAnal(光谱学与光谱分析),2013,33(7):1791-1795.
[9] Li YW,Zhou FQ,Wang LP,etal.FTIR fingerprint identification ofZiziphusjujubaand its counterfeit[J].ChinArchTraditChinMed(中华中医药学刊),2005,23(4):713-715.
[10] Li YM,Gong Y,Jiang YP.Determination of volatile components in different parts ofViolainconspicusin Guizhou[J].GuizhouAgricSci(贵州农业科学),2017,45(3):14-17.
[11] Cao J.Qualitative and qualitative studies on the flavone glycosides ofViolalyedoensis(紫花地丁黄酮苷类成分的定性定量研究)[D].Shanghai:Fudan University,2013.
[12] Chen HL,Sun J,Qin FF,etal.Studies on chemical constituents of petroleum ether extract ofViolayedoensisMakino.by GC-MS chromatogram[J].JChengduUnivTraditChinMed(成都中医药大学学报),2013,36(1):50-52.
[13] Liu H,Hu W,Fang Y.Chemical constituents in ethyl acetate fraction fromViolayedoensis[J].AnhuiMedPharmJ(安徽医药),2015(6):1068-1071.
[14] Gong Y,Jiang YP,Li YM.Determination of total flavonoids inViolainconspicua[J].JQiannanMedCollNationalities(黔南民族医专学报),2016,29(3):157-159.
[15] Chen YS.Taxonomic revision of Viola L.in China(中国堇菜属的分类修订)[D].Beijing:Graduate University of Chinese Academy of Sciences,2006.
[16] Zhu JJ,Chen XL.Study on the Classification ofViolayedoensisin Hangzhou and its similar species[J].ZhejiangJTraditChinMed(浙江中医杂志),2010,45(1):54-55.
[17] Yang Y,Zhang XF,Jiang H,etal.Assay of flavonoids and trace elements inViolayedoensisMakino from different habitats[J].ChinJHospPharm(中国医院药学杂志),2016,36(5):342-346.
[18] Mai X,Ouyang T,Cao YS,etal.Application of second derivative IR fingerprint spectra to origin prediction of the TCM ofViolayedoensisMakino[J].PhysTestChemAnalB:ChemAnal(理化检验-化学分册),2011,47(1):12-14.

