心房颤动患者血浆miRNA-1和miRNA-155检测在复律后复发预测的应用研究*
姚少侠,罗文强(.西安市第八医院检验科,西安 7006;.咸阳市中心医院检验科,陕西咸阳 7000)
心房颤动(房颤)是临床中最常见的心律失常,且发病率随年龄增长而增多。心房结构重构被发现在房颤发病机制中扮演重要的角色[1]。但房颤在复律后常常复发,因此针对房颤复发的正确预测有助于早期发现高危患者,并及时选择合适的治疗方案,减少患者的风险。微小RNA (microRNAs,miRNAs)是一类内源性非编码小分子RNA,它们在心房结构重构中的重要作用已被证实[2]。本研究通过RT-PCR技术检测房颤患者血浆miRNA-1和miRNA-155的表达,探讨其在心房结构重构中可能的作用机制,进一步发现房颤复律后复发有效的预警标志物和干预靶点。
1材料与方法
1.1 研究对象 选取2015年10月~2017年11月于西安市第八医院和咸阳市中心医院复律成功的房颤患者110例(复律组),其中30例患者复律后复发(复发组),80例患者未复发(未复发组)。房颤患者年龄60.12±13.37岁,男性61例,女性49例。110例房颤患者中包括阵发性房颤57例和持续性房颤53例,其中高血压59例,冠心病47例,心肌病4例。所有房颤患者的诊断均经心电图和动态心电图证实。排除标准:房室传导阻滞,胺碘酮治疗≥12周无效者,病态窦房结综合征,美国NYHA 心功能分级Ⅰ级或虽为Ⅱ级但经利尿剂、洋地黄等治疗能达到Ⅰ级者,糖尿病、甲状腺功能亢进、胺碘酮过敏、洋地黄中毒、严重冠脉疾病,肝、肾功能障碍,感染性疾病。各组患者的性别和年龄比较差异无统计学意义(P>0.05)。本研究经本院伦理委员会批准,并得到所有研究对象的知情同意。
1.2 试剂和仪器 房颤患者血浆miRNA-1和miRNA-155表达水平采用RT-PCR检测。采用罗氏MODULARP800全自动生化分析仪检测各组研究对象空腹血糖及总胆固醇水平。所有研究对象应用超声心动仪评价左房内径及左心室射血分数。应用美国Invitrogen公司试剂提取血浆总RNA。采用上海久盛医疗用品有限公司的PCR试剂盒进行实验。德国Roche公司的lightCycler荧光PCR仪和全自动化学发光分析仪。
1.3 研究方法 复律组患者服用胺碘酮预防房颤复发,用法:口服胺碘酮每次0.2 g,每天3次。5~7天后改为每天2次,再过5~7天后改为每天1次。若维持3个月未出现复发,可进一步减量或停药观察。定期复查。12个月后80例患者维持窦性心律,30例患者于12个月内复发。复发率为27.27%。
1.4 研究方法
1.4.1 随访:每个月随访一次,房颤复发评价依据患者症状、心电图或动态心电图。服用胺碘酮后12个月内未复发者为房颤未复发组,否则为房颤复发组。
1.4.2 标本采集:复律组患者于复律成功后采集肘静脉血4 ml,复发组和未复发组患者于复律后12月采集肘静脉血4 ml,全血分为两管,一管用EDTA抗凝,在2 h之内,3 000 r/min离心15 min分离血浆,用于检测miRNAs。另一管用同样的速度离心分离血清,用于检测血糖和总胆固醇。分离的血浆和血清移至冻存管中,-80℃保存。
1.4.3 miRNAs表达量检测:miRNAs的引物采用pfimer5软件设计,miRNA-1的引物序列为:正义链5’-AGCGGCAGAATCAGGAGTA-3’,反义链5’-GAGGACCTTGGAGGCAGAC-3’,产物长度660 bp。miRNA-155的引物序列为:正义链5’-TTAATGCTAATCGTGA-3’,反义链5’-ACCTGAGAGTAGACCAGA-3’,产物长度630 bp。β-actin作为内参照,引物序列为:正义链5’-ATGTCACGCACGATTTCC-3’,反义链5’-CTGTCCCTGTATGCCTCTG-3’,产物长度360 bp。反应条件:95℃3 min→95℃60 s,60℃60 s,70℃1.5 min,40个循环→70℃15 min→4℃保存。在测序仪上测定PCR产物的序列,其结果与GenBank中的已知序列进行同源性比较。对PCR产物应用3 g/dl的凝胶进行电泳分析,通过系统扫描记录处理后,得到miRNAs变化的Ct值(△Ct)。由2-△Ct计算得出miRNAs的相对表达量。△Ct=(miRNA)Ct-(β-actin)Ct。
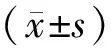
2结果
2.1 各组基线资料比较 见表1。左心房内径和收缩压在复发组的检测结果分别与复律组和未复发组比较显著增高,差异均有统计学意义(均P<0.01);而它们在复律组的结果分别与未复发组比较差异则无统计学意义(均P>0.05);三组的空腹血糖、总胆固醇水平和射血分数比较,差异均无统计学意义(均P>0.05)。

表1 各组部分心血管危险因素结果比较
注:TC:总胆固醇;FBG:空腹血糖;EF:左室射血分数。
2.2 各组miRNA-1和miRNA-155表达水平比较 见表2。miRNA-1和miRNA-155在复发组的表达分别与未复发组和复律组比较明显上调、下调,差异有统计学意义(t=21.37,20.57,P<0.01;t=18.77,11.71,P<0.01);两标志物在未复发组的表达与复律组比较差异无统计学意义(t=0.67,0.54,P>0.05)。
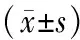
表2 各组miRNA-1和miRNA-155表达水平比较
2.3 相关性分析 在复发组中,miRNA-1和miRNA-155的表达呈负相关(r=-0.673,P<0.01)。且它们分别与左心房内径、收缩压具有相关性(r=0.528,-0.537,P<0.01)。
2.4 ROC曲线分析 复发组分别以复律组和未复发组为参照,血浆miRNA-1的AUC分别为0.743(95%CI:0.627~0.839),P<0.01;0.730(95%CI:0.21~0.826),P<0.01,血浆miRNA-155的AUC分别为0.703(95%CI:0.628~0.837),P<0.01;0.685(95%CI:0.603~0.813),P<0.01。显示血浆miRNA-1和miRNA-155水平在房颤复律后的复发预测中有诊断意义。miRNA-1和miRNA-155 ROC曲线见图1~2。
3讨论近年来的研究认为,房颤的发生及维持的机制被认为是由于心房结构重构所导致的。这种重构主要表现为心房肌细胞凋亡、肌原纤维溶解以及心房肌纤维化[3]。目前,心房结构重构在房颤动物模型及房颤患者中均发现,其中心房肌纤维化主要包括胶原排列紊乱、比例失衡以及增多的胶原沉积于间质,这些变化导致房内传导的不均一性[4]。miRNAs在心脏疾病中的应用已被证实[5]。目前研究房颤患者miRNAs的作用机制已成为发现房颤复律后的复发监测及干预治疗的热点,通过调控miRNAs的表达,可能逆转心房结构重构以及预防房颤的发生或复发。有研究分析房颤组、对照组以及复发组研究对象的外周血miRNAs表达水平发现,有25种miRNAs在消融复律术前表达减少或术后表达增多[6]。有报道认为,基因敲除miRNA-155可促进压力负荷而诱导心脏重构,其作用机制可能为心肌组织的miRNA-155过量表达,使血管紧张素Ⅱ型受体下调,抑制心肌肥厚和纤维化过程[7~9]。进一步的研究显示,心房颤动射频消融术前后外周血miRNA-155的表达水平存在显著差异,其在术前明显下降,而在术后增加,可能机制为miRNA-155的调控使术前房颤易感性增加,心房纤维化增强,而术后则发生心房纤维化逆转[10]。本研究采用RT-PCR技术分析房颤患者血浆miRNA-155的表达提示,复发组miRNA-155表达显著低于复律组。揭示miRNA-155可能与房颤复律后复发的病理过程有关,其表达的差异可为房颤复发的预测提供参考依据。复发组miRNA-155表达低于未复发组,提示miRNA-155可能参与心房纤维化,参与房颤调控。复律组miRNA-155表达与未复发组比较无差异,推测房颤患者经过该标志物的调控可能使心房重构发生逆转。
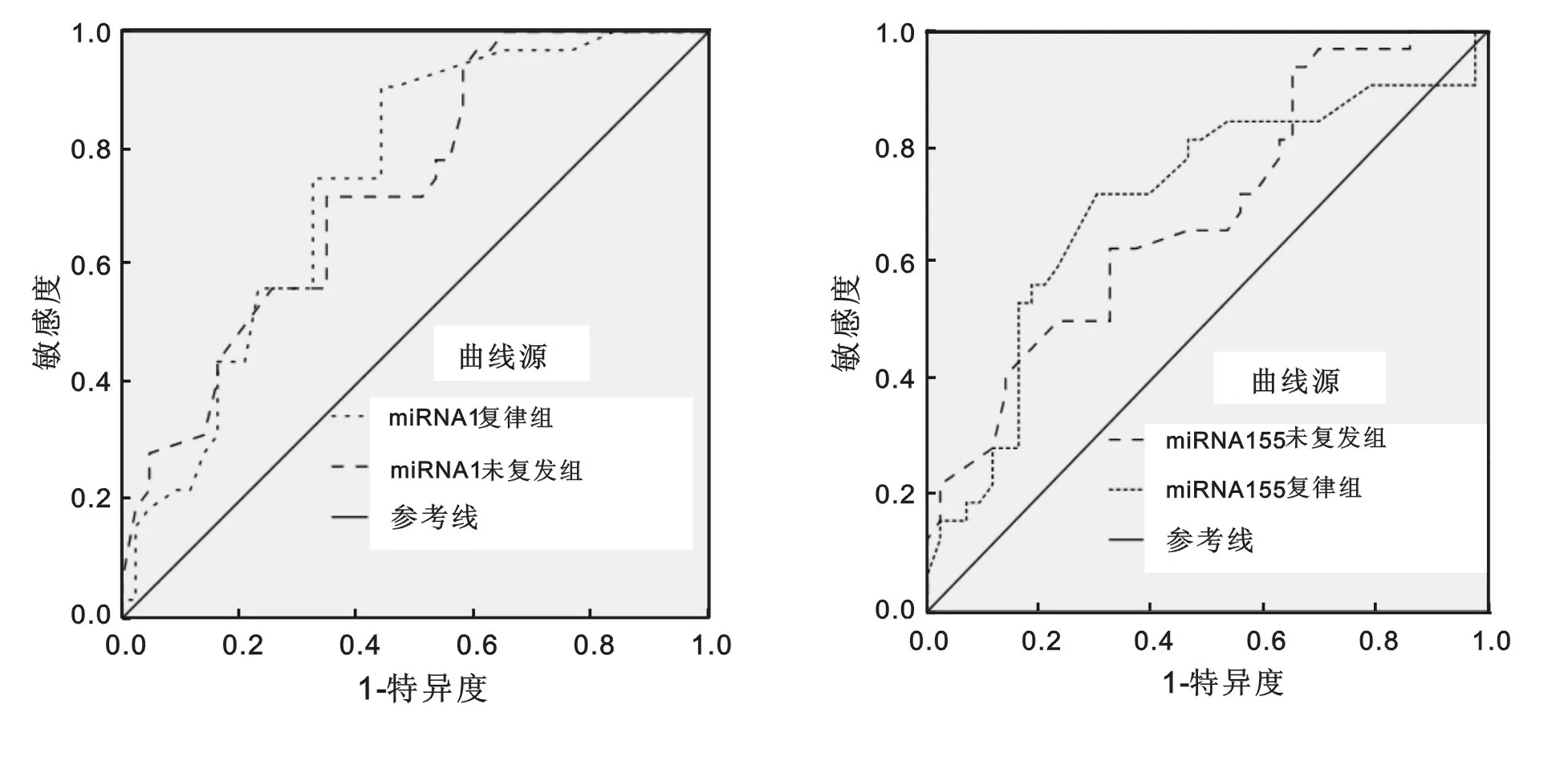
图1 检测miRNA-1在诊断房颤复发中的ROC曲线 图2 检测miRNA-155在诊断房颤复发中的ROC曲线
除了上述microRNAs外,miRNA-1在许多心脏疾病发挥重要作用,特别是其可能参与心律失常的病理生理过程。Wu等[11]研究发现,梗死小鼠的心律失常可能为心脏内miRNA-1的过量表达所致。另外的研究认为miRNA-1可能引起心肌缺血时离子通道的失衡进而导致心律失常[12]。miRNA-1在心房颤动中的作用也印证了上述观点。本研究采用RT-PCR技术分析房颤患者血浆miRNA-1的表达显示,复发组miRNA-1表达显著高于复律组和未复发组。提示其对于房颤发作时心肌的代谢具有调控作用,这些变化显示miRNA-1可能参与房颤的复律和维持的病理过程。因此,推测miRNA-1可应用于房颤复律后复发的早期诊断,并在其治疗中发挥积极的作用。
miRNA-1和miRNA-155在复发组中的表达量具有相关性(P<0.01),且与左房内径及收缩压也有明显相关性(P<0.01),提示两标志物与房颤的发生、发展密切相关。进一步揭示复律治疗后患者的心功能都得到明显改善,而复发患者的心房重构则可能未发生逆转。miRNA-1和miRNA-155的ROC曲线分析显示两标志物在血浆的表达水平能有效地预测房颤的复发。综上所述,血浆miRNA-1和miRNA-155的表达水平可预测房颤复律后的复发,两标志物可能成为房颤复发有效地预警标志物和干预靶点。
参考文献:
[1] Pellman J,Sheikh F.Atrial fibrillation:mechanisms,therapeutics,and future directions[J].Compr Physiol,2015,5(2):649-665.
[2] 蒋智渊,钟国强,肖 飞,等.微小RNA-101 在心房颤动心房纤维化中的作用[J].实用医学杂志,2015,31(6):890-893.
Jiang ZY,Zhong GQ,Xiao F,et al.Effect of miRNA-101 on atrial fibrillation in human chronic atrial fibrillation[J].The Journal of Practical Medicine,2015,31(6):890-893.
[3] Zhao J,Hansen JB,Wang Y,et al.Three-dimensional integrated functional,structural,and computational mapping to define the structural “Fingerprints” of heart-specific atrial fibrillation drivers in human heart ex vivo[J].J Am Heart Assoc,2017,6(8):e005922.
[4] Dai H,Wang X,Yin S,et al.Atrial fibrillation promotion in a rat model of rheumatoid arthritis[J].J Am Heart Assoc,2017,6(12):e007320.
[5] 程 涛,黄 刚.血清miRNA-21,miRNA-126表达在诊断PCI术后冠状动脉再狭窄的临床应用价值[J].现代检验医学杂志,2018,33(1):59-62,66.
Cheng T,Huang G.Clinical value of serum miRNA-21 and miRNA-126 expression in diagnosis of the coronary artery restenosis after PCI[J].Journal of Modern Laboratory Medicine,2018,33(1):59-62,66.
[6] 崔淯夏,苏 迎,李 龙,等.心房颤动射频消融手术可逆转微小RNA的调控异常[J].中华心血管病杂志,2015,43(12):1051-1056.
Cui YX,Su Y,Li L,et al.Radiofrequency ablation can reverse the abnormal ciycalating microRNA expression changes in patients with atrid fibrillation[J].Chinese Journal of cardiovascular disease,2015,43(12):1051-1055.
[7] Wei Y,Yan X,Yan L,et al.Inhibition of microRNA-155 ameliorates cardiac fibrosis in the process of angiotensin II-induced cardiac remodeling[J].Mol Med Rep,2017,16(5):7287-7296.
[8] Lorenzen JM,Schauerte C,Hübner A,et al.Osteopontin is indispensible for AP1-mediated angiotensin II-related miR-21 transcription during cardiac fibrosis[J].Eur Heart J,2015,36(32):2184-2196.
[9] Papageorgiou N,Tsalamandris S,Giolis A,et al.MicroRNAs in cardiovascular disease:Perspectives and reality[J].Cardiol 2016,24(3):110-118.
[10] 赵 晟,杨 诺,岳语喃,等.射频消融术改变心房颤动患者外周血微小RNA表达谱[J].中华老年心脑血管病杂志,2015,17(7):725-731.
Zhao S,Yang N,Yue YN,et al.Radiofrequency ablation of atrial fibrillation rebalances atrial ion current remodeling by regulating miRNAs[J].Chinese Journal Geriatric Heart Brain and Vessel,2015,17(7):725-731.
[11] Wu A,Lou L,Zhai J,et al.miRNA expression profile and effect of wenxin granule in rats with ligation-induced myocardial infarction[J].Int J Genomics,2017,2017:2175871.
[12] Wu A,Zhao M,Lou L,et al.Effect of wenxin granules on gap junction and MiR-1 in rats with myocardial infarction[J].Biomed Res Int,2017,2017(5):3495021.

