羊口疮病毒强毒株与传90代毒株毒力相关基因的序列比较
张 静,仲 亮,李 智,李秀男,范峻豪,刘春羽,张七斤
(内蒙古农业大学兽医学院,内蒙古呼和浩特 010018)
羊口疮(ORF)又称羊传染性脓疱病(CE)、接触传染性脓疱性口炎,是由羊口疮病毒(ORFV)引起的一种接触性人兽共患病[1-2]。ORFV属痘病毒科副痘病毒属,基因全长139 kb,是痘病毒属中最小的病毒。该属成员还有伪牛痘病毒、牛丘疹性口炎病毒、新西兰马鹿副痘病毒[3-4]。ORFV基因组末端区域有许多免疫调节基因,其编码的蛋白决定了病毒的宿主范围、发病机理和毒力[5]。到目前为止,在GenBank数据库中,具有全基因组序列的ORFV毒株有:美国株OV-SA00(登录号AY386264)、OV-IA82(登录号AY386263),德国株D1701(登录号HM133903)和新西兰标准株NZ2(登录号DQ184476)[6]。这些毒株编码132个基因[7]。ORFV基因编码的含有毒力的蛋白主要有:病毒干扰素抑制蛋白(OVIFNR、ORF020),趋化因子结合蛋白(CBP、ORF112),GM-CSF/IL-2抑制蛋白(GIF、ORF117),病毒白细胞介素10(vIL-10、ORF127)和血管内皮生长因子(VEGF,ORF132)等。最近还有样细胞凋亡抑制剂(Bcl-2、ORFV125)与信号通路抑制剂(NF-κB、ORF024)等被鉴定出来。由于两头末端区域的大多基因编码的是与病毒
致病机制有关的蛋白,因此对ORFV相关毒力基因的了解与研究是其免疫学研究的基础。研究清楚这些基因是否发生重组及非必须基因的替换等有助于其毒力基因生物学特性和病毒致病机制的研究。
本研究通过对ORFV/QD/2015强毒株与传90代后毒株毒力相关基因的对比分析,为毒力相关基因在强弱毒株之间造成的差异提供试验基础,为解释ORFV的免疫逃避机制与构建新的基因工程疫苗提供理论依据。
1 材料与方法
1.1 病毒株
ORFV/QD/2015分离株[8],由内蒙古农业大学兽医学院传染病教研室分离保存。
1.2 细胞系
山羊皮肤成纤维细胞,由中国科学院典型培养物保藏委员会昆明细胞库提供。
1.3 主要试剂
DMEM、胰酶和胎牛血清等:购自Gibco公司;病毒DNA提取试剂盒,胶回收试剂盒,DL2000Marker、2×Easy Taq SuperMix、质粒DNA提取试剂盒等:购自TIANGEN公司等。
1.4 主要仪器
凝胶成像系统Alph imager HPr(美国)、梯度PCR仪TAdvanced 96G(德国)、电泳仪(DYCP-328)等。
1.5 引物设计与合成
根据GenBank上发表的毒株OV-SA00全基因参考序列,参照已编码的含有毒力的4组基因序列片段,用Primer 5.0生物软件设计并合成特异性引物(表1)。引物均由生工生物工程(上海)股份有限公司合成。
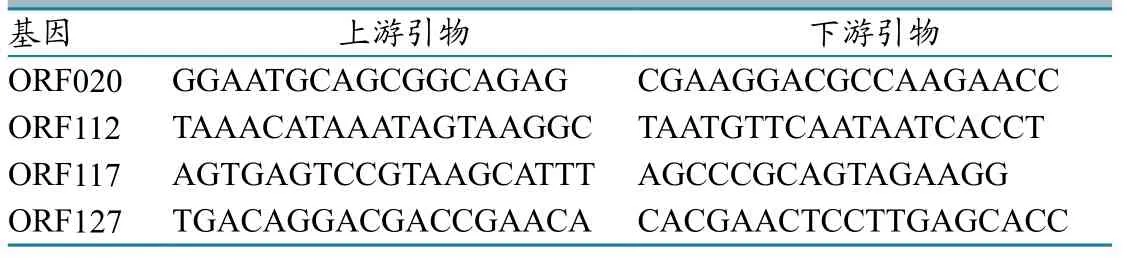
表1 含有毒力的基因及其特异引物
1.6 PCR扩增及产物回收
在ORFV/QD/2015株与传90代产生稳定病变分离株的细胞培养液中提取病毒DNA。以提取的病毒DNA为模版,用2×Easy Taq Super Mix试剂盒配制 25 µL普通PCR反应体系:2×Easy Taq Super Mix 12.5 µL, 上 游 引 物(10 µmol/L)1 µL,下游引物(10 µmol/L)1 µL,c DNA 模板1 µL,dd H2O 9.5 µL。PCR 扩增反应时退火条件为:ORF020:59 ℃ 45 s;ORF112:51.1 ℃ 45 s;ORF117:55 ℃ 45 s;ORF127:57 ℃ 45 s。
1.7 基因测序及生物信息学分析
将电泳检测结果中条带最亮的样品送至上海生工生物工程股份有限公司测序。用DNA Star软件将测序结果拼接,并用其中的Edit Seq软件和MegAlign软件,将强弱毒株相关毒力基因序列与网上已经公布的序列进行比对,用DNAMAN软件分析强毒株ORFV/QD/2015株与传90代毒株的变化。
2 结果
2.1 强毒株与传90毒株4组毒力有关基因的扩增成功扩增出强毒株与QD90株020、112、
117、127毒力相关基因扩增片段,目的片段大小与预期相符(表2、图1)。

表2 扩增出的毒力相关基因目片段大小

图1 QD强毒株与传90代毒株基因目的片段PCR扩增结果
2.2 强毒株与传90代毒株与已公布毒株相关毒力基因核苷酸同源性对比
将ORFV/QD/2015强毒株与传90代后毒株质粒测序结果的核苷酸与Genebank公布的9组ORFV全基因序列中的ORF020、ORF112、ORF117、ORF127基因核苷酸进行比对。结果显示:ORFV/QD/2015强毒株ORF020基因与9组公布基因的相应核苷酸序列同源性为97.2%~99.1%,而传90代毒株ORF020基因相应核苷酸序列同源性为96.9%~98.9%(图2);ORF112基因与9组基因的相应核苷酸序列同源性为93.1%~95%,传90代 后 毒 株 则 为92.8%~94.9%( 图3);ORF117基因与7组基因的相应核苷酸序列同源性为96.1%~98.9%,而传90代后毒株相应核苷酸序列同源性为95.5%~96.7%(图4);ORF127基因与9组基因的相应核苷酸序列同源性为95.5%~97.9%,而传90代后毒株相应核苷酸序列同源性为93.9%~95.7%(图5)。
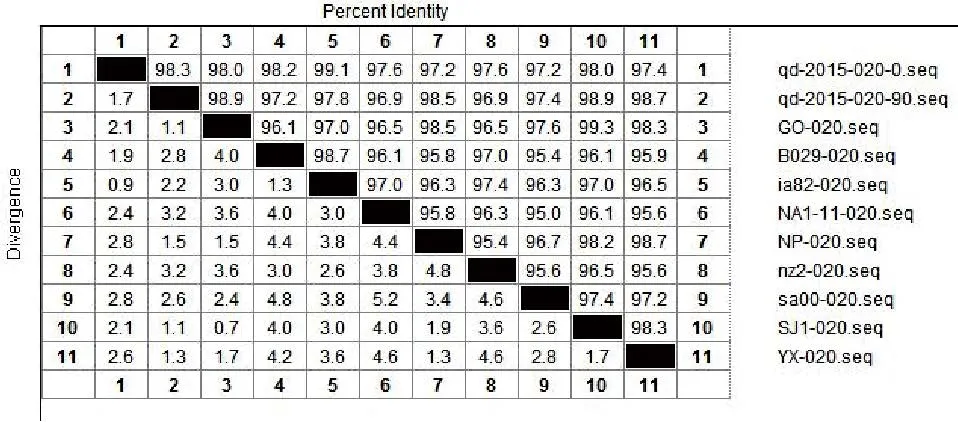
图2 QD强毒株与传代90代毒株ORF020基因核苷酸同源性分析结果
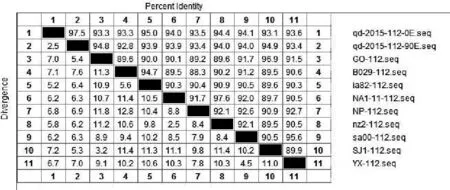
图3 QD强毒株与传代90代毒株ORF112基因核苷酸同源性分析结果
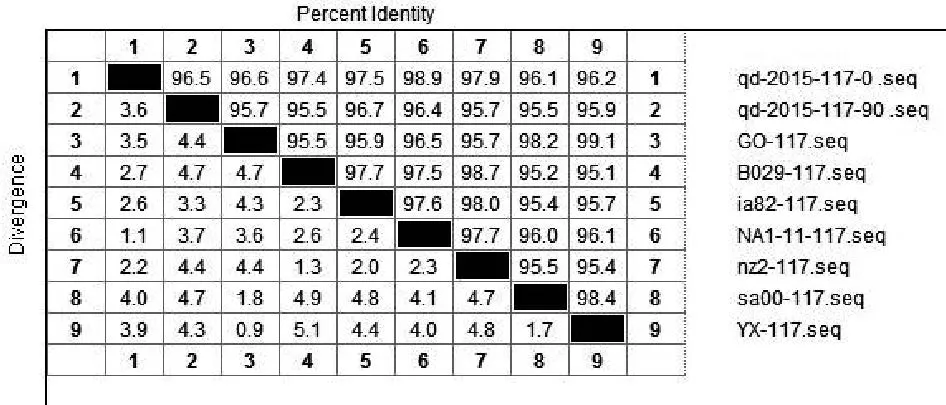
图4 QD强毒株与传代90代毒株ORF117基因核苷酸同源性分析结果
2.3 强毒株与传90代毒株毒力相关基因的氨基酸序列比对
根据测序结果,用DNA Star软件推导出ORFV/QD/2015强毒株与传90代毒株间各毒力相关基因对应的编码氨基酸序列,并与其他毒株毒力相关基因进行比对分析。
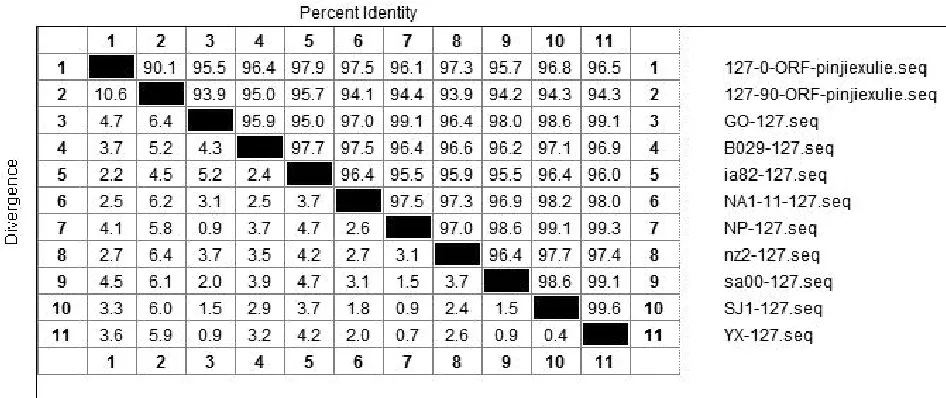
图5 QD强毒株与传90代毒株ORF127基因核苷酸同源性分析结果
结果显示,两个毒株的ORF020基因推导出的编码氨基酸个数均为181个,且发生了7处变异(图6);两个毒株的ORF112基因推导出的编码氨基酸个数均为278个,且发生了52处变异(图7);两个毒株的ORF117基因推导出的编码氨基酸个数均为265个,并发生了14处变异(图8);两个毒株的ORF127基因组推导出的编码氨基酸个数均为186个,并发生了15处变异(图9)。

图6 QD强毒株与传90代毒株及其他公布毒株的ORF020基因氨基酸序列比对结果
2.4 蛋白抗原指数分析

图7 QD强毒株与传90代毒株及其他公布毒株的ORF112基因氨基酸序列比对结果

图8 QD强毒株与传90代毒株及其他公布毒株的ORF117基因氨基酸序列比对结果
运用DNA Star中的Protean软件,分析QD强毒株与传90代毒株间各毒力相关基因编码蛋白的抗原指数。抗原指数分析表明,4组毒力相关基因的抗原指数较高,说明抗原性较好。强毒株与传90代毒株间的抗原指数发生了明显变异(图10)。

图9 QD强毒株与传90代毒株及其他公布毒株的ORF127基因氨基酸序列比对结果

图10 QD强毒株与传90代毒株之间抗原指数的比较
3 讨论与结论
在病毒感染早期,ORF020作为毒力因子能够抑制宿主干扰素(IFN)诱导的dsRNA依赖的酶的激活,从而阻止IFN诱导的病毒蛋白翻译的终止,即可抑制干扰素的抗病毒机制[9]。ORF112(CBP)是早期表达的病毒复制编码产物[10-11]。GIF是ORF117编码的蛋白,是病毒感染晚期表达的蛋白,能够抑制宿主免疫活性,在机体的抗病毒感染过程中发挥着相当重要的作用[12]。ORF127是ORFV作为痘病毒科中唯一一个发现含有IL-10编码基因的病毒。该基因也是病毒感染早期表达的基因之一[13]。
从相关毒力基因的角度出发,本试验提取强毒株ORFV/QD/2015与传90代毒株的4组与毒力相关的的基因组DNA,通过扩增ORF020、ORF112、ORF117和 ORF127的 目 的 基 因, 并对PCR扩增产物进行测序,通过测序找出两毒株相同毒力基因片段,并分析其对应关系。ORFV/QD/2015强毒株与传90代毒株的质粒测序结果与Genebank公布的9组ORFV全基因序列中的ORF020、ORF112、ORF117、ORF127基因的比对结果显示,强毒株的4组毒力相关基因同源性比传代毒株的同源性高,传90代毒株的这4组毒力相关的基因发生了明显变异。这个变化可能导致病毒致弱,后续将进行攻毒试验,以验证传90代毒株的毒力是否致弱。ORFV毒力相关基因的变异可能与其毒力有很大联系,这个变化可能与传代过程中基因发生多处变异有关,也可能是这些毒力基因共同作用的结果。在今后,制备ORFV弱毒疫苗是否可以根据这几个主要毒力基因的变异去研究,还有待进一步验证。
[1] 黎摄儿. 羊传染性脓疱病毒(ORFV)不同毒力毒株功能基因比较基因组学的相关研究[D]. 长沙:湖南农业大学,2014.
[2] 赵魁. 羊传染性脓疱病毒重组DNA疫苗的构建与实验免疫研究[D]. 长春:吉林大学,2010. 11-12.
[3] MARTINS M,CARGNELUTTI J F,WEIBLEN R,et al. Pathogenesis in lambs and sequence analysis ofputative virulence genes of Brazilian Orf virus isolates[J].Veterinary microbiology,2014,174(1/2):69-77.
[4] 张佳纯. 快速筛选重组羊口疮病毒NA1/11Δ132以及构建表达EV71 VP1蛋白的重组羊口疮病毒NA1/11-VP1[D]. 广州:南方医科大学,2016.
[5] 刘媛. IL-2基因佐剂对羊口疮病毒核酸疫苗免疫效果的影响研究[D]. 贵阳:贵州大学,2016.
[6] 成伟伟,张克山,刘永杰. 羊传染性脓疱病毒基因组结构和主要基因功能研究进展[J]. 动物医学进展,2014,35(7):82-85.
[7] MERCER A A,UEDA N,FRIEDERICHS S M,et al. Comparative analysis of genome sequences of three isolates of Orf virus reveals unexpected sequence variation.[J]. Virus research,2006,116(1/2):146-158.
[8] 涂明亮. 羊口疮病毒生物学特性研究[D]. 呼和浩特:内蒙古农业大学,2016.
[9] MERCER A,HAIG D. Parapoxviruses(Poxviridae)[J]. Encyclopedia of virology,1999,18(2):1140-1146.
[10] LI J,SONG D,HE W,et al. Rapid detection of Orf virus by loop-mediated isothermal amplification based on the DNA polymerase gene[J]. Archives of virology,2013,158(4):793-789.
[11] 庞方圆,高日明,李旭东,等. 羊口疮病毒的分离与鉴定[J]. 中国畜牧兽医,2015,42(2):467-471.
[12] 刘永杰,张克山,孔汉金,等. 羊传染性脓疱诊断技术研究进展[J]. 动物医学进展,2013,34(2):96-99.
[13] 刘其昌,宋德荣,彭华,等. 羊口疮研究进展[J]. 当代畜牧,2015(6):79-80.

