黄瓜白粉菌基因组DNA 提取方法比较
柳利龙 , 张爱琴 , 张 环
(1.甘肃省农业科学院畜草与绿色农业研究所,甘肃 兰州 730070;2.甘肃省农业科学院农业质量标准与检测技术研究所,甘肃 兰州 730070)
黄瓜白粉病又称粉霉病、白毛病,是严重危害黄瓜的主要病害之一,具有潜伏期短、再侵染频繁、流行性强和周年发生等特点[1-3]。其主要为害叶片,影响叶片的光合作用,故通常在黄瓜生长过程中、后期发病重,造成黄瓜减产,甚至造成提前拉秧[4]。果实感染后不能正常膨大,呈瘦长形[5],丧失商品价值。黄瓜白粉病病菌有2种,包括单囊壳白粉菌{Podosphaera xanthii[Sphaerotheca fuliginea(Schlecht)poll]}和二孢白粉菌[Golorinomyces cichoracearum(Erysiphe cichoracearum D C)],我国黄瓜上多以单囊壳白粉菌Podosphaera xanthii为主[6]。2种白粉菌均属于子囊菌,都是严格的专性寄生菌,寄主范围广泛,主要集中在黄瓜、西葫芦、西甜瓜和南瓜等葫芦科作物[3,7-9]。因其无性阶段与报道的其他瓜类白粉菌结构非常相似,并且有性阶段的闭囊壳不易产生,所以给病原物的分类、鉴定工作造成较大的困难[10]。因此,若要有效防治黄瓜白粉病,澄清其病原体的种类将非常重要。
近年来,随着分子生物学的发展,用提取白粉病病原菌无性生殖阶段个体(分生孢子和菌丝)基因组DNA来鉴定、区分形态高度相似的白粉病病原菌,已成为重要的鉴定手段,其在形态鉴定基础上,不仅提高了鉴定的准确性,还缩短了鉴定时间[10]。在分子生物学鉴定病原菌工作中,DNA提取至关重要。目前,基于白粉菌基因组DNA提取方法方面的研究较多。刘建利等[10]利用Chelex-100法建立了快速提取甜瓜白粉菌基因组DNA的高效方法;万三连等[11-12]用3种方法提取了橡胶白粉菌基因组DNA,DNA产量OMEGA试剂盒法最高,生工生物试剂盒法最低,CTAB法介于两者之间;龚双军等[13]采用改进破壁法、液氮研磨法和溶菌酶消化法进行破壁,利用改良CTAB法提取微量小麦白粉菌基因组DNA,改进的破壁方法获得的DNA收率大且纯度高;朱海荣等[14]利用4种方法提取相同质量小麦白粉菌基因组DNA,结果显示提取率由大到小依次为改良CTAB法、电钻微量研磨一管法、FastPrep DNA试剂盒法、Chelex-100法。基于黄瓜白粉菌基因组DNA提取方法的比较研究报道较少。黄瓜白粉菌为专性寄生菌,病菌须在活体上保存、培养和繁殖,而且在繁殖过程中易受寄主生长条件等因素的影响,收集足以提取DNA的孢子需花费较长的时间长且工作量大,筛选或开发出用尽可能少的孢子提取出高质量DNA的方法至关重要。我们利用改良CTAB法、SDS法和真菌试剂盒法提取黄瓜白粉菌基因组DNA并进行了比较,以期筛选出提取黄瓜白粉菌基因组DNA的最佳方法,为黄瓜白粉菌的分子生物学研究、系统发育分析及抗药性分子机理等研究提供相应的参考。
1 材料与方法
1.1 试验材料
供试品种:黄瓜品种“皇家101F1油亮型密刺黄瓜”(山东华诺种业有限公司),购于甘肃省农业科学院种子市场。
供试菌株:黄瓜白粉病菌采自实验室内培养发病的黄瓜植株叶片。
供试药剂:CTAB法提取缓冲液A(1.00 mol/L Tris-HCl, 0.50 mol/L EDTA, 20 g/L CTAB, 1.4 mol/L NaCl, pH 8.0); SDS 法提取缓冲液B(0.05 mol/L Tris-HCl, 0.18 mol/L EDTA,10 g/L SDS,pH 8.0)。以上提取缓冲液均用无菌水配制,置于4 ℃冰箱备用。
1.2 试验方法
1.2.1 黄瓜白粉菌分生孢子收集 将黄瓜白粉菌分生孢子加入盛有0.5%十二烷基硫酸钠(SDS)水溶液中,在10×10倍显微镜下镜检使其浓度为每个视野约50~60个分生孢子。采用涂布法接种,将配制的孢子悬浮液均匀地涂抹在植株的所有子叶和真叶上[15],接种量至每个叶片上都布满孢子悬浮液为宜。然后将接种的幼苗置于温度为25 ℃、RH 60%、光照12 h和光照强度为4 400 Lx的光照培养箱中培养,培养14 d后,待叶片上产生大量分生孢子时在超净工作台上收集白粉孢子。将已发病的黄瓜叶片慢慢用镊子从培养基上取下放在琉璃纸上,轻轻用镊子敲打2~3次,抖落大量的分生孢子后,再用细毛笔刷掉叶片上剩余的分生孢子,最后将收集到的所有白粉孢子刷进2 mL离心管中(可多次收集,每管中可分装50~100 mg白粉孢子),每收集完一批,将超净工作台用酒精擦拭灭菌,打开紫外灯并风吹10 min,以保证菌种间不互相污染。将收集完孢子的离心管置于干燥器中干燥3~5 d,置于-20 ℃冰箱中保存备用。
1.2.2 黄瓜白粉病菌DNA的提取 改良CTAB法[16-17]。称取黄瓜白粉菌分生孢子0.6 g于灭菌的研钵中,加入适量石英砂和液氮迅速研磨,重复2~3次,使成细粉末状。用灭菌的钥匙将研磨后的分生孢子粉末转入1.5 mL离心管,依次加入750 μL DNA 提取缓冲液 A、 65 μL 10%CTAB、150 μL 2.5 mol/L NaCl、 50 μL 10%SDS 溶液, 反复颠倒离心管使其混匀(动作轻缓),在65 ℃条件下水浴1 h,期间轻轻震荡3~4次。从水浴锅中取出离心管,室温下12 000 r/min离心8 min,取上清液于另一离心管中,并记录体积。上清液中加入等体积的氯仿·异戊醇,12 000 r/min室温下离心10 min,取上清液于另一离心管中,重复抽提1次。在上清液中加20 μL RNase酶,37 ℃水浴1 h;加入等体积的预冷无水乙醇,置于-20 ℃冰箱中3 h或过夜,沉淀DNA。取出离心管,12 000 r/min室温下离心15 min,弃上清液。用70%乙醇和无水乙醇各洗1次(去除残杂),在超净工作台上风干(40~60 min);加入50 μL TE缓冲液溶解DNA,放入-20℃储存或放入4 ℃下待用。
SDS法[18]。称取黄瓜白粉菌分生孢子0.6 g于灭菌的研钵中,加入适量石英砂进行研磨,使成细粉末状。用灭菌的钥匙将研磨后的分生孢子粉末转入2 mL离心管中,加入700 μL DNA提取缓冲液B,涡旋震荡8~10 min,每隔30 s上下晃动10 s。在65 ℃条件下水浴90 min,期间轻轻颠倒离心管4~5次,加入600 μL 7.5 mol/L NH4AC,冰浴10 min。取出离心管于12 000 r/min,室温下离心5 min,取上清液。上清液中加入1/10体积NaAC 3 mol/L和0.6倍体积预冷异丙醇,轻轻颠倒管子以混匀,冰浴20 min;12 000 rpm,室温下离心5 min,取沉淀。取200 μL TE缓冲液溶解沉淀,加入适量RNase酶,37 ℃条件下水浴1 h。加入200 μL氯仿·异戊醇,取上清液于1.5 mL离心管,重复抽提1次。上清液加入1/10体积NaAC 3 mol/L 和2.5倍体积的预冷无水乙醇,最大转速离心8 min,弃上清液。用75%乙醇和无水乙醇各洗1次去除残杂,在超净工作台上风干(40~60 min)。加入50 μL TE缓冲液溶解DNA,放入-20 ℃下储存或放入4 ℃下待用。
真菌试剂盒提取法,具体步骤参照DNA Fungal DNA Kit使用说明书。
1.2.3 提取DNA的琼脂糖凝胶电泳检测 将50×TAE缓冲液稀释成1×TAE缓冲液来制备1.0%琼脂糖凝胶(含0.5 μL/mL溴化乙锭),电泳鉴定提取的DNA。取5 μL DNA,加入3 μL溴酚蓝混匀,然后在1.0%琼脂糖凝胶上电泳,一侧加Marker(上海生工生产的DNA Marker D,分子量分别为 2 000、 1 000、 750、 500、 250、 100 bp)为分子量对照,于100 V下电泳30 min,在紫外光(254 nm)下观察抽提结果,然后在凝胶成像系统中观察并拍照。
1.2.4 DNA质量体积分数及提取率计算 各取3 μL DNA稀释(稀释倍数为10),以稀释所用超纯水为对照,用CARY-50(Varian,美国)分光光度计测其在260 nm和280 nm波长处的光吸收值、R值(在1.8~2.0为高质量 DNA)[11,19-20]。
DNA 质量体积分数(μg/mL)=OD260×50×稀释倍数
总DNA量(μg)= DNA浓度(μg/mL)×体积(mL)
DNA产量(μg/g)=总DNA量(μg)/菌重量(g)
R=A260/A280表示DNA在波长260 nm和280 nm处的吸光值比值。
2 结果与分析
2.1 DNA琼脂糖凝胶电泳检测结果
通过3种方法提取黄瓜白粉菌基因组总DNA,观察白粉菌DNA电泳检测条带,结果表明,真菌试剂盒法提取的白粉菌DNA电泳检测条带(图1 A,B,C)暗,杂质较多,有拖尾现象;SDS法提取的白粉菌DNA电泳检测条带(图1D,E,F)较亮,但杂质较多,且部分有降解,出现拖尾现象;CTAB法提取的白粉病菌DNA较为完整,电泳检测条带(如图1 G,H,I)清晰,亮度高,基本无拖尾现象。3种方法提取的白粉菌DNA电泳检测条带亮度依次为CTAB法、SDS法、真菌试剂盒法。
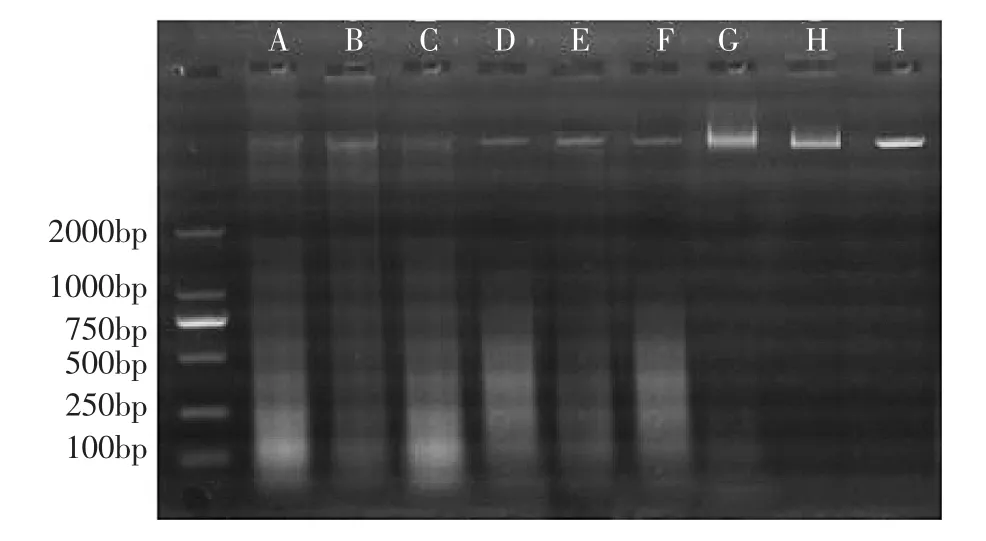
图1 黄瓜白粉病菌基因组DNA凝胶成像电泳图
2.2 DNA浓度及提取产率分析
测定了黄瓜白粉菌DNA的A260和A280,结果表明,3种方法获得的DNA无论从数量还是质量上都有显著区别(表1)。CTAB法和SDS法提取白粉菌DNA质量较高,其R值均大于1.8,分别为1.969 6和1.832 2;而真菌试剂盒法提取得白粉菌DNA质量较低,其R值小于1.8,为1.507 9。用CTAB法提取到的 DNA产量达 204.30 μg/g,比SDS法(产量147.70 μg/g)的效率高出38.3%, 比真菌试剂盒法(产量118.70 μg/g)的效率高出72.1%,且各方法提取的DNA产量之间差异极显著(P<0.01)。综上所述,3种方法提取的白粉菌DNA产量和质量由大到小依次为CTAB法、SDS法、真菌试剂盒法。
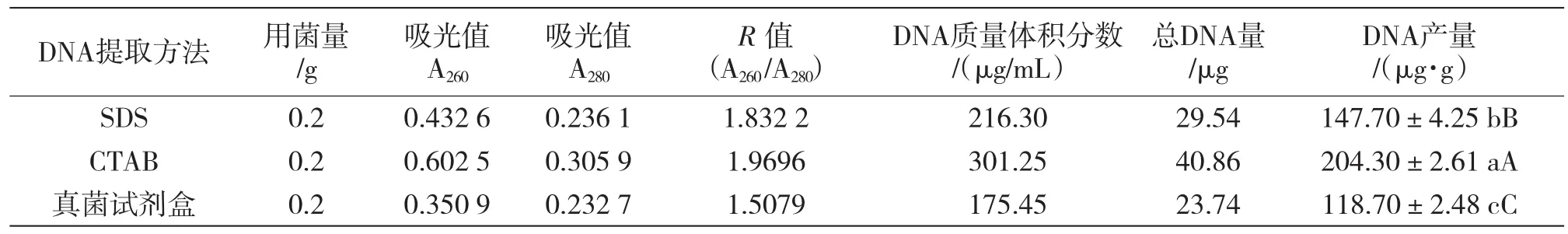
表1 不同方法提取黄瓜白粉菌DNA的测定结果
3 小结与讨论
分别利用改良CTAB法、SDS法和真菌试剂盒法提取了黄瓜白粉菌基因组DNA。通过比较分析,发现利用CTAB法提取的白粉菌DNA效果最佳,其次分别为SDS法和真菌试剂盒法。CTAB法提取的黄瓜白粉菌基因组DNA在纯度(R=A260nm/A280nm)和产量上均优于SDS法和真菌试剂盒法,且杂质少。CTAB法提取的黄瓜白粉菌基因组DNA产率为204.30 μg/g,而SDS法和真菌试剂盒法为147.70 μg/g、 117.70 μg/g, 且方法产率之间差异极显著。采用CTAB法提取的DNA纯度较高为1.969 6,SDS法和真菌试剂盒法较低分别为1.832 2和 1.507 9。
CTAB法在提取白粉菌基因组DNA过程中,研磨之前加入适量石英砂,同时还加液氮进行了速冻,因此破壁效果更好,获得的DNA产量最高,同时整个提取过程中不需多次抽提,步骤简单、成本低、提取的质量高,适合提取黄瓜白粉菌这种菌体较轻、难收集、易飞溅的专性寄生菌的DNA,这与龚双军等[13]、朱海荣等[14]提取小麦白粉菌基因组DNA时筛选出的方法相一致。改进的SDS法提取的黄瓜白粉菌基因组DNA,研磨前只加石英砂进行研磨,同时使用涡旋振荡器充分振荡混匀,虽避免了在提取过程中DNA的损失,但破壁效果较差,导致提取的DNA纯度和产量均较低。真菌试剂盒法破壁方法和CTAB法一样,但提取的DNA产量和质量较CTAB法低,这可能是裂解液的裂解不充分或其他方面的原因而影响了核酸释放。
[1]张圣平,刘苗苗,苗 晗,等.黄瓜白粉病抗性基因的 QTL 定位[J].中国农业科学, 2011, 44(17):3584-3593.
[2]孙中亚.黄瓜白粉病及防治[J].现代农业,2012(5): 65.
[3]周生茂,班美玲,尚小红,等.瓜类蔬菜白粉病及其抗性分子遗传的研究进展[J].浙江农业学报,2013,25(6): 1456-1461.
[4]徐宝星.无公害大棚黄瓜白粉病的防治技术措施[J].河北农业, 2005(5): 14.
[5]刘政兴.大棚温室黄瓜白粉病的发生与防治[J].现代农业科技, 2005(2): 18-19.
[6]刘盼娜.黄瓜茎蔓抗白粉病基因的定位研究[D].北京:中国农业科学院,2016.
[7]XU X, YU T, YU R, et al.Fine mapping of a dominantly inherited powdery mildew resistance major-effect QTL,Pm1.1,in cucumber identifies a 41.1 kb region containing two tandemly arrayed cysteine-rich receptorlike protein kinase genes[J].Theoretical and Applied Genetics, 2016, 129(3): 507-516.
[8]刘秀波,崔 琦,崔崇士,等.瓜类白粉病抗性育种研究进展[J].东北农业大学学报, 2005, 36(6): 794-798.
[9]曲 丽,秦智伟.黄瓜白粉病病原菌及抗病性研究进展[J].东北农业大学学报, 2007, 38(6): 835-841.
[10]刘建利,赵海霞.Chelex-100法快速提取甜瓜白粉病菌基因组 DNA[J]. 北方园艺, 2010(10): 167-169.
[11]万三连,梁 鹏,宋风雅,等.橡胶树白粉菌收集及DNA和RNA提取方法比较[J].广东农业科学,2013(11): 134-139.
[12]毛宇宁,梁 鹏,刘文波,等.橡胶树白粉菌分子检测技术的建立[J]. 植物保护, 2016, 42(4): 119-123.
[13]龚双军,杨立军,刘 辉,等.1种小麦白粉病菌DNA基因组的微量简介提取方法[J].微生物学杂志, 2011,31(1): 24-27.
[14]朱海荣,段霞瑜,周益林,等.小麦白粉病菌基因组DNA的微量提取及ISSR-PCR反应体系的优化[J]. 植物保护, 2010, 36(3): 125-129.
[15]司乃国,刘君丽.新型广谱杀菌剂烯肟菌胺//中国植物病害化学防治研究研究(第四卷)[C].北京:中国农业科学技术出版社,2004:37-42.
[16]江 洁,杜连祥,路福平,等.基因工程菌里氏木霉染色体 DNA的提取方法[J].生物技术,2004,14(2): 24-26.
[17]NIU C, KEBEDE H,AULD D L, et al.A safe inexpensive method to isolate high quality plant and fungal DNA in an open laboratory environment[J].African Journal of Biotechnology, 2008, 7(16): 2818-2822.
[18]迟文娟.东北小麦白粉病菌群体遗传结构与分子检测技术研究[D].沈阳:沈阳农业大学,2009.
[19]奥斯伯F,金斯顿R E,塞得曼J G,等.精编分子生物学实验指南[M].颜子颖,王海林,译.北京:科学出版社,1998:831-833.
[20]刘 丹,刘太国,张 敏,等.小麦光腥黑粉菌冬孢子总DNA提取方法比较[J].植物保护,2006,32(2): 93-95.

