微血管内皮细胞对小鼠造血干细胞增殖的影响
钱 怡,杨 敏,林凡莉,汪姝玥,李晓明,黄纯兰
(西南医科大学附属医院血液内科,四川泸州 646000)
造血干细胞(hemopoietic stem cells,HSCs)存在于造血组织,具有高度的自我更新能力和多向分化潜能,是所有成熟血细胞的前体细胞。造血干细胞移植(hematopoietic stem cell transplantation,HSCT)是治疗恶性血液病、遗传性疾病及免疫缺陷病的重要手段之一。骨髓微环境对于HSCs的增殖、分化、迁移及归巢等具有重要的调控作用[1]。HSCT并非仅仅是单纯的HSCs输注,还包括骨髓基质细胞和其他造血调节因子的同时输注,以便更好、更快地重塑造血系统和免疫系统。然而,人骨髓中HSCs比例较低,极大地限制了HSCT的发展和临床应用。本文通过研究微血管内皮细胞(microvascular endothelial cells,MECs)对HSCs增殖的影响,建立一种促进HSCs增殖的方法。
1 材料与方法
1.1材料
1.1.1实验动物 体质量20~25 g,4~6周龄,雄性或雌性,无特殊病原体(SPF)级C57BL/6小鼠(购自成都达硕生物科技有限公司)和C57系GFP小鼠(购自重庆腾鑫生物公司)。
1.1.2主要仪器与试剂 CO2培养箱(Thermo Forma公司),超净工作台(Air Tech公司),台式离心机(Bioridge公司),倒置荧光显微镜及照相系统(Olympus公司),流式细胞仪(BD公司),质谱(MS)分离柱、mini MACS磁珠分选装置、CD117细胞分选试剂盒、小鼠白细胞介素(IL)-3、小鼠干细胞因子(SCF)、异硫氰酸荧光素(FITC)标记的兔抗鼠CD31(CD31-FITC)及藻蓝蛋白(APC)标记的CD117(CD117-APC)购自Miltenyi Biotec公司,血管内皮生长因子(VEGF)购自ACRO公司,Ⅰ型胶原酶、明胶粉购自Sigma公司,藻红蛋白标记的兔抗鼠CD34(CD34-PE)及多甲藻黄素叶绿素蛋白(PerCP)标记的CD45(CD45-PerCP)购自BD公司,羊抗八因子相关抗原(vWF)多克隆抗体、FITC标记的驴抗羊IgG(IgG-FITC)购自Abcam公司,Ficoll分离液购自TBD公司,DMEM-F12购自南京三生生物公司。
1.2方法
1.2.1MECs分离、培养及鉴定
1.2.1.1MECs的培养 MECs使用添加有20%胎牛血清(FBS)、2 ng/mL VEGF、100 U/mL肝素、0.1 mg/mL青霉素及链霉素的DMEM-F12完全培养基进行培养。
1.2.1.2MECs的分离与培养 颈髓离断处死小鼠,75%乙醇浸泡约5 min。逐层剪开胸腔,剥离肺组织外的脏层胸膜,剪取肺叶组织,除掉可见的支气管和大血管。剪碎肺组织至1 mm左右,装入离心管。加入与组织等量的含2%牛血清蛋白(BSA)和0.1%Ⅰ型胶原酶的消化液,吹打混匀,37 ℃摇床消化。每5分钟吹打1次,共消化约30 min。加入FBS和DMEM-F12终止消化,过200目滤网。300×g离心10 min,弃上清液。加入DMEM-F12重悬,400×g离心10 min,弃上清液,用DMEM-F12完全培养基重悬。经细胞计数及活力测定。以1×106个/cm2密度接种于0.1%明胶包被的24孔板,置于37 ℃、5% CO2、95%湿度培养箱培养。培养24 h后进行首次全量换液,此后每2~3天换1次,逐日显微镜下观察。0.25%胰蛋白酶消化“铺路石”样贴壁细胞用于流式细胞仪(FCM)鉴定和共培养。
1.2.1.3免疫荧光鉴定 第8天24孔板中的细胞2孔,设对照孔、实验孔,磷酸盐缓冲液(PBS)洗涤后加4%多聚甲醛200 μL,室温固定15 min。去掉多聚甲醛,PBS洗涤2次,加入5% BSA封闭30 min。实验孔加5 μL CD31-FITC和45 μL PBS,对照孔加50 μL PBS,4 ℃冰箱避光孵育10 min。PBS洗涤后加100 μL 0.2% Triton X-100溶液,混匀,5 min后PBS洗涤。加入5 μL 4′,6-二脒基-2-苯基吲哚(DAPI)和100 μL PBS,混匀,避光孵育3 min,PBS洗涤。荧光显微镜下观察采图,随机选取3个视野(×200),计算阳性细胞百分率。
1.2.1.4流式鉴定 设对照管、实验管1、实验管2、实验管3,均加上述制备的细胞悬液200 μL(细胞数大于1×105个)。对照管加IgG-FITC、IgG-PE、IgG-PerCP各5 μL,实验管1加5 μL CD31-FITC,实验管2加5 μL CD34-PE,实验管3加5 μL CD45-PerCP,混匀,4 ℃避光孵育15 min。PBS洗涤,200×g离心5 min,去上清液。400 μL PBS重悬上机检测。
1.2.1.5vWF-FITC 流式鉴定 设置对照管、实验管,均加备用细胞悬液200 μL。离心后加200 μL 0.4%多聚甲醛重悬,室温下固定20 min,PBS洗涤离心后加200 μL 0.2%皂素溶液重悬,静置20 min,PBS洗涤离心。200 μL PBS混匀细胞。实验管加4 μL羊抗vWF多克隆抗体,对照管加4 μL羊IgG,室温孵育30 min。PBS洗涤离心后200 μL PBS重悬,加4 μL驴抗羊IgG-FITC,室温避光孵育20 min。洗涤,400 μL PBS重悬上机检测。
1.2.2GFP小鼠骨髓HSCs的分离、鉴定
1.2.2.1密度梯度离心与磁珠分选 颈椎脱臼法处死小鼠,置于75%乙醇中浸泡约5 min。逆向解剖法剥离股骨、胫骨,PBS冲洗。剪去骨端约2 mm,暴露髓腔。1 mL注射器插入骨髓腔,用PBS反复冲洗髓腔至发白,冲出的骨髓收集于离心管,过200目滤网。离心去上清液,加1 mL PBS重悬,混匀。加2 mL复温的Ficoll分离液(1.084 g/mL)于离心管,加样枪沿管壁缓慢加入上述细胞悬液。20 ℃ 400×g离心30 min。收集中间云雾层(即单个核细胞层),以1∶3比例加入PBS稀释,制成细胞悬液,400×g离心10 min,弃上清液,重复1次。经活力测定及计数。加入预冷Buffer[0.5% BSA、2 mmol/L乙二胺四乙酸(EDTA)、PBS]3 mL,吹打混匀,22 ℃ 300×g离心10 min,弃上清液。按照每1×108个MNCs用80 μL预冷Buffer重悬,每1×107个MNCs加20 μL CD117微珠标记细胞,混匀,4 ℃冰箱避光孵育15 min。每1×107个MNCs用1 mL Buffer洗涤,300×g离心10 min,去上清液,每1×108个MNCs加入500 μL Buffer重悬。连接MACS分选装置,500 μL Buffer润湿MS柱,骨髓细胞悬液滴入MS柱,收集洗脱细胞。Buffer冲洗MS柱3次,每次500 μL。MS柱移出磁场,加1 mL Buffer,配备活塞加压快速推出滞留在MS柱内的标记细胞,离心管收集。对CD117+细胞进行活力测定并计数,留作流式纯度鉴定和共培养使用。
1.2.2.2FCM检测CD117+细胞纯度及CD117 CD34表达率 设置对照管、实验管1和2。对照管加MNCs悬液200 μL、IgG-APC和IgG-PE各5 μL,实验管1和2均加分选后的阳性细胞悬液200 μL和5 μL CD117-APC,实验管2再加CD34-PE 5 μL,混匀,4 ℃冰箱避光孵育30 min,PBS洗涤离心,加400 μL PBS重悬上机检测。
1.2.3MECs促进HSCs增殖
1.2.3.1HSCs培养基 添加有20% FBS、25 ng/mL SCF、25 ng/mL IL-3、0.1 mg/mL青霉素及链霉素的DMEM-F12完全培养基。
1.2.3.2分组 (1)对照组:HSCs单培养;(2)共培养组:HSCs+MECs。
1.2.3.3细胞准备 (1)MECs:“铺路石”的MECs经胰酶消化后,收集入离心管,PBS洗涤离心。MECs培养基重悬,密度为5.0×104个/mL。(2)HSCs:MACS收获的HSCs,PBS洗涤离心。HSCs培养基重悬,密度为5.0×104个/mL。
1.2.3.4种板与换液 (1)共培养组:MECs接种于24孔板,每孔200 μL,设3个复孔。37 ℃、5% CO2、95%湿度孵箱培养,细胞贴壁后去掉培养基每个复孔均加HSCs悬液200 μL、HSCs培养基300 μL,继续培养。(2)对照组:24孔板,每孔HSCs悬液200 μL、HSCs培养基300 μL,设3个复孔。37 ℃、5% CO2、95%湿度孵箱中培养。每3天半量换液,培养7 d。
1.2.3.5荧光显微镜观察 荧光显微镜下观察生长情况,每天取3个复孔悬浮细胞计数,计算扩增倍数。
1.2.3.6FCM检测共培养组扩增后CD117 CD34表达率 收集MECs组3个复孔HSCs,PBS洗涤离心,400 μL PBS重悬,一式两份,1份加IgG-APC、IgG-PE各5 μL,混匀,作同型对照;另1份加CD117-APC、CD34-PE各5 μL,混匀。4 ℃冰箱避光孵育30 min,PBS洗涤离心,400 μL PBS重悬上机检测。

2 结 果
2.1MECs分离、培养、鉴定
2.1.1MECs原代培养 接种后6 h见贴壁细胞,第3天细胞聚集生长,形成形态大小较一致的细胞簇,第6天相邻细胞突起彼此相连,成“血管样”改变,第14天达80%融合,呈“铺路石”外观,见图1。
2.1.2CD31免疫荧光鉴定 荧光显微镜下,细胞呈绿色,细胞核呈蓝色,见图2;培养第8天阳性细胞百分率为54.5%。
2.1.3MECs流式鉴定 vWF、CD31、CD34、CD45的阳性率分别为81.39%、45.80%、57.48%、0.17%,见图3。
2.2GFP小鼠骨髓HSCs分离、鉴定
2.2.1骨髓HSCs分离 骨髓经密度梯度离心后分4层,中间的云雾层即为MNCs。平均每只小鼠骨髓可获得约1.1×108个MNCs,活细胞率为98%。
2.2.2CD117+细胞回收及纯度 每只小鼠MNCs经MACS分选后可获约4.7×105个CD117+细胞,活细胞率为97%,纯度为99.51%,见图4。

图1 MECs原代培养(×40)

A:DAPI染色图;B:CD31抗体染色图;C:A、B合成图
图2 CD31抗体免疫荧光鉴定(×200)

图3 流式检测MECs 的vWF、CD31、CD34、CD45表达

图4 MACS分选后的CD117+细胞纯度分析
2.3MECs促HSCs增殖
2.3.1对照组和共培养组细胞扩增变化 共培养第0天,两组HSCs计数均为1.00×104个;共培养第7天,对照组、共培养组HSCs计数分别为6.92×104、12.31×104个,见表1。荧光显微镜下观察HSCs生长情况:共培养第2、4、6、7天,共培养组绿色荧光细胞多于对照组,见图5。第1~7天,共培养组与对照组细胞计数的相对变化倍数分别为1.21、1.35、1.50、1.72、1.71、1.75和1.78,两组细胞计数比较,差异有统计学意义(P<0.05),见表1;第4天变化最明显,见图6。对照组第1~7天较第0天的HSCs细胞计数比较:第1天扩增0.99倍(P>0.05),第2~7天扩增倍数分别为1.42、2.30、4.25、5.66、6.45、6.92(P<0.05)。共培养组第1~7天较第0天的HSCs细胞计数比较:第1~7天扩增倍数分别为1.20、1.92、3.45、7.31、9.72、11.28、12.31(P<0.05)。
2.3.2共培养组共培养前后HSCs CD117 CD34共表达率变化 共培养前HSCs CD117 CD34共表达率为75.85%,见图7。共培养后HSCs CD117 CD34共表达率为92.06%,见图8。共培养7天后,共培养组HSCs CD117 CD34共表达率增加。

图5 荧光显微镜下观察HSCs生长情况(×100)
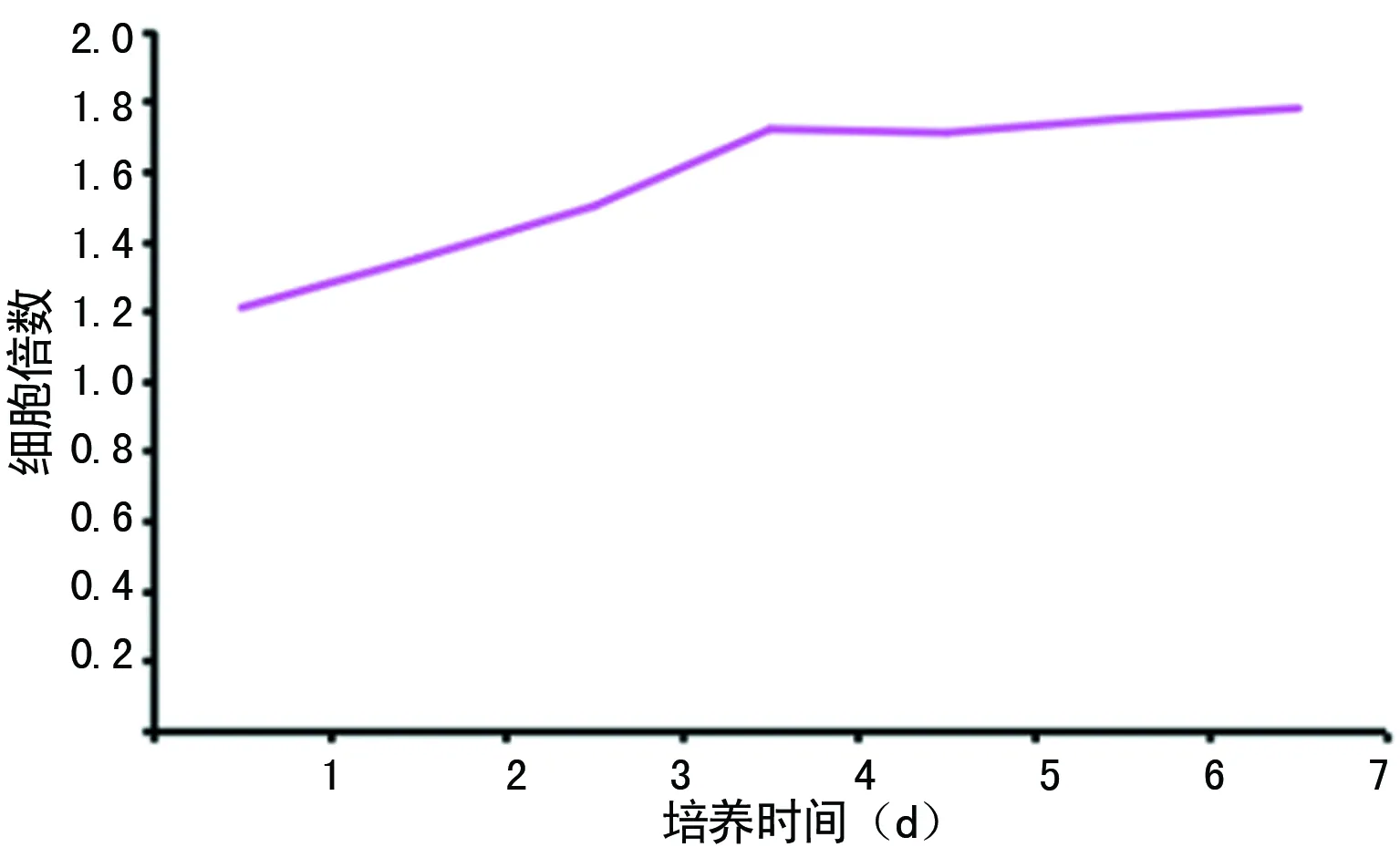
图6 共培养组与对照组HSCs细胞计数的相对变化

图7 共培养前HSCs D117 CD34共表达率流式检测

组别第0天第1天第2天第3天第4天第5天第6天第7天对照组 1.000.99±0.03 1.42±0.022.30±0.064.25±0.205.66±0.126.45±0.14 6.92±0.17共培养组 1.00 1.20±0.04* 1.92±0.45*3.45±0.09*7.31±0.06*9.72±0.12*11.28±0.12*12.31±0.11*
注:**P<0.05,与对照组比较
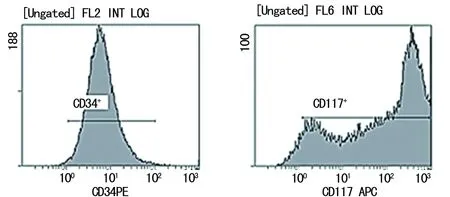
图8 共培养后HSCs CD117 CD34共表达率流式检测
3 讨 论
骨髓龛按照骨髓解剖部位和功能作用差异分为两类:以成骨细胞为主的成骨龛,以内皮细胞(endothelial cells,ECs)为主的血管龛[2]。前者维持HSCs的稳态,后者调控HSC增殖、分化、动员及归巢[3]。然而不同组织来源的ECs生物学特性存在差异。MECs存在于毛细血管、微静脉及微动脉,肺组织含量最多[4],取材简便,因此作为本实验ECs来源。目前ECs鉴定方法主要有3种:细胞形态、细胞抗原标记、细胞器超微结构。W-P小体是代表性的ECs细胞器超微结构,但是该小体会因种属、部位、培养条件、细胞状态的差异而呈现不同的形状和结构,出现概率极低[5-7]。故本实验选用前两种方法鉴定ECs。CD31、CD34、vWF是ECs鉴定较为理想的抗原标记。本实验小鼠肺组织经Ⅰ型胶原酶消化的细胞在培养第6天细胞突起彼此相连,成血管样改变,第14天长至80%融合,呈“铺路石”样。培养第8天的细胞CD31荧光检测阳性率为54.5%。第14天细胞流式检测vWF、CD31、CD34、CD45的阳性率分别为81.39%、45.80%、57.48%、0.17%,符合文献报道[8]。故本实验成功培养出肺MECs。
HSCs主要存在于骨髓龛,目前骨髓分离HSCs的方法主要有免疫磁珠分选和流式细胞分选。免疫磁珠分选法操作简便、快速,MACs分离纯度高达99%,细胞损伤小,可直接用于培养研究和流式检测。CD117即SCF受体,主要表达于造血干/祖细胞。本实验选用CD117作为分选小鼠HSCs免疫标记。每只小鼠骨髓经CD117磁珠分选后可收获4.7×105个阳性细胞,纯度为99.51%,成功分选出骨髓HSCs。
共同起源学说认为血管ECs与早期HSCs都是由胚胎卵黄囊血岛细胞分化而来[9]。激活小鼠ECs中的蛋白激酶B1(AKT1),不仅可以扩增HSCs,还能重建辐射小鼠的造血系统[10]。脑MECs通过胰岛素样生长因子结合蛋白3(IGFBP-3)功能性克隆促进CD34+CD38-HSCs体外增殖[11]。MECs能促进损伤后HSCs的保持和更新[12]。ECs作为脐血细胞的滋养层,可明显增加扩增CD34+CD38-细胞数量[13]。综上研究,ECs会调控HSC增殖、分化、归巢。本研究发现共培养过程中:(1)培养时间增加,两组HSCs数量均增加,MECs组较对照组增加更明显。(2)第1~7天均与第0天对比,共培养组及对照组HSCs均扩增,且共培养组扩增倍数大于对照组,第4天MECs促进HSCs增殖的作用最明显。由此可见,MECs促进HSCs增殖,且第4天最明显。
综上所述,共培养第7天的共培养组悬浮细胞HSCs CD117 CD34共表达率增加,而既往研究发现小鼠年龄和状态会影响HSCs CD34抗原表达。5周龄以下的小鼠,包括胚胎期、新生小鼠,所有的HSCs都表达CD34,7周龄小鼠有CD34-的HSCs,10~20周龄大多数HSCs不表达CD34[14]。小鼠CD34+HSCs与CD34-HSCs可以相互转化,活化状态下的HSCs表达CD34[15],人HSCs CD34抗原表达是可逆的[16]。4~6周龄小鼠HSCs分为CD34+和CD34-群[17]。笔者认为MECs可以促进HSCs CD34表达,但其具体机制需要进一步研究。
[1]MENDELSON A,FRENETTE P S.Hematopoietic stem cell niche maintenance during homeostasis and regeneration[J].Nat Med,2014,20(8):833-846.
[2]ZHAO M, LI L.Regulation of hematopoietic stem cells in the niche[J].Sci China Life Sci,2015,58(12):1209-1215.
[3]MERCIER F E,RAGU C,SCADDEN D T.The bone marrow at the crossroads of blood and immunity[J].Nat Rev Immunol,2011,12(1):49-60.
[4]WINIARSKI B K,ACHESON N,GUTOWSKI N J,et al.An improved and reliable method for isolation of microvascular endothelial cells from human omentum[J].Microcirculation,2011,18(8):635-645.
[5]BLEAU C,FILLIOL A,SAMSON M,et al.Brain invasion by mouse hepatitis virus depends on impairment of tight junctions and beta interferon production in brain microvascular endothelial cells[J].J Virol,2015,89(19):9896-9908.
[6]METCALF D J,NIGHTINGALE T D,ZENNER H L,et al.Formation and function of Weibel-Palade bodies[J].J Cell Sci,2008,121(Pt 1):19-27.
[7]LIU Y,XUE Q,TANG Q,et al.A simple method for isolating and culturing the rat brain microvascular endothelial cells[J].Microvasc Res,2013,90:199-205.
[8]WANG J D,KHAFAGY E S,KHANAFER K,et al.Organization of endothelial cells,pericytes,and astrocytes into a 3d microfluidic in vitro model of the blood-brain barrier[J].Mol Pharm,2016,13(3):895-906.
[9]ROBERTSON S,KENNEDY M,KEL-
LER G.Hematopoietic commitment during embryogenesis[J].Ann N Y Acad Sci,1999,872:9-16.
[10]KOBAYASHI H,BUTLER J M,O′DONNELL R,et al.Angiocrine factors from Akt-activated endothelial cells balance self-renewal and differentiation of haematopoietic stem cells[J].Nat Cell Biol,2010,12(11):1046-1056.
[11]LIU L Q,SPOSATO M,LIU H Y,et al.Functional cloning of IGFBP-3 from human microvascular endothelial cells reveals its novel role in promoting proliferation of primitive CD34+CD38-hematopoietic cells in vitro[J].Oncol Res,2003,13(6/10):359-371.
[12]NOLAN D J,GINSBERG M,ISRAELY E,et al.Molecular signatures of tissue-specific microvascular endothelial cell heterogeneity in organ maintenance and regeneration[J].Dev Cell,2013,26(2):204-219.
[13]ROSLER E,BRANDT J,CHUTE J,et al.Cocultivation of umbilical cord blood cells with endothelial cells leads to extensive amplification of competent CD34+CD38-cells[J].Exp Hematol,2000,28(7):841-852.
[14]OGAWA M,TAJIMA F,ITO T,et al.CD34 expression by murine hematopoietic stem cells.Developmental changes and kinetic alterations[J].Ann N Y Acad Sci,2001,938:139-145.
[15]SATO T,LAVER J H,OGAWA M.Reversible expression of CD34 by murine hematopoietic stem cells[J].Blood,1999,94(8):2548-2554.
[16]DAO M A,AREVALO J,NOLTA J A.Reversibility of CD34 expression on human hematopoietic stem cells that retain the capacity for secondary reconstitution[J].Blood,2003,101(1):112-118.
[17]MOREL F,GALY A,CHEN B,et al.Equal distribution of competitive long-term repopulating stem cells in the CD34+and CD34-fractions of Thy-1lowLin-/lowSca-1+bone marrow cells[J].Exp Hematol,1998,26(5):440-448.

